益生菌干酪乳桿菌FM10-3產胞外多糖培養條件的優化
王英,周劍忠,黃開紅,李清,劉小莉,趙延存
(江蘇省農業科學研究院農產品加工研究所,南京210014)
0 引 言
乳酸菌胞外多糖(Exopolysaccharides,EPS)是乳酸菌生長代謝過程中分泌到細胞壁外的粘液多糖和莢膜多糖的總稱[1-2]。乳酸菌是天然的食品工業中生產菌種,其產生的EPS具有對機體無毒副作用,來源安全可靠等優點,具有較高的安全性,近年來對乳酸菌的EPS的研究和開發引起廣大研究者和食品加工業的重視[3-5],乳酸菌胞外多糖是天然的生物增稠劑,它可以替代其他目前在應用的、來源于非食品級微生物的穩定劑或增稠劑[6]。乳酸菌胞外多糖能提高酸乳的品質,能有效地保持凝膠結構,防止乳清析出[7-8],另外,EPS具有增強免疫力,抗腫瘤,抗病毒等功效[9-10],隨著民眾保健意識的增強,對具有保健功效的功能食品及保健品愈發收到重視。
FM10-3分離自新疆地區傳統酸馬奶中,鑒定為干酪乳桿菌[11]。前期對FM10-3的生物學及發酵特性進行了系統的研究[12],本文對其產EPS的發酵條件進行研究,為將其開發成功能性乳制品的菌種資源提供又一重要依據和技術支持。
1 材料與方法
1.1 材料與試劑
干酪乳桿菌(Lactobacillus casei)FM10-3,本實驗室篩選保藏;MRS培養基按文獻[13]中的方法配制,121℃滅菌20 min。10%的脫脂牛奶,巴氏滅菌。
葡萄糖,檸檬酸氫二銨,K2HPO4,Tween-80,Mg-SO4·7H2O,乙酸鈉,苯酚,濃H2SO4,三氯乙酸,無水乙醇等,均為分析純試劑;酵母提取物、牛肉浸出粉 、酪蛋白胨為生化試劑。
1.2 儀器與設備
恒溫培養箱,生化培養箱,UV-1600PC型分光光度計,超凈工作臺,電熱手提式高壓殺菌鍋,電子天平等。
1.3 方法
1.3.1 干酪乳桿菌的活化與擴大培養
將菌種的凍干粉分別接種到10%的滅菌脫脂牛奶管和液體MRS試管中,與37℃培養24 h,傳代2次。按3%的接種量分別接種到裝有10%的無菌的脫脂牛奶三角瓶和裝有液體MRS的三角瓶中,培養24 h,置冰箱中備用。
1.3.2 胞外多糖的分離提取
胞外多糖的提取參照文獻[14]和[15]并作適當改進。取10 mL發酵液液于離心管中,冷凍離心去除菌體。上清液分別用蛋白酶等處理以脫除蛋白,再添加3倍體積的冷乙醇于上清液中,4℃下靜置過夜。冷凍離心得沉淀物,用冷乙醇洗滌沉淀物數次,再于90℃下干燥得胞外多糖粗提物。
1.3.3 胞外多糖的定量分析
采用苯酚一硫酸法[16]以葡萄糖作標準曲線,490 nm檢測波長。同樣的操作,取1 mL的樣品液,測定490 nm吸收值,由標準曲線計算多糖含量。
1.3.4 產糖條件
具體方法參照文獻[17]中方法,稍作修改。
(1)發酵溫度對胞外多糖產量的影響 培養基起始pH值為6.8、接種量為5%、發酵時間為28 h的前提條件下,研究不同發酵溫度(25,28,31,34,37,40 ℃)對合成胞外多糖產量的影響。
(2)發酵時間對胞外糖產量的影響 在產糖培養基起始pH為6.8、接種量為5%、發酵溫度為37℃的前提條件下,研究不同發酵時間(12,16,20,24,28,32,36,40 h)對胞外多糖產量的影響。
(3)培養基起始pH對胞外多糖產量的影響 在接種量為5%、發酵溫度為37℃、發酵時間為28 h的前提條件下,研究產糖培養基的不同起始pH值(5.5,6.0,6.5,7.0,7.5)對合成胞外多糖產量的影響。
(4)接種量對胞外多產量的影響 在產糖培養基起始pH為6.8、發酵溫度為37℃、發酵時間為28 h的前提條件下,研究不同接種量(2%,3%,4%,5%,6%,7%)對胞外多糖產量的影響。
(5)胞外多糖發酵條件的優化。在單因素試驗結果基礎上,采用中心組合實驗 Box-Behnken設計方案,以培養溫度、接種量以及培養時間,分別用Xl,X2,X3來表示;并以+1,0,-1別代表變量的水平,按方程xi=(Xi—Xo)/△X 自變量進行編碼。 式中,xi變量的編碼值,Xi為變量的真實值,X0驗中心點變量的真實值,△X為變量的變化步長,EPS質量濃度Y為響應值(表1)。

表1 中心組合試驗Box-Behnken方案設計的因素和水平編碼值
2 結果與分析
2.1 發酵溫度對FM10-3 EPS產量的影響
微生物EPS的生成受培養溫度的影響很大,培養溫度的選擇是提高EPS產量的一個重要條件。溫度是影響細胞生長繁殖和EPS產量的重要因素之一,溫度不同,菌株的生長及其EPS產量亦明顯不同。培養溫度過低,菌體生長緩慢,菌體濃度不高,從而影響次生代謝產物EPS的產量;培養溫度過高,菌體培養后期易衰老進而自溶,菌體濃度亦不高,也會影響EPS的合成。FM10-3的EPS產量受培養溫度的影響結果如圖1所示,由圖1可以看出,不同發酵溫度條件下菌株FM10-3合成EPS的量不同,發酵溫度在34℃時EPS產量處于最大值,低于34℃時隨著溫度的升高,EPS產量呈線性增加,但溫度高于34℃時EPS產量開始下降,因此,菌株FM10-3合成胞外多糖的適宜溫度是34℃。

圖1 不同發酵溫度對胞外多糖產量的影響
2.2 發酵時間對合成胞外多糖產量的影響
圖2為發酵時間對FM10-3的EPS產量的影響結果。由圖1可以看出,發酵時間長短對胞外多糖的產量影響較大。在不同的發酵時間菌株FM10-3合成EPS的量不同。發酵時間在28 h時EPS產量處于最大值。在發酵前期,EPS產量較低,這種現象說明在對數生長期由于培養基的營養物質較充足,而有利于菌體生長繁殖,卻不利于胞外多糖的積累。發酵后期,菌體會分泌多糖降解酶而降低胞外多糖的產量。菌株FM10-3合成胞外多糖的適宜發酵時間28 h。

圖2 不同發酵時間對胞外多糖產量的影響
2.3 pH值對合成胞外多糖產量的影響
培養基pH值高低對菌體生長繁殖與次生代謝產物胞外多糖的合成影響也很大,因為發酵液pH值的變化會影響發酵過程中多種酶的活性,當pH值抑制菌體中某些酶的活性時,會阻礙菌體的新陳代謝。pH值不同,引起菌體代謝過程不同,使代謝產物的產量和比例發生改變。許多研究證實,在接近中性偏酸的pH值條件下,EPS生物合成量較大[18]。由圖3可以看出,在培養基不同起始pH值條件下菌株FM10-3合成EPS的量不同。培養基的起始pH值為6.5,即弱酸性條件時,使發酵液中胞外多糖產量達到最大值;培養基的pH值越接近中性偏堿條件,EPS產量越低,當pH值在超過7.5時胞外多糖產量較低;當培養基的pH值過低時,一方面分泌的多糖酶類有降解胞外多糖的作用[19],另一方面pH值的降低會因失去脂質載體中間體而使胞外多糖的合成受阻[20]。綜上所述,合成EPS的培養基適宜pH值為6.5。
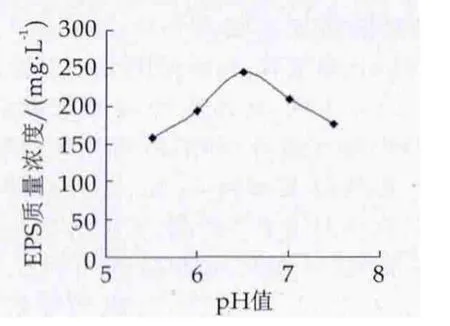
圖3 培養基初始pH值對胞外多糖產量的影響
2.4 接種量對合成胞外多糖產量的影響
圖4為接種量對胞外多糖產量的影響。由圖4可以看出,在試驗設計的發酵時間內,不同的接種量菌株FM10-3合成EPS的量不同。接種量在5%時EPS產量處于最大值;接種量小于4%時EPS的產量處于較低水平;當接種量超過6%時EPS產量急劇下降。這是由于接種量過高,發酵前期會使菌體生長過快、菌體濃度過高,中后期會因營養物質消耗殆盡而導致合成胞外多糖的前體物質的減少,從而降低EPS的產量。綜上所述,菌株FM10-3合成EPS的適宜接種量是5%。
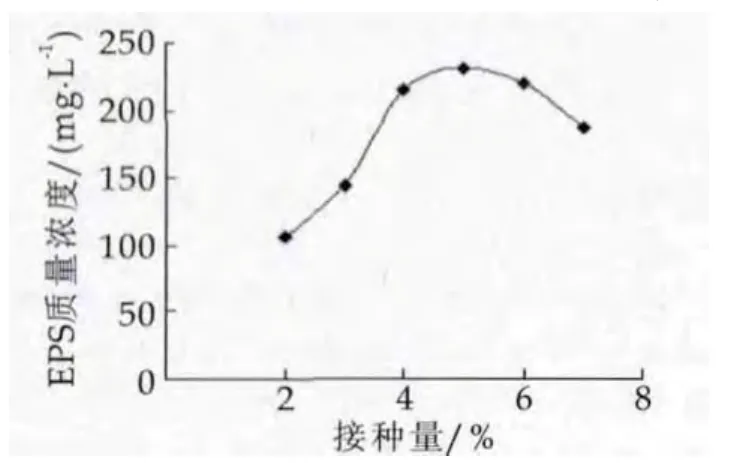
圖4 接種量的影響
2.5 響應曲面實驗結果及分析
按表1列出的實驗組合進行FM10-3培養后提取EPS,獲得各種條件下EPS產量的提取值及其預測值,利用Design Expert軟件,對響應值EPS產量的實驗值進行二次多項回歸擬合,建立EPS產量的回歸模型,回歸模型方程為
REPS產量=312.50+13.33X1+4.29X2+1.87X3+4.35X1X2+3.58X1X3-0.58X2X3-43.23X12-21.16X22-9.41X32。
對此模型進行方差分析結果如表3所示。由表3可以看出,模型在α=0.01水平上回歸極顯著(P<0.001),模型的確定系數R2=0.9993,校正后的決定系數(R2)達到 0.9983,表明二次模型能很好地擬合不同培養條件下EPS產量的變化,失擬項不顯著(P>0.05),從另一角度說明該方程對數據進行了很好的擬合。
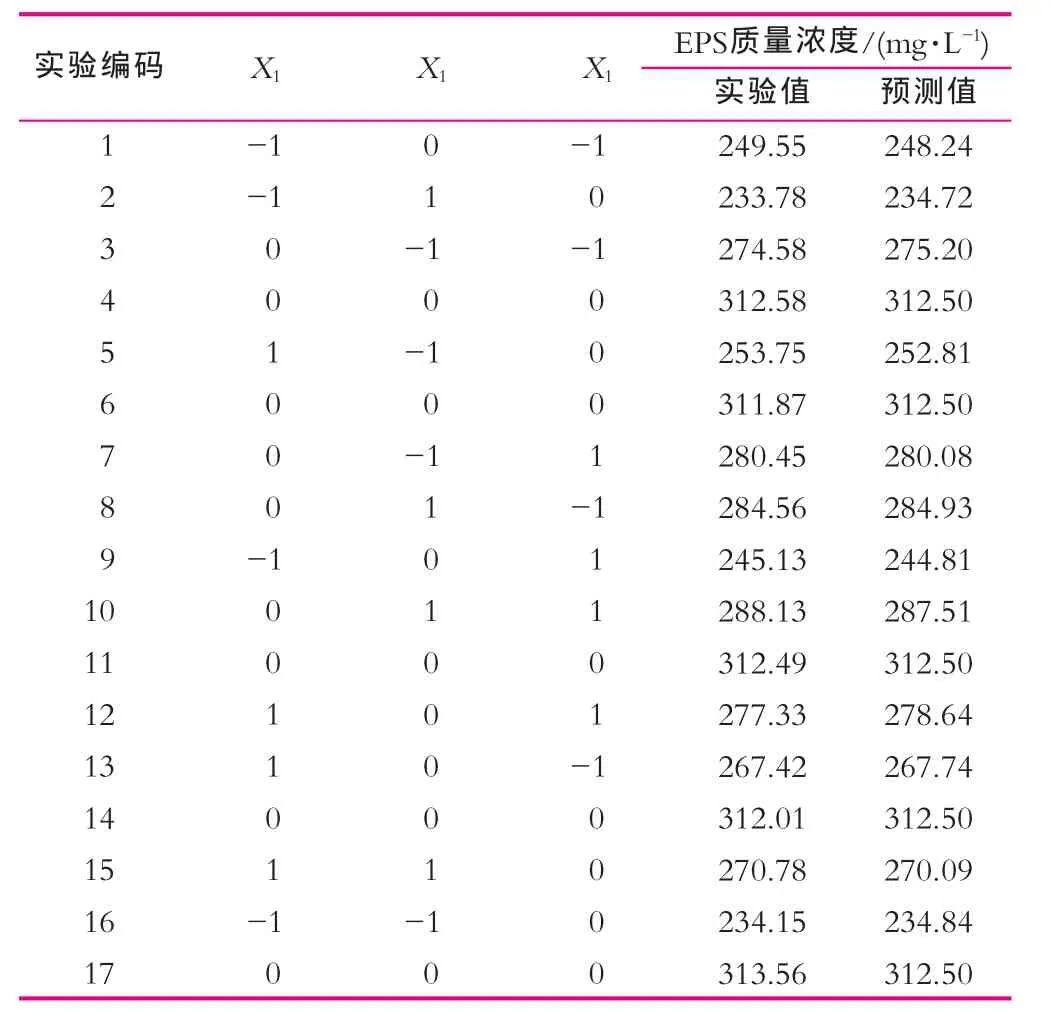
表2 Box-Behnken設計方案及實驗結果
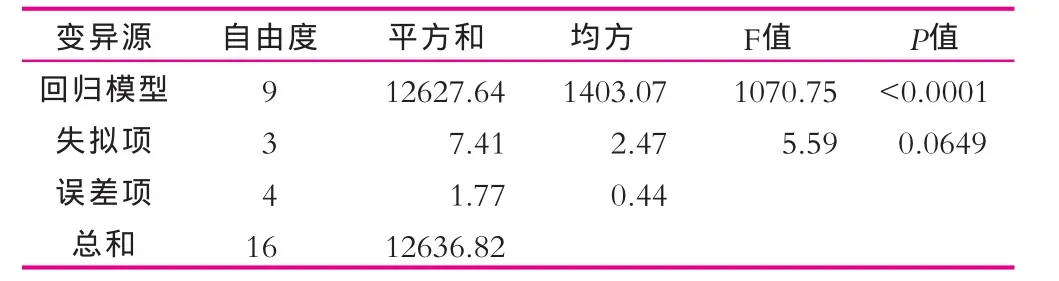
表3 回歸模型方差分析
表4為回歸方程系數顯著性檢驗結果。由表4可以看出,模型一次項X1和X2極顯著,X3顯著;二次項X12,X22,X32均處于極顯著水平;交互項X1X2極顯著,X1X3處于顯著水平、X2X3不顯著。
利用Design Expert軟件對表2數據進行二次多元回歸擬合,所得到的二次回歸方程的響應面及其等高線如圖5~圖7所示。
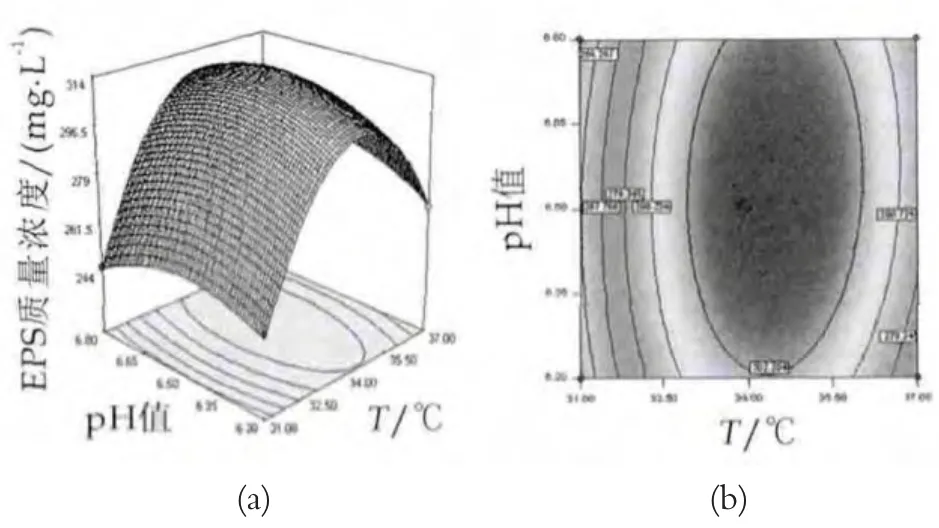
圖6 pH值和溫度對EPS產量影響的響應曲面和等高線
當pH值為6.5時,培養時間和培養溫度對EPS產量的影響如圖5所示。由圖5可以看出,當培養時間不變,EPS產量會隨著溫度的增加而增加,當溫度達到一定值后,EPS產量值呈現下降的趨勢。當培養時間在25~28 h范圍內,培養溫度在31~34℃范圍內,EPS產量值隨著培養時間和培養溫度的增加而增加,并最終達到最大值。
當培養時間為28 h時,pH值和培養溫度對EPS產量的影響如圖6所示。由圖6可以看出,當pH值不變時,隨著培養溫度的增加,EPS產量呈現增加的趨勢,當溫度增加到一定值后,EPS產量值呈現下降的趨勢。當pH值在6.2~6.5范圍內,同時培養溫度在31~34℃范圍內,EPS產量值隨著pH值和培養溫度的增加而增加,并最終達到最大值。

圖7 pH值和培養時間對EPS產量影響的響應曲面和等高線
當培養溫度為34℃時,培養時間和pH值對EPS產量的影響如圖7所示。由圖7可以看出,當pH值不變時,隨著培養時間的延長,EPS產量增加,當時間延長到一定值后,EPS產量值呈現下降的趨勢。當培養時間在25~28 h范圍內,pH值在6.2~6.5范圍內,EPS產量值隨著pH值和培養時間的增加而增加,并最終達到極大值。
2.6 優化組合及驗證實驗
當培養時間、溫度和pH值范圍分別設定在25~31 h,31~37℃和 6.2~6.8時,并將胞外多糖產量設定為最大值時,軟件給出最優組合,即最后優化的產胞外多糖的最優條件為:培養溫度為34.49℃,培養時間為28.35 h,pH值為6.54,此條件下EPS產量為313.973 mg/L。按實際可行設定情況,可設定培養溫度為34.5℃,培養時間為28.4 h,pH值為6.5,作為產EPS的最佳培養條件。為了進一步驗證產EPS的最優的培養條件,采用上述條件進行了3次重復試驗,結果EPS產量在 (313.36±1.35)mg/L,與理論值 313.97 mg/L基本一致。
3 結 論
通過單因素試驗分析干酪乳桿菌FM10-3產EPS的主要影響因素,采用Box-Behnken的中心組合設計及響應面分析,建立干酪乳桿菌FM10-3產EPS二次多項式數學模型。獲得到干酪乳桿菌FM10-3產EPS最佳培養條件為:培養溫度為34.5℃,培養時間為28.4 h,pH值為6.5,在此條件下FM10-3的胞外多糖產量為313.36mg/L。經檢驗證明該模型是合理可靠的,能夠較好地預測干酪乳桿菌FM10-3產EPS的量。
[1]AI L Z,ZHANG H,GUO B H,et al.Preparation,Partial Characterizati0n and Bioactivity of Exopolysaccharides from Lactobacil1us casei LC2W[J].Carbohydrate Polymers,2008,74:353-357.
[2]YANG Z H N,LI S Y,ZHANG X,et a1.Capsular and Slimepolysaccharide Production by Lactobacillus rhamnosus JAAS8 Isolated from Chinese Sauerkraut:Potential Application in Fermented Milk Products[J],Journal of Bioscience and Bioengineering,2010,11(1):53-57.
[3]BADEL S,BERNARDI T,MICHAUD P.New Perspectives for Lactobacilli Exopolysaccharides [J].Biotechnology Advances,2011,29:54-66.
[4]MOSTAFA H,DABA A,EL-MEZAWY A.Screening of potential lactobacilli protein-bound exopolysaccharides[J].Deutsche Lebensmittel-Rundschau,2006,102:62-66.
[5]WANG Y P,LI C H,LIU P,et a1.Physical Characterization of Exopolysaccharide Produced by Lactobacillus Plantarum KF5 Isolated from Tibet Kefir[J].Carbohydrate Polymers,2010,82:895-903.
[6]羅玲泉.增稠劑的復配對酸乳乳清析出的影響研究[J].食品研究與開發,2008,29:136-139.
[7]RUAS-MADIEDO P,HUGENHOLTZ J,ZOON P.An Overview of the Functionality of Exopolysaccharides Produced by Lactic Acid Bacteria[J].Intemational Dairy Journal,2002,12:163-171.
[8]劉慧,熊利霞,易欣欣,等.藏靈菇中高產胞外多糖乳酸菌的篩選及其發酵能的研究[J].食品科學,2007,28(5):21 1-215
[9]LIU C F,TSENG K C,CHIANG S S,et a1.Immunomodulatory and Antioxidant Potential of Lactobacillus Exopolysaccharides[J].J.Sci.Food Agr.,2011,91(12):2284-2291
[10]ABDEL-GAWAD I A,EL-SAYED E M,HAFEZ S A,et a1.Inhibitory Effect of Yoghurt an d Soya Yoghurt Containing Bifidobaeteria on the Proliferation of Ehrlich Ascites Tumour Cells in Vitro and in Vivo in a Mouse Tumour Model[J].Brit.J.Nutr.,2004,92(1):81-86.
[11]朱丹宇,王英,周劍忠,等.酸馬奶中乳酸菌的分離和鑒定[J].江蘇農業科學,2009(1):245-247.
[12]王英,周劍忠,仇小妹,等.益生菌干酪乳桿菌FM10-3生物學與發酵特性分析[J].江蘇農業學報,2013,29(3):654-658.
[13]張剛.乳酸細菌基礎、技術和應用 [M].北京:化學工業出版社,2006:421-422.
[14]SAVADOGO A,CHEIK A,SAVADOGO O P.Identification of Exopolysacccharides-producing Lactic Acid Bacteria from Burkina Faso Fermented Milk Samples[J].African Journal of Biotechnology,2004,3(3):189-194.
[15]ZHEN N Y,EINE H,MIKAEL S.Separation,Purifiation and Characterisation of Extracellular Polysaccharides Produced by Slime-forming Lactococcua act s ssp.Cremoris Strains[J].Intemational Dairy Journal,1999,9(9):631-638
[16]張惟杰.糖復合物生化研究技術(第二版)[M].杭州:浙江大學出版,1999,531-540
[17]王英,黃開紅,李思睿,等.產葡聚糖明串珠菌的分離鑒定及發酵條件研究[J].食品與生物技術學報,2012,31(7),727-732.
[18]劉慧,張紅星,代娟.藏靈菇中嗜熱鏈球菌高產胞外多糖發酵條件的優化研究[J].中國釀造,2007,6:41-45.
[19]劉麗波,劉寧,盂祥晨.影響乳酸菌胞外多糖合成的因素[J].中國乳品工業,2004,32(2):32-35.
[20]JOLLY L,STINGEL E.Molecular Organization and Functionality of Exopolysaccharide Gene Clusters in Lactic Acid Bacteria in Dairy[J].Current Opinion in Biotechnology,2001,11:733-746.

