乳酸菌發酵劑制備發酵乳的特性研究
侯保朝,葛紅娟,趙建云,徐顯睿,單勝艷,李寶磊,馬廣輝,馬一航,李理,李言郡
(1.杭州娃哈哈集團有限公司研究院生物工程研究所,杭州310018;2.東北農業大學食品學院乳品科學教育部重點實驗室,哈爾濱150030)
0 引言
發酵乳的感官品質以及形成良好凝固組織狀態的時間是篩選發酵劑的重要指標。優良的發酵劑菌株應具有適宜的產酸速率,以保證較短的發酵時間,同時不應有大量乳清的析出。此外,乳酸菌菌株能夠產生一定量的黏性物質也是其作為發酵劑的重要因素。研究表明,一些乳酸菌菌株具有產胞外多糖的性質,該物質因其化學結構中含有大量親水基團而具有良好的持水能力,能夠增加發酵乳的黏性、爽滑度,對發酵乳形成穩定的乳化狀態有積極作用[3]。除發酵劑菌株本身的發酵特性外,菌株間的復配比例也會顯著影響發酵乳的品質,其中嗜熱鏈球菌和保加利亞乳桿菌間的復配比例是研究的重點之一[4-6]。
目前,國內發酵乳制品所使用的發酵劑以購買國際通用型直投式發酵劑為主,這一點大大限制了產品的升級換代,因此研發具有自主知識產權的新型發酵劑對乳制品生產企業的長久發展具有重要意義。本研究在大量前期實驗的基礎上,對兩種自主研發的發酵劑的復配比例進行探究,同時,從產酸性能、產香性能、流變性能和持水性能4個方面比較了采用自主研發發酵劑與國際標準發酵制備的發酵乳的優勢和不足。本研究不僅為自主研發發酵劑的產業化提供了理論基礎,同時也為其他乳酸菌發酵劑的開發研究提供了良好的借鑒和指導。
1 實驗
1.1 菌株與培養基
實驗菌株分別為兩種自主篩選及保藏的乳酸菌ST-1、LB-1和一種購自A公司的國際標準直投式發酵劑D-1(對照菌株),以上菌粉均4℃保存。培養基(乳基)采用國際通用酸奶配料,其中非脂類固形物質量分數為8.2%~8.6%,乳脂肪質量分數為1.5%,蛋白質質量分數為2.9%~3%。
1.2 儀器與試劑
iCinac乳品發酵酸化監控儀(AMS SYSTEA),Anton Paar MCR302流變儀,Silverson L5T高速分散機,Eppendorf 5810R離心機,梅特勒MS603電子天平,Agilent氣相色譜6890-質譜5975C聯用儀,市售脫脂乳,分析純氯化鈉。
1.3 不同菌株復配比例發酵乳的制備
取適量乳基,巴氏殺菌(90~95℃,5~10 min),冷卻至43℃。在前期實驗基礎上,ST-1與LB-1分別按1∶1和1∶3的比例進行復配后接種于滅菌乳基中,接種量為5×106mL-1,D-1對照菌株采用相同接種量,混勻后靜置于43℃發酵。發酵過程中監測乳體系pH值變化情況。當發酵液表面有少量水痕,傾斜杯體時發酵液變黏稠,且pH值接近4.5時即可停止發酵。取出,冷卻,放于4℃條件下后酸化12~24 h后,進行相關指標的測定。
1.4 指標測定
1.4.1 發酵過程乳體系pH值測定
自發酵起始開始,每隔20 min記錄發酵乳體系的pH值,同一時間點pH值至少重復測定3次,測定結果取平均值,繪制變化曲線。
1.4.2 發酵乳風味物質測定[7]
1.4.2.1 發酵乳樣品前處理(頂空-固相微萃取法)
取發酵乳樣品10 g至頂空樣品瓶中,加入3 g NaCl,磁力攪拌,樣品瓶用聚乙烯/硅膠膜蓋密封后45℃水浴30 min。待樣品平衡一段時間后,用針頭刺穿膜蓋,使固相微萃取膜(50/30 μm DVB/CAR/PDMS纖維)暴露于頂空處30 min。萃取得到的樣品解析3 min后,進行氣相色譜-質譜(GC-MS)定性及定量分析。
1.4.2.2 GC-MS檢測
樣品和標準品均使用毛細管柱(30 m×250 μm×1.0 μm)分析,進樣口溫度為300℃,初始柱溫為20℃,保持5 min后,以4℃/min的速度升溫至200℃,維持10 min,流動相為氮氣,流速為0.65 mL/min。定量方法采用標準曲線法,以峰面積定量。
1.4.3 發酵乳流變學特性測定
為科學評價自主研發發酵劑制備的發酵乳在黏度、質構、口感等方面的性狀,對3種發酵乳進行流變學測試,其中包括振幅掃描測試和旋轉測試掃描測試。取適量發酵乳置于燒杯中,玻璃棒瞬時方向攪動10圈,再逆時針方向攪動10圈,靜置30~60 min后進行測試。檢測環境溫度為發酵乳入口溫度10℃。振幅掃描條件為固定頻率為1 Hz,應變掃描范圍0.01%~500%。旋轉掃描剪切速率范圍為0.001~500 s-1,每次測定的時間間隔為10 s。
1.4.4 發酵乳持水力測定
準確稱取4℃發酵乳樣品10 g置于離心管中,4 000 rpm/min離心10 min,稱重發酵乳上清(乳清),質量記為n。持水力=(m-n)/m×100%,其中m為發酵乳樣品質量[8]。實驗結果取3次重復測定的平均值。
2 結果與分析
2.1 不同菌株復配比例發酵乳在發酵過程中pH值的變化
采用3種不同發酵劑制備的發酵乳在發酵過程中pH值的變化情況如圖1所示。由圖1可以看出,3種發酵乳的pH值呈現出平臺-迅速下降-緩慢下降的變化趨勢,但采用D-1(國際標準發酵劑)制備的發酵乳和采用自主研發發酵劑制備的發酵乳的pH值變化在平臺時期和迅速下降時期出現較明顯的區別。D-1發酵乳,在發酵初期(0~80 min)產酸緩慢;進入100 min后,pH值迅速下降,且下降速率持續增加,說明該階段菌體處于對數生長期,產酸量激增;當發酵接近240 min時,pH值下降變緩,產酸速率降低,說明此時發酵已進入平穩階段。與之相比,自主研發的發酵劑(ST∶LB=1∶1為發酵劑Z-1,ST∶LB=1∶3為發酵劑Z-2)的產酸平臺期較長,接近D-1發酵乳的2倍(0~160 min),而當發酵180 min后,兩種發酵乳的pH值均開始迅速下降,最大下降速率可達到0.0175△pH/min,發酵300 min后,pH值下降明顯變緩,此時pH值為4.94。發酵結束時,Z-1和Z-2發酵乳的終點pH值為4.5左右,D-1發酵乳的終點pH值為4.7左右,由此可知,雖然自主研發發酵劑在乳基中產酸延遲期較長,但達到發酵終點pH值至所用時間與國際標準發酵劑基本一致。
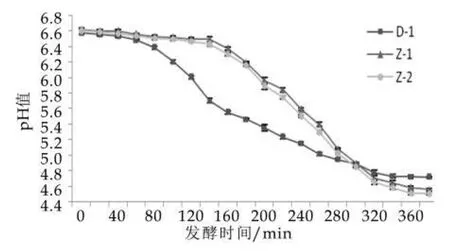
圖1 不同菌株復配比例發酵乳在發酵過程中pH值的變化
發酵劑及發酵過程中球菌與桿菌的比例直接影響發酵乳產酸的速度,并對發酵乳的性狀和感官品質有著重要的影響[9]。嗜熱鏈球菌是發酵劑中主要的產酸菌株,一般情況下,接種時球菌占優勢的發酵乳發酵速度整體快于桿菌占優勢的發酵乳,但有研究指出,當球菌和桿菌的復配比例接近1∶1時,發酵乳產酸的速度是最快的[5]。另外,球桿菌的比例不僅會影響發酵過程中產酸的速度和產酸量,也會影響發酵乳在后酸化期pH值的變化。秦南冰等人[5]和趙鑫等人[10]的研究表明,發酵劑中球菌占優勢的發酵乳后酸化程度較低,而后酸化產酸最多的仍然是球桿菌比例為1∶1的情況。值得注意的是,由于不同菌株自身特性差異較大,最佳產酸時的球桿菌比例是不定的。通過實驗結果及上述分析可知,自主研發發酵劑應適當增加ST-1的量,從而提高復配菌株產酸的速度,以期縮短其在發酵前期的延遲時長和達到發酵終點pH值的時間。
2.2 不同菌株復配比例發酵乳的風味物質
采用頂空固相微萃取結合GC-MS的方法對3種發酵乳中揮發性的風味物質進行檢測,氣譜-質譜峰如圖2所示,主要揮發性物質質量濃度如表1所示。由圖2可以看出,3種發酵乳中分離到的揮發性物質種類較多,但大部分質量濃度較低。其中質量濃度較高的為三種酮類化合物,分別為2,3-丁二酮,2,3-戊二酮和3-羥基丁酮,一種酸性化合物乙酸和一種酯類化合物丁二酸二乙酯。在這五種物質中,前四種為發酵乳主要的風味物質。采用自主研發發酵劑制備的兩種發酵乳,乳酸質量濃度較高且質量濃度接近,分別是采用通用型發酵制備發酵乳的2.18和1.99倍,這可能是由于Z-1和Z-2發酵劑在發酵后期和后酸化期仍緩慢產酸導致的。與其他研究結果相比[11-12],這兩種發酵乳中的酸性物質質量濃度在可接受的范圍內,說明自主研發發酵劑制備的發酵乳能夠形成更為酸爽的口感。2,3-丁二酮,又稱雙乙酰,是一種重要的風味物質,賦予發酵乳特殊的香氣。Z-1和Z-2發酵乳中均檢測到了2,3-丁二酮,而對照發酵乳中沒有檢測到該種化合物,說明了自主研發發酵劑制備的發酵乳在產香方面明顯優于對照發酵乳。
2.3 不同菌株復配比例發酵乳的流變學特性
流變學測試是指從應力、應變、溫度和時間等方面來研究物質變形和(或)流動的一種手段。發酵乳是一種復雜的流體,其流變性是指發酵乳的流動和變形隨時間、壓力的變化所表現出的性質,發酵乳的流變性通常用來描述和衡量產品的質地,包括凝膠的黏彈性、硬度等[13]。為評價自主研發發酵劑所制備發酵乳口感、質構等方面的性狀,本實驗分別采用振幅掃描和旋轉掃描對發酵乳的流變特性進行測定。振幅掃描主要檢測由乳酸菌產生的胞外多糖與乳中酪蛋白形成網狀結構的交聯程度以及此結構對水分的保持力[14]。旋轉掃描主要為測定發酵乳的動態黏度曲線以及發酵乳在入口、留口及吞咽過程中其黏性的變化趨勢。
2.3.1 振幅掃描
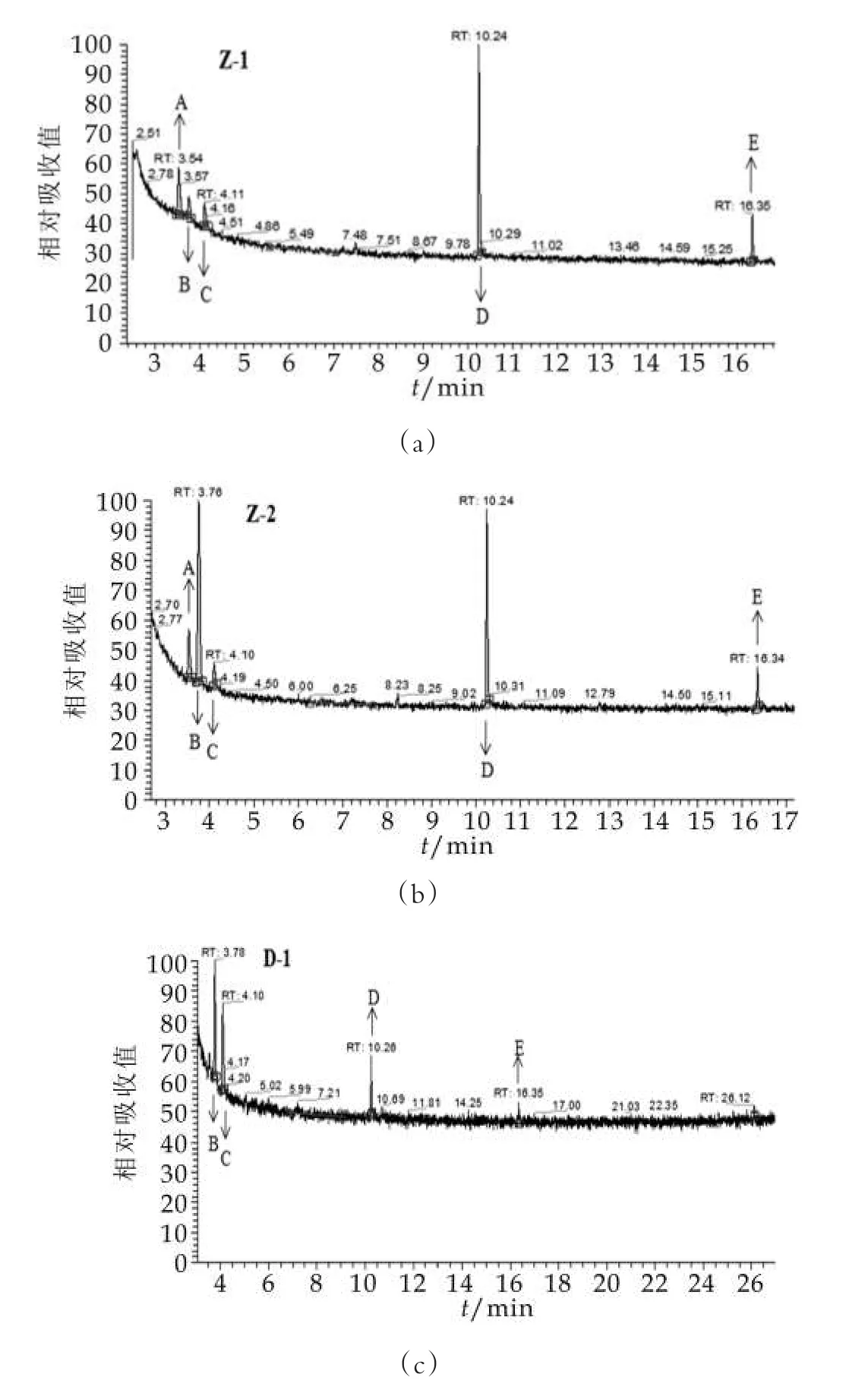
圖2 不同菌株復配比例發酵乳氣相色譜-質譜圖
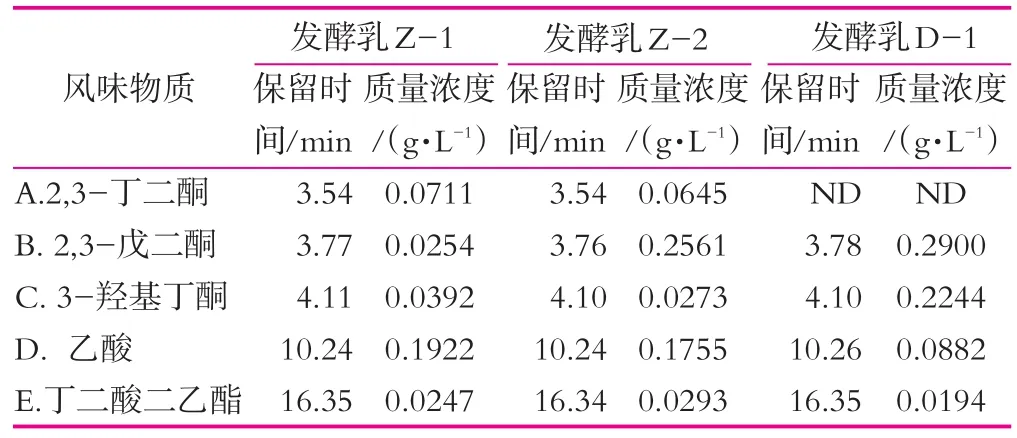
表1 發酵乳中主要揮發性物質質量濃度
通過振幅掃描,分別對三種發酵乳的黏彈性、儲能模量(Storage Modulus,G′)和損耗模量(Loss Modulus,G″)進行測定,結果如圖3所示。從圖中可以發現,國際通用D-1和自主研發Z-1和Z-2發酵劑制備的發酵乳,在1 Hz的應變掃描中,線性黏彈區均在0.01~1.2%,在此區間剪切應變率(γ)和剪切應力(τ)成線性關系,說明了采用自主研發發酵劑制備的發酵乳在黏彈性方面能夠達到標準。另外,在大部分掃描過程中,發酵乳樣品表現為G′>G″,該結果與Purohit等人[14]的研究一致。儲能模量與損耗模量與乳體系凝膠網絡結構中鏈接鍵的個數是呈一定比例[15],其中損耗模量與鍵能較大的鏈接鍵相關,而儲能模量的大小主要取決于鍵能較小的鏈接鍵[16]。因此,當發酵乳呈現G′>G″時,說明乳體系中形成了較為堅固的網狀膠體結構。但隨著剪切應變率的增加,G′>G″均明顯下降,說明此時發酵乳體系中的網狀膠體結構很大程度被破壞。同時我們還發現,在線性黏彈區間內,Z-1發酵乳的儲能模量始終大于D-1發酵乳,由此可以判斷,采用自主研發發酵劑Z-1制備的發酵乳所形成的網狀結構較為牢固,表現為入口較高的稠厚感。

圖3 不同菌株復配比例發酵乳的振幅掃描
2.3.2 旋轉掃描
通過旋轉掃描,對3種發酵乳的動態黏度進行測定,結果如圖4所示。由圖4可以看出,當剪切應變速率在0.001~0.01 s-1區間時,發酵乳樣品的狀態可以理解為處于貨架期或入口的狀態,此時發酵乳Z-1的黏度為650~802 Pa·s,而對照發酵劑D-1制備的發酵乳為533~625 Pa·s,由此可以判斷自主研發發酵乳對比國際標準發酵乳在貨架期及入口時可能呈現出較高的黏稠度,以及可能具有較強的持水能力。當應變剪切速率升高到10~70 s-1時,對照發酵乳D-1的黏度較高,而自主研發的發酵乳Z-1和Z-2較低,由此我們可以推測,前者在吞咽過程中呈現的稠度較厚,而后者在咀嚼和吞咽過程中比較順滑,易于吞咽。發酵乳的黏度主要與乳體系中蛋白膠束的強弱有關,膠束強弱的變化是一種維持在乳蛋白酸化變性、蛋白酶活性變化、肽分子由于靜電力和疏水作用力的重排以及氫鍵和二硫鍵等多重因素間的動態平衡[17-18]。另外,乳酸菌發酵過程中產生的胞外多糖也是影響發酵乳黏度的一個重要因素,有研究證明,采用能夠產生胞外多糖的乳酸菌菌株作為發酵劑制備的酸乳具有較好的稠度和穩定性[2,19]。
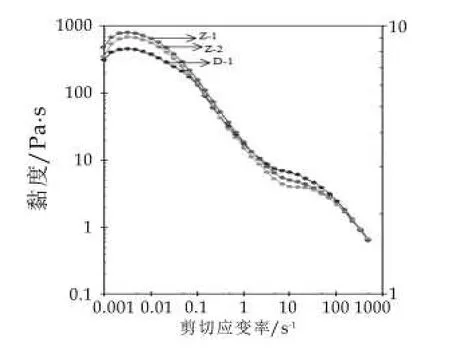
圖4 不同菌株復配比例發酵乳的旋轉掃描
2.4 不同菌株復配比例發酵乳持水力的比較
利用重力和離心力是測定發酵乳持水性能的經典手段[20-21]。本研究采用離心測定析水力的方法分析了3種發酵乳的持水能力,結果如圖5所示。由圖5可以看出,國際標準發酵劑D-1制備的發酵乳經適度離心后,乳清析出量較少,與之相比,Z-1和Z-2發酵乳上清析出量較低,其中Z-1上清析出量比D-1少10%(質量分數)左右。乳清的析出主要受到發酵乳中酪蛋白分子重排和膠質鈣離子溶解速率的影響[15],然而,有研究表明,發酵乳中的一些大分子物質,例如胞外多糖,由于其具有較強結合水分的能力,并能和乳蛋白相互結合形成較穩定的網狀結構[22],從能夠而有效地降低乳清的析出,提高發酵制品的感官品質。另外,發酵劑菌株產酸的速率也會顯著影響乳清的析出,因此在篩選發酵劑菌株時,應同時考慮菌株產生胞外多糖的量以及產酸的速度。

圖5 不同菌株復配比例發酵乳的持水力
3 結論
(1)采用自主研發發酵劑制備的發酵乳在產香、黏彈性(爽滑度)、持水力等方面優于采用國際標準通用型發酵劑制備的發酵乳。
(2)采用振幅掃描和旋轉掃描技術能夠對發酵乳制品的組織狀態、黏彈性、持水力等方面進行科學、客觀的評價。
(3)自主研發發酵劑菌株產酸主要發生在發酵的中后期,應適當調整發酵劑菌株的復配比例,以期縮短發酵延遲期,使其適用于大規模的發酵乳生產。
[1]MOZZI F,DE GIORI GS,DE VALDEZ GF.UDP-galactose 4-epimerase:a key enzyme in exopolysaccharide formation by Lactobacillus casei CRL 87 in controlled pH batch cultures[J].Journal of Applied Microbiology,2003,94(2):175-183.
[2]KAILASAPATHY K.Survival of free and encapsulated probiotic bacteria and their effect on the sensory properties of yoghurt[J].LWT-Food Science and Technology,2006,39(10):1221-1227.
[3]FOLKENBERG D M,DEJMEK P,SKRIVER A,et al.Sensory and rheological screening of exopolysaccharide producing strains of bacterial yoghurt cultures[J].International Dairy Journal,2006,16(2):111-118.
[4]華鶴良,房東升,楊仁琴,等.嗜熱鏈球菌與保加利亞乳桿菌的不同比例對酸乳發酵性能和產香特性的影響[J].中國乳品工業,2014,42(3):26-29.
[5]秦南冰,李妍,袁珠妮,等.保加利亞乳桿菌與嗜熱鏈球菌的比例變化對酸奶品質的影響[J].中國乳品工業,2011,39(2):37-39.
[6]田芬,粘靖祺,霍貴成.嗜酸乳桿菌和雙歧桿菌發酵乳的流變特性研究[J].食品科學,2012,33(5):155-159.
[7]DA SILVA GC,DA SILVA AAS,DA SILVA LSN,et al.Method development by GC-ECD and HS-SPME-GC-MS for beer volatile analysis[J].Food chemistry 2015,167:71-77.
[8]趙謀明,盧延輝,林偉鋒,等.乳清蛋白對脫脂發酵乳的流變特性及貯存穩定性的影響[J].中國乳品工業,2006,34(2):4-6.
[9]LA TORRE L,TAMIME AY,MUIR D.Rheology and sensory profiling of set-type fermented milks made with different commercial probiotic and yoghurt starter cultures[J].International Journal of Dairy Technology,2003,56(3):163-170.
[10]趙鑫,趙洪雙,姜國龍.不同比例的嗜熱鏈球菌與保加利亞乳桿菌對酸奶品質的影響[J].農產品加工(學刊),2009,3:177-180.
[11]FERNANDEZGARCIA E,MCGREGOR JU.Determination of Organic-Acids During the Fermentation and Cold-Storage of Yogurt[J].Journal of Dairy Science,1994,77(10):2934-2939.
[12]李理,丁木,滿朝新,等.兩種酸奶后酸化期風味物質的比較研究[J].中國食物與營養,2014,20(5):26-30.
[13]趙紅玲,李全陽,趙正濤,等.攪拌型酸奶流變學特性的研究[J].乳業科學與技術,2009,32(4):159-163.
[14]PUROHIT DH,HASSAN AN,BHATIA E,et al.Rheological,sensorial,and chemopreventive properties of milk fermented with exopolysaccharide-producing lactic cultures[J].Journal of Dairy Science,2009,92(3):847-856.
[15]LEE WJ,LUCEY JA.Structure and physical properties of yogurt gels:Effect of inoculation rate and incubation temperature[J].Journal of Dairy Science,2004,87(10):3153-3164.
[16]LUCEY J A,JOHNSON M E,HORNE D S.Invited review:Perspectives on the basis of the rheology and texture properties of cheese[J].Journal of Dairy Science,2003,86(9):2725-2743.
[17]RINGGENBERG E,ALEXANDER M,CORREDIG M.Effect of concentration and incubation temperature on the acid induced aggregation of soymilk[J].Food Hydrocolloids,2013;30(1):463-469.
[18]ROESCH R,JUNEJA M,MONAGLE C,et al.Aggregation of soy/milk mixes during acidification[J].Food Research International,2004,37(3):209-215.
[19]SUTHERLAND I W.Structure-Function-Relationships in Microbial Exopolysaccharides[J].Biotechnology Advances 1994,12(2):393-448.
[20]AMATAYAKUL T,SHERKAT F,SHAH NP.Syneresis in set yogurt as affected by EPS starter cultures and levels of solids[J].International Journal of Dairy Technology,2006,59(3):216-221.
[21]HASSAN AN,FRANK JF,SCHMIDT KA,et al.Textural properties of yogurt made with encapsulated nonropy lactic cultures.Journal of Dairy Science,1996,79(12):2098-2103.
[22]DE VUYST L,DEGEEST B.Heteropolysaccharides from lactic acid bacteria[J].FEMS Microbiology Reviews,1999,23(2):153-177.

