松仁紅衣多酚的提取及體外抗氧化活性研究
張根生,侯 靜,張銘東,司淼菲
(哈爾濱商業大學食品工程學院,黑龍江省普通高等學校食品科學與工程重點實驗室,黑龍江哈爾濱150076)
植物多酚,是一類廣泛存在于植物體內的多元酚化合物[1],廣泛存在于植物的皮、根、果中,含量可達20%[2]。近年來,研究表明松屬植物含有大量多酚類化合物,其具有獨特的化學性質和生物活性,統稱為松多酚[3]。松多酚的酚羥基中的鄰位酚羥基極易被氧化成醌類化合物,對活性氧等自由基有較強的捕捉能力[4],使得松多酚具有抗氧化活性[5],此外松多酚還具有抗腫瘤[6]、降血脂、抗動脈硬化、防治冠心病與中風等心腦血管疾病[7]等多種生理功能,在食品、醫藥以及其他領域起到了一定的作用[8-9]。
松多酚的提取方法主要有機溶劑浸提、超聲波輔助和酶法輔助有機溶劑提取法等。采用超聲波輔助有機溶劑提取法提取松多酚是最常用的,該方法利用了超聲波的空化效應,通過對細胞壁產生影響及促進細胞溶脹等,強化了提取過程,縮短了提取時間[10],使植物活性成分溶出,并且溫度不會大幅度升高,不會破壞其有效成分[11]。趙玉紅等比較了樟子松樹皮中松多酚的提取方法,研究表明超聲波輔助提取法的提取效果好于有機溶劑提取法[3]。蘇曉雨采用超聲波輔助提取了紅松種殼中多酚類化合物,研究表明松殼多酚能夠有效的抑制羥自由基及超氧陰離子等生理性自由基,能夠顯著地清除DPPH自由基及ABTS等非生理性自由基[12]。
以松仁生產過程中廢棄的松仁紅衣為原料,采用超聲波輔助有機溶劑浸提法,提取松仁紅衣中的粗多酚,優化提取工藝條件,并研究其體外抗氧化活性,為充分利用紅松籽可食用資源及尋找新型天然抗氧化劑提供了一個新途徑。
1 材料與方法
1.1 材料與儀器
松仁紅衣 勃利縣宏泰松果有限公司;無水碳酸鈉 天津市雙船化學試劑廠;乙醇 天津基準化學試劑有限公司;沒食子酸 天津市光復精細化工研究所;福林酚 天津市光復精細化工研究所;抗壞血酸 天津市天新精細化工開發中心;硫代硫酸鈉 天津市科密歐化學試劑有限公司;DPPH Aladdin公司;碘化鉀 天津市北方天醫化學試劑廠;鉬酸銨 天津市化學試劑四廠;30%過氧化氫 哈爾濱新達化工廠;水楊酸鈉 天津市光復精細化工研究所,以上試劑均為分析純。
Y92-2D超聲波細胞粉碎儀 寧波新知生物科技股份有限公司;721E型紫外可見分光光度計 上海光譜儀器有限公司;電熱恒溫水浴鍋 天津市泰斯特儀器有限公司。
1.2 實驗方法
1.2.1 提取工藝流程 松仁紅衣→粉碎→超聲波輔助乙醇溶劑浸提→冷卻→抽濾→松仁紅衣多酚提取液
將松仁紅衣干燥,經粉碎機粉碎,過40目篩。每份稱取1g松仁紅衣粉末,加入一定量的乙醇溶劑,進行超聲波輔助提取,以乙醇濃度、料液比、提取溫度、提取時間、超聲功率為變量,進行單因素實驗。提取結束后冷卻并抽濾,得到松仁紅衣多酚粗提液。將濾液定容至一定體積,用福林酚比色法測定吸光度,并計算多酚得率。根據單因素實驗結果,進行正交實驗,對松仁紅衣多酚提取條件進行優化。
1.2.2 福林酚法測定松仁紅衣多酚含量 參考文獻[13]進行實驗。
1.2.2.1 標準曲線的繪制 沒食子酸標準儲備溶液(1000μg/mL):稱取(0.110 ±0.01)g 沒食子酸(GA,相對分子質量188.14),于100mL容量瓶中溶解并定容至刻度,搖勻(現配)。沒食子酸工作液:用移液管分別移取 1.0、2.0、3.0、4.0、5.0mL 的沒食子酸標準儲備溶液于100mL容量瓶中,分別用水定容至刻度,搖勻,濃度分別為 10、20、30、40、50μg/mL。
標準曲線的確定:用移液管分別移取沒食子酸工作液、水(做空白對照)各1.0mL于10mL棕色容量瓶中,分別加入5.0mL 10%福林酚試劑,搖勻。反應3~8min內,加入 4.0mL 7.5% 的 Na2CO3溶液,充分混勻后定容。置于25℃恒溫水浴中反應1h后,用10mm比色皿于765nm波長下測定吸光值。以沒食子酸的質量濃度為橫坐標,吸光度值為縱坐標繪制沒食子酸標準曲線。
1.2.2.2 樣品的測定 樣品測定方法:精密吸取1mL樣品溶液于10mL棕色容量瓶中,再分別加入5.0mL10%福林酚試劑,搖勻。反應3~8min內,加入4.0mL7.5%的 Na2CO3溶液,充分混勻后定容。置于25℃恒溫水浴中反應1h后,用10mm比色皿于765nm波長下測定吸光值。由標準曲線上查得相對應的濃度,按下式計算出多酚粗提物的得率:
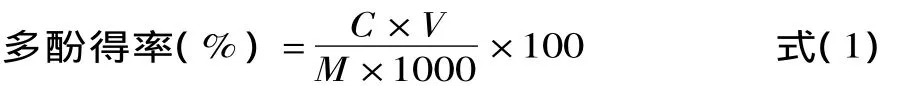
式中:C為多酚質量濃度(mg/mL);V為提取液的體積mL;M為樣品質量g。
1.2.3 松仁紅衣多酚提取工藝單因素實驗
1.2.3.1 乙醇濃度對松仁紅衣多酚粗提物得率的影響 精確稱取(1±0.0001)g松仁紅衣粉末5份,分別加入濃度為30%、40%、50%、60%、70%的乙醇溶液,按料液比1∶20,提取溫度60℃的條件超聲波提取90min,超聲功率300W,提取結束后抽濾,取濾液按照福林酚法測定多酚粗提物得率[12,14]。
1.2.3.2 料液比對松仁紅衣多酚粗提物得率的影響 精確稱取(1±0.0001)g松仁紅衣粉末5份,分別按料液比 1∶15、1∶20、1∶25、1∶30、1∶35 用濃度為 50%的乙醇溶液超聲波提取90min,提取溫度60℃,超聲功率300W,提取結束后抽濾,取濾液按照福林酚法測定多酚粗提物得率。
1.2.3.3 提取溫度對松仁紅衣多酚粗提物得率的影響 精確稱取(1±0.0001)g松仁紅衣粉末5份,料液比1∶20,乙醇濃度50%,分別在30、40、50、60、70℃溫度條件下超聲波提取90min,超聲功率300W,提取結束后抽濾,取濾液按照福林酚法測定多酚粗提物得率。
1.2.3.4 超聲時間對松仁紅衣多酚粗提物得率的影響 精確稱取(1±0.0001)g松仁紅衣粉末5份,料液比1∶20,乙醇濃度50%,在60℃下分別超聲波提取30、60、90、120、150min,超聲功率 300W,提取結束后抽濾,取濾液按照福林酚法測定多酚粗提物得率。
1.2.3.5 超聲功率對松仁紅衣多酚粗提物得率的影響 精確稱取(1±0.0001)g松仁紅衣粉末5份,料液比1∶20,乙醇濃度50%,提取溫度60℃,分別在超聲功率 200、250、300、350、400W 下提取時間 90min,提取結束后抽濾,取濾液按照福林酚法測定多酚粗提物得率。
1.2.4 松仁紅衣多酚提取工藝正交實驗 根據單因素實驗的結果,選擇乙醇濃度、料液比、提取溫度、超聲時間為正交實驗因素,設計3個水平,以多酚的得率為指標,選用L9(34)正交表優化實驗方案,確定最佳提取工藝。
1.2.5 松仁紅衣多酚體外抗氧化活性實驗
1.2.5.1 松仁紅衣多酚清除羥自由基能力測定 吸取 0.5mL 濃度為8mmol/L 的 FeSO4溶液,0.8mL 濃度為6mmol/L 的 H2O2溶液,0.5mL 蒸餾水,1.0mL 不同濃度的松仁紅衣多酚提取物,0.2mL濃度為20mmol/L水楊酸鈉溶液。混合搖勻后于37℃水浴中反應1h,然后于562nm波長下測定混合物吸光度值A1;將上述體系中的1.0mL松仁紅衣多酚提取物用蒸餾水代替,其余同法操作,測定吸光度值A0;將上述體系中的0.2mL水楊酸鈉溶液用相同體積的蒸餾水代替,其余同法操作,測定吸光度值A2。以抗壞血酸為陽性對照,同等方法操作進行測定[15]。記錄各項吸光度值,按照下式計算松仁紅衣多酚提取物及抗壞血酸對羥自由基的清除率:
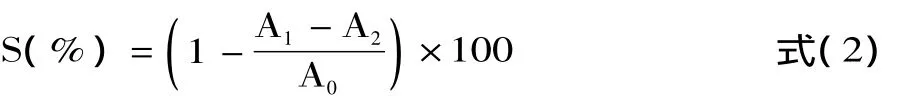
式中:S為羥自由基清除率(%);A1為混合物吸光度值;A2為上述體系中水楊酸鈉溶液用等體積蒸餾水代替測定吸光度值;A0為上述體系中樣品用等體積蒸餾水代替測定吸光度值。
1.2.5.2 松仁紅衣多酚清除 DPPH自由基能力測定 將DPPH·粉末配制濃度為8.62×10-2mmol/L的DPPH·乙醇溶液保存于棕色瓶中(臨用前配)。向比色管中加入 2.0mL DPPH·乙醇溶液,2.0mL 不同濃度松仁紅衣提取物,搖勻,室溫下避光靜置30min,然后在517nm波長處測定吸光度值A1;同法操作,用等體積乙醇代替松仁紅衣提取物,測定吸光度值A0;不加DPPH·溶液,用等體積乙醇代替,加入不同濃度松仁紅衣提取物,測定吸光度值A2,用以排除樣品本身對測定結果的干擾。以抗壞血酸作為陽性對照品,以樣品濃度為橫坐標,清除率為縱坐標,制作樣品濃度與DPPH自由基清除率關系曲線[16]。按照下式計算松仁紅衣多酚提取物及抗壞血酸對DPPH自由基的清除率:
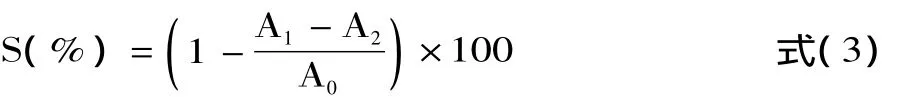
式中:S為DPPH·清除率(%);A1為混合物吸光度值;A2為上述體系中DPPH·溶液用等體積乙醇代替測定吸光度值;A0為上述體系中樣品用等體積乙醇代替測定吸光度值。
1.2.5.3 松仁紅衣多酚清除過氧化氫能力測定 吸取1.0mL0.1mmol/L的 H2O2溶液于10mL比色管中,再加入3%鉬酸銨溶液0.1mL,2mol/L的H2SO4溶液10mL,1.8mol/L 的碘化鉀溶液 7.0mL,不同濃度的松仁紅衣提取物1.0mL,混合搖勻后靜置片刻。用5mmol/L Na2S2O3溶液滴定上述混合溶液,滴定終點為溶液的黃色消失[17]。按照下式計算過氧化氫清除率,清除率表示加樣后過氧化氫的減少量占對照組過氧化氫總量的百分比:
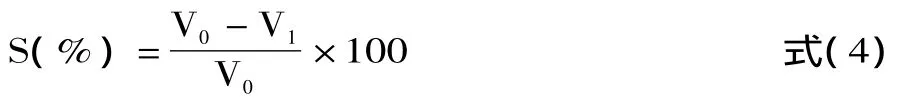
式中:S為過氧化氫清除率(%);V0為對照組消耗Na2S2O3溶液的體積(mL);V1為樣品組消耗Na2S2O3溶液的體積(mL)。
2 結果與分析
2.1 沒食子酸標準曲線及回歸方程
沒食子酸在0~50μg/mL濃度范圍內的線性回歸方 程為:y=0.0063x+0.0008,相關 系數 R2為0.9997,表明該濃度范圍內線性關系良好。
2.2 松仁紅衣多酚提取工藝的單因素實驗
2.2.1 乙醇濃度對松仁紅衣多酚得率的影響 由圖2可知,在乙醇濃度小于50%時,多酚得率隨乙醇濃度增大而呈上升趨勢,當乙醇濃度達到50%時多酚的得率達到最高,之后隨著乙醇濃度的增加,多酚得率略微下降,原因可能是隨著乙醇濃度的增大,多酚在乙醇水溶液中的溶解度增大,在乙醇濃度50%達到最大,然而隨后增加乙醇濃度,溶劑中的水分減少,通透性降低,細胞內的多酚物質向外擴散難度加大,所以提取率低[18]。因此確定乙醇濃度50%為最佳浸提條件,選取優化范圍為40%~60%。
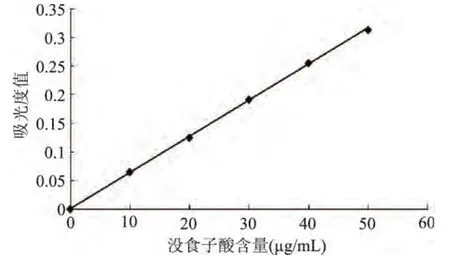
圖1 沒食子酸標準曲線Fig.1 The standard curve of gallic acid
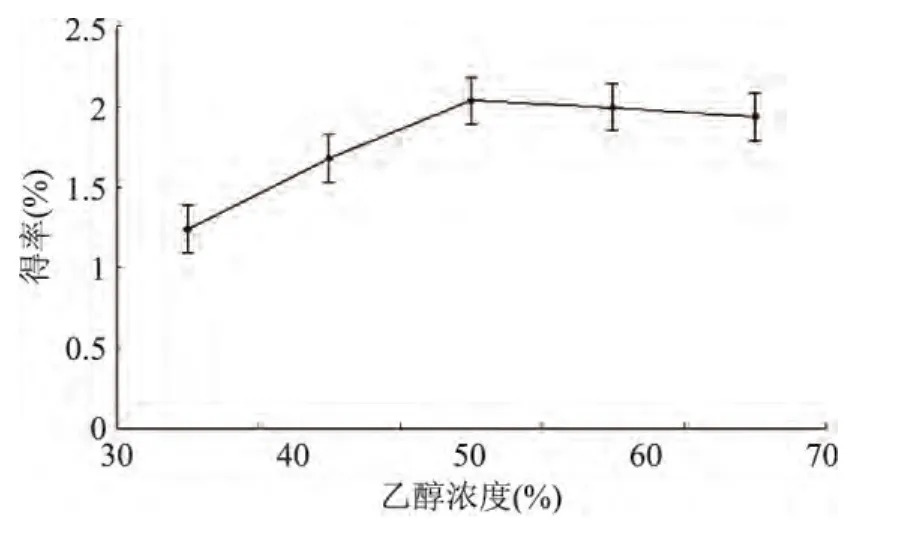
圖2 乙醇濃度對松仁紅衣多酚得率的影響Fig.2 Effects of ethanol concentration on polyphenols yield of Pine Nut Coat
2.2.2 料液比對松仁紅衣多酚得率的影響 由圖3可知,從料液比1∶15開始,隨著料液比的加大,多酚得率呈現先升高后降低的趨勢,當料液比為1∶20時,多酚得率較1∶15時明顯升高,之后逐漸平穩,變化不大,考慮后續的濃縮處理及經濟成本等多方面原因,確定料液比1∶20為最佳浸提條件,選取優化范圍為1∶15~1∶25。
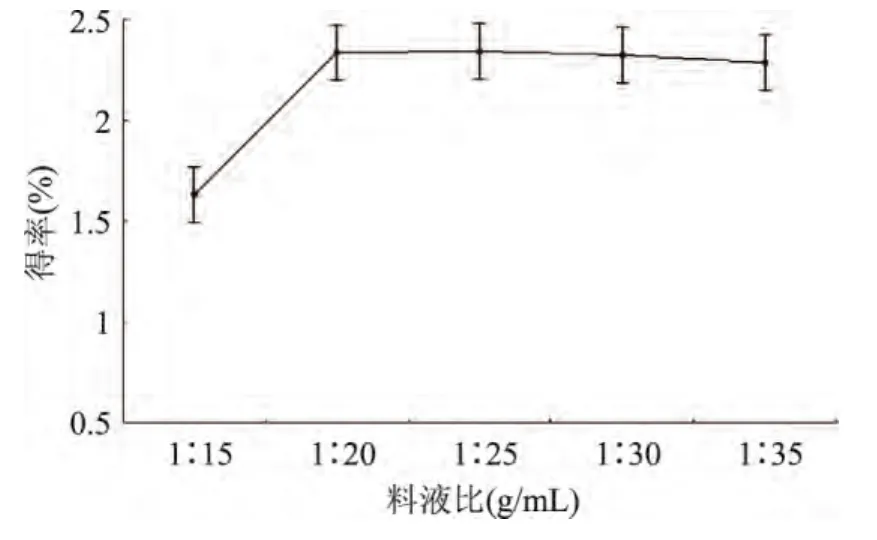
圖3 料液比對松仁紅衣多酚得率的影響Fig.3 Effect of material-to-liquid ratio on polyphenols yield of Pine Nut Coat
2.2.3 提取溫度對松仁紅衣多酚得率的影響 由圖4可知,提取溫度低于60℃時,隨著溫度的升高,松仁紅衣多酚得率逐漸提高,在溫度達到60℃時多酚的得率達到最大,隨后略有下降。這是由于多酚類化合物在高溫條件下很不穩定,易受到破壞;而溫度過低不利于超聲的空化作用,因此也會降低多酚的提取效果[19]。綜合考慮,確定最佳提取溫度為60℃,選取優化范圍為40~60℃。
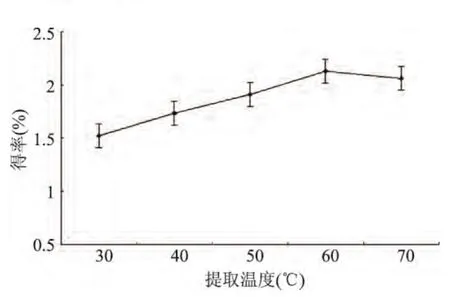
圖4 提取溫度對松仁紅衣多酚得率的影響Fig.4 Effect of extraction temperature on polyphenols yield of Pine Nut Coat
2.2.4 超聲時間對松仁紅衣多酚得率的影響 由圖5可知,當超聲波作用時間為60min時,多酚粗提物得率較低,隨著提取時間的延長,松仁紅衣多酚粗提物得率呈上升趨勢,在120min時達到最高。這是由于提取時間長有利于多酚物質溶解入溶劑中,使提取更加完全;當提取時間超過120min時,得率略微下降。因此,確定最佳提取時間為120min,選取優化范圍為90~150min。
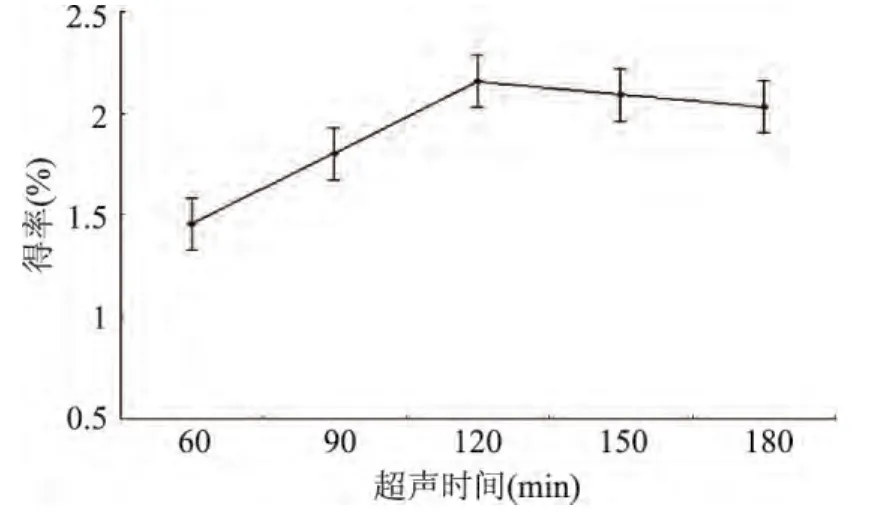
圖5 超聲時間對松仁紅衣多酚得率的影響Fig.5 Effect of ultrasonic time on polyphenols yield of Pine Nut Coat
2.2.5 超聲功率對松仁紅衣多酚得率的影響 由圖6可以看出,超聲功率低于300W時,隨著超聲功率的增加,松仁紅衣多酚得率逐漸升高,功率達到300W時得率最大,此后,隨著超聲功率的增加,得率略有下降,但整體水平對得率的影響不顯著。原因可能是超聲波使細胞破裂,提高功率,細胞破裂加劇,從而有利于多酚類物質的溶解;但當超聲波功率超過一定限度時,便可能會破壞多酚類物質的結構,從而造成得率下降[20]。因此選擇300W為最佳提取超聲功率。
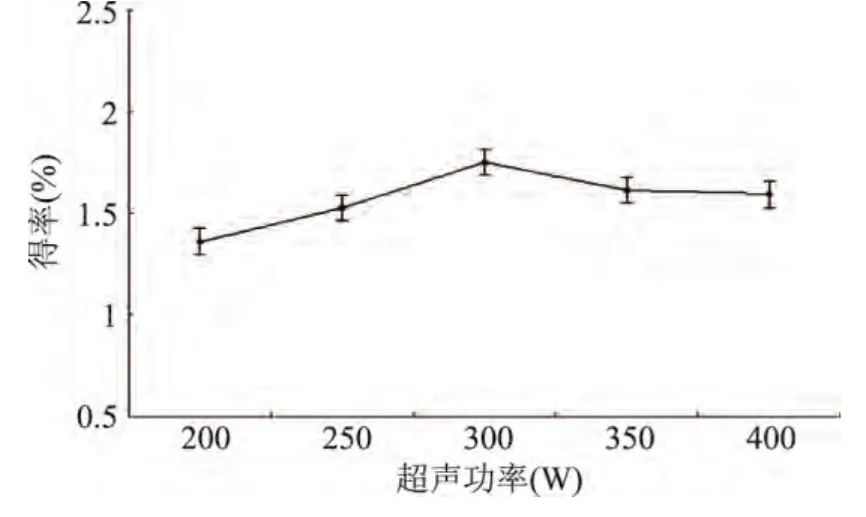
圖6 超聲功率對松仁紅衣多酚得率的影響Fig.6 Effect of ultrasonic wave power on polyphenols yield of Pine Nut Coat
2.3 松仁紅衣多酚提取工藝的正交實驗
為了確定松仁紅衣多酚提取的最佳工藝,根據單因素的實驗結果,設計了四因素三水平的正交實驗,具體設計及結果見表1。
由表1可知,各因素對松仁紅衣多酚得率影響程度的大小次序為A>B>D>C,即乙醇濃度>料液比>超聲時間>提取溫度,最佳提取工藝參數為A3B2C2D1,即乙醇濃度 60%,料液比 1∶20,提取溫度60℃,超聲時間90min,在此條件下進行驗證實驗,得到松仁紅衣多酚得率為2.36%。
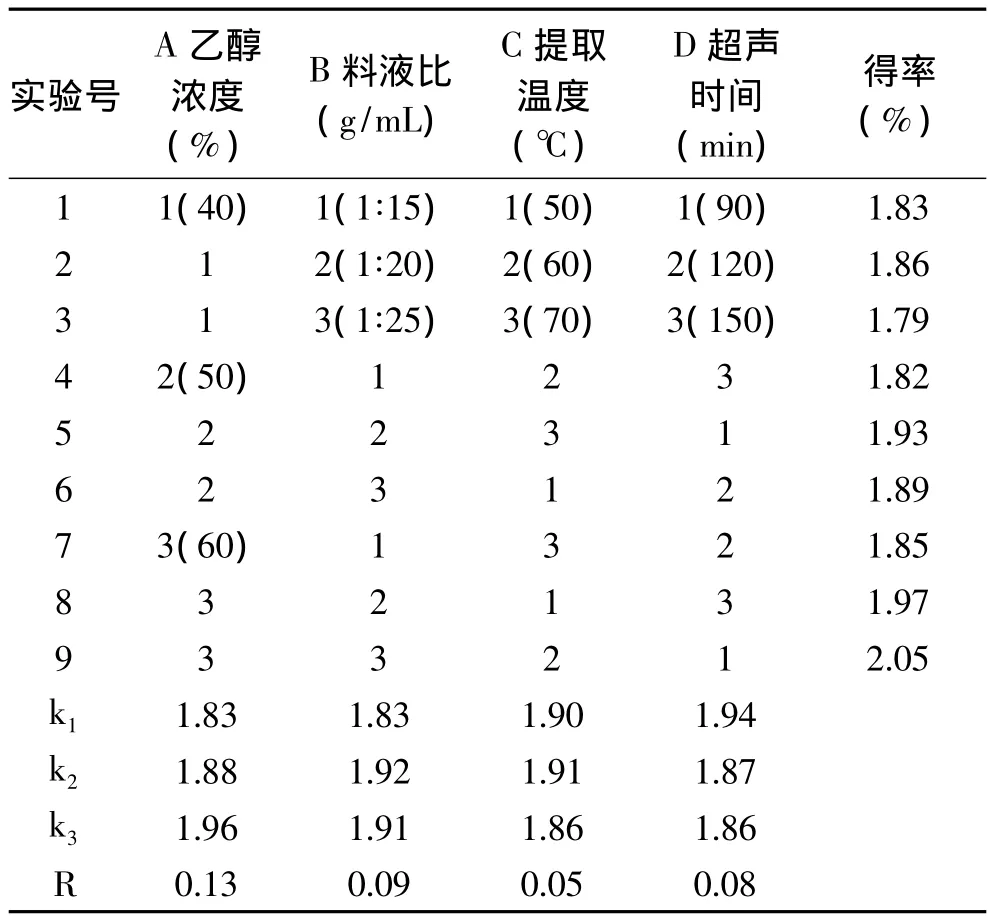
表1 正交實驗設計及結果Table 1 Results of orthogonal test of polyphenols extraction
2.4 松仁紅衣多酚的抗氧化活性
2.4.1 松仁紅衣多酚清除羥自由基的能力 實驗結果如圖7所示,松仁紅衣多酚與抗壞血酸對羥自由基均具有一定清除作用,在一定濃度范圍內,隨著濃度的增加,兩者的清除率都在提高,當松仁紅衣多酚樣品濃度達到0.5mg/mL時,其清除率達到56.23%。羥自由基已被研究證明對活細胞中各種分子具有損傷作用,能夠導致DNA鏈斷裂,產生基因突變等[21],該實驗結果表明松仁紅衣多酚具有清除羥自由基的作用,所以在防治自由基引發的疾病、延緩機體衰老等方面具有重要意義。
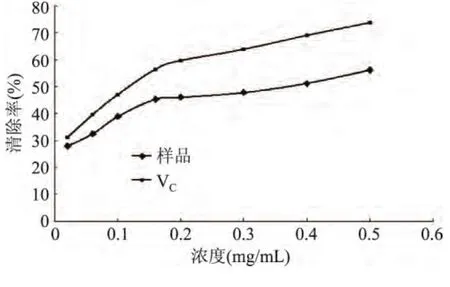
圖7 松仁紅衣多酚及抗壞血酸對羥自由基清除作用Fig.7 The·OH scavenging activity of Pine Nut Coat polyphenols extract and ascorbic acid
2.4.2 松仁紅衣多酚清除DPPH自由基能力 實驗結果如圖8所示,松仁紅衣多酚及抗壞血酸對DPPH·均有明顯的清除作用,0~0.04mg/mL的濃度范圍內,隨著松仁紅衣多酚樣品濃度的增加,清除率不斷上升,達到 0.04mg/mL后,其清除率上升緩慢,樣品對DPPH自由基清除率最大達到 93.23%,VC達到97.34%。與蘇曉雨[12]研究的松殼多酚對DPPH自由基的清除效果基本一致。
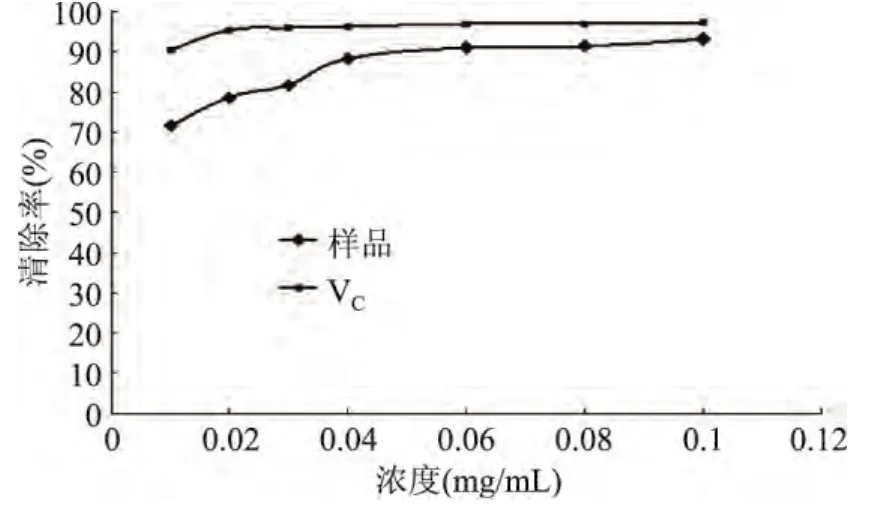
圖8 松仁紅衣多酚及抗壞血酸對DPPH自由基清除作用Fig.8 The DPPH·scavenging activity of Pine Nut Coat polyphenols extract and ascorbic acid
2.4.3 松仁紅衣多酚清除過氧化氫能力 實驗結果如圖9所示,松仁紅衣多酚及抗壞血酸對過氧化氫的清除率隨著濃度增加而升高。抗壞血酸濃度達到1.4mg/mL時,清除率達到71.21%,之后變化不明顯;松仁紅衣多酚樣品的清除率隨著濃度的增加而上升,最大濃度時達到56.73%。雖然松仁紅衣多酚的清除率低于抗壞血酸,但在實驗濃度范圍內,對過氧化氫仍有一定的清除作用,比蘇曉雨[12]研究的松殼多酚對過氧化氫的清除效果明顯。
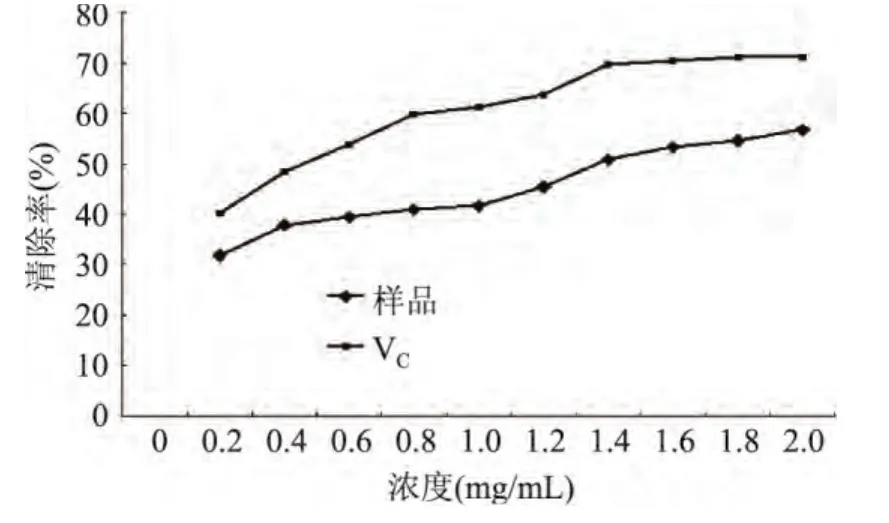
圖9 松仁紅衣多酚及抗壞血酸對過氧化氫清除作用Fig.9 The H2O2scavenging activity of Pine Nut Coat polyphenols extract and ascorbic acid
3 結論
超聲波法輔助提取松仁紅衣多酚的影響因素主次順序為乙醇濃度>料液比>超聲時間>提取溫度,最佳提取工藝:乙醇濃度60%,料液比1∶20,提取溫度60℃,超聲時間90min,超聲功率300W,在此條件下得到松仁紅衣多酚得率為2.36%。
體外抗氧化活性實驗研究結果表明,松仁紅衣多酚對羥自由基的清除率為松仁紅衣多酚樣品濃度達到 0.5mg/mL 時,其清除率達到 56.23%;對 DPPH自由基的清除率為當樣品濃度達到0.1mg/mL時,最大清除率為93.23%;對過氧化氫的清除率為當樣品濃度達到2mg/mL時,清除作用最大達56.73%。由此可見,松仁紅衣多酚具有一定的抗氧化性。
[1]李群梅,楊長鵬,李健,等.植物多酚提取與分離方法的研究進展[J].保鮮與加工,2010(1):16-19.
[2]Heroes P J,Benner R,Cowie G L.Tannin diagensis in mangrove leavesfrom atropicalestuary:A novelmolecular approach[J].Geochimica et Cosmochimica Acta,2001,65(18):3109-3122.
[3]趙玉紅,翟亞楠,王振宇.樟子松樹皮中松多酚的提取工藝研究及提取方法比較[J].食品工業科技,2013,34(4):304.
[4]Z Zdunczyk,S Frejnagel,M Wro blewska,et al.Biological activity of polyphenol extracts from different plant sources[J].Food Research International,2002,35(2-3):183-186.
[5]王振宇,周麗萍,劉瑜.蘋果多酚對小鼠脂肪代謝的影響[J].食品科學,2010,31(9):287-289.
[6]姚瑞祺.植物多酚的分類及生物活性的研究進展[J].農產品加工,2011(4):99-100.
[7]翟清波,李誠,王靜.植物多酚降血糖和降血脂作用研究進展[J].中國藥房,2012,23(3):279-281.
[8]李健,楊昌鵬,李群梅.植物多酚的應用研究進展[J].廣西輕工業,2008(12):1-3.
[9]Anna Soko-e towska,Jan Oszmianski.Antioxidant activity of the phenolic compounds of hawthorn,pine and skullcap[J].Food Chemistry,2007,103:853-859.
[10]郭英,貝玉祥,王雪梅,等.超聲波法提取廣棗多酚的研究[J].中醫中藥雜志,2008,29(8):36-38.
[11]胡愛軍,鄭捷.食品工業中的超聲提取技術[J].食品與機械,2004,20(4):57-60.
[12]蘇曉雨.紅松種殼組成及多酚提取分離與抗氧化抗腫瘤功能研究[D].哈爾濱:哈爾濱工業大學,2010,11.
[13]GB/T 8313-2008.茶葉中茶多酚和兒茶素類含量的檢測方法[S].
[14]姚永志,王子涵,左錦靜.乙醇提取花生紅衣多酚物質的研究[J].現代食品科技,2006,32(3):51-54.
[15]Wang H,Gao X D,Zhou G C,et al.In Vitro and in Vivo Antioxidant Activity of Aqueous Extract from Choerospondias Axillaris Fruit[J].Food Chemistry,2008,106:888-895.
[16]Blois M S.Antioxidant Determinations by the Use of a Stable Free Radical[J].Nature,2002,26:1199-1200.
[17]Barros L,Ferreira M J,Queiros B.Total Phenols,Ascorbic Acid,13-Carotene and Lycopene in Portuguese Wile Edible Mushrooms and Their Antioxidant Activities[J].Food Chemistry,2007,103:413-419.
[18]Fausto Gironi,Vincenzo Piemonte.Temperature and solvent effects on polyphenol extractionprocess from chestnut tree wood[J].Chemical Engineering Research and Design,2011,89:857-862.
[19]荀二娜,張春利,謝曉娜,等.超聲波法輔助提取松針多酚[J].吉林大學學報,2012,50(1):147-152.
[20]向麗,周鐵軍,葉迎春,等.青果多酚超聲波醇提工藝條件的研究[J].安徽農業科學,2012,40(2):772-774.
[21]王璐.山荊子多酚分離鑒定及對γ輻射誘導氧化損傷的防護作用[D].哈爾濱:哈爾濱工業大學,2013,11.

