鹽酸格拉司瓊注射液的制備及其質量研究
王 敏 李 莉
1.東營市廣饒縣人民醫院藥劑科,山東廣饒 257300;2.量子高科集團,北京 102200
格拉司瓊是一種強效5-HT3 受體拮抗劑[1-3],臨床用于抑制腫瘤化療引起的惡心、嘔吐[4-5]。國內市場上的鹽酸格拉司瓊注射液大多存在pH 值不穩定、制備工藝復雜、生產費用高等缺點[6-7]。該實驗(2013.08-2014.05)欲研制更為理想的鹽酸格拉司瓊氯化鈉注射液,并通過控制滅菌條件、pH 值等因素使穩定性進一步提高。
1 材料
1.1 儀器
P3000 分析型HPLC 儀;PHS-3C 精密pH 計;YXQ-SG46-280 手提式壓力蒸汽滅菌鍋。
1.2 試藥
鹽酸格拉司瓊;注射用氯化鈉;氫氧化鈉;鹽酸。
1.3 統計方法
使用Microsoft Excel 2007 對數據進行統計,計數資料用百分數表示
2 試驗方法及結果
2.1 初步處方篩選
由于鹽酸格拉司瓊原料藥易溶于水,故無須考慮助溶劑的選擇。處方組成:鹽酸格拉司瓊60 mg,注射用氯化鈉9 g,注射用水1 000 mL。
2.1.1 pH 對鹽酸格拉司瓊注射液穩定性的影響 配制不同pH的處方溶液,測定其不同條件下含量,觀察pH 對鹽酸格拉司瓊注射液穩定性的影響,結果見表1。
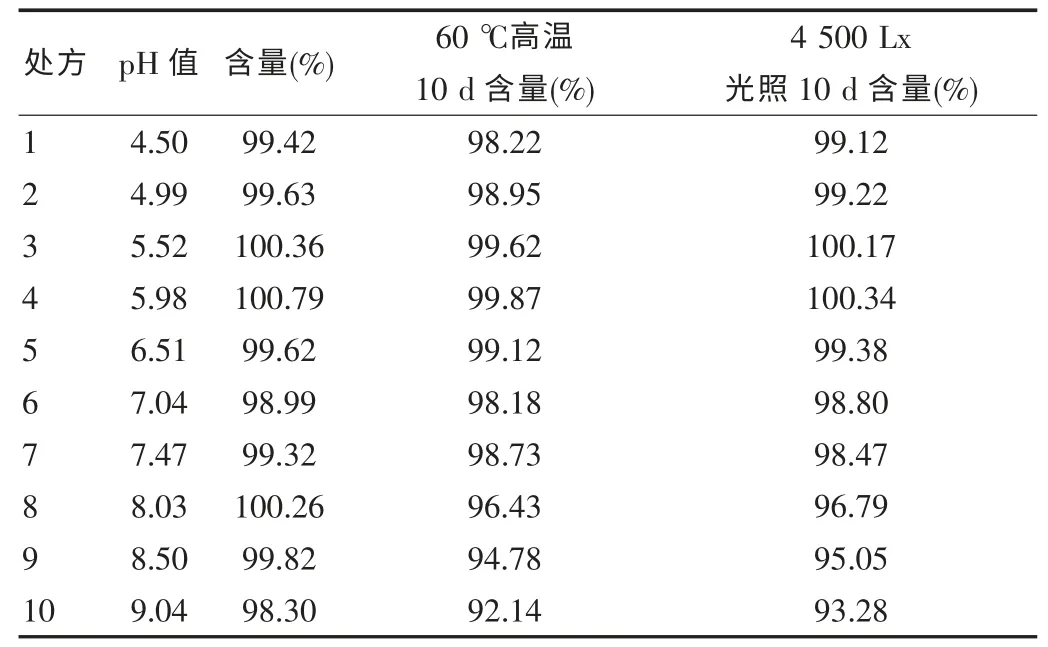
表1 pH 對鹽酸格拉司瓊注射液穩定性影響
由表1 可知,該品在中性偏酸性環境中較穩定,在偏堿性環境中含量變化較大,故其適宜的pH 值應<8。結合試驗結果,本品質量標準中定其pH 范圍為5.0~7.0,實驗中將pH 調節至6.0。
2.1.2 滅菌條件選擇 配制鹽酸格拉司瓊注射液3 份,其中一份樣品于100 ℃流通蒸汽滅菌30 min、一份樣品于100 ℃流通蒸汽滅菌45 min、一份樣品于115 ℃高壓滅菌30 min。在上述3 種不同滅菌條件下,隨滅菌溫度升高和滅菌時間延長,藥液pH 稍有下降,有關物質略有增加,含量及性狀無明顯變化。但考慮到注射液對無菌,無熱原要求較高[8],選擇本品的滅菌條件為:115 ℃高壓滅菌30 min。
2.2 處方和制備工藝最終確立
取鹽酸格拉司瓊60 mg,注射用氯化鈉9 g,加入注射用水,攪拌使之完全溶解,轉入1 000 mL 容量瓶中,注射用水加至全量,調節pH 為6.0,用0.45 μm 的微孔濾膜過濾,灌封于20 個50 mL的無菌干燥的輸液瓶中,置于滅菌鍋中115 ℃滅菌30 min,即得。照上述條件制備3 批樣品用于質量測定及穩定性分析。
3 鹽酸格拉司瓊注射液的質量控制[9]
3.1 性狀
本品為無色的澄明液體。
3.2 鑒別
在含量測定項下色譜圖中,供試品溶液與對照品溶液主峰的保留時間一致。
取本品適量,加0.1 mol/L 鹽酸溶液制成1 mL 含12 μg 的溶液,照分光光度法測定,在302 nm 的波長處有最大吸收。
3.3 檢查
3.3.1 pH 值 取樣測定pH 值,3 批樣品的pH 值分別為5.80,5.87 和5.82,均在規定的5.0~7.0 之間。
3.3.2 有關物質[10-11]
取本品作供試品溶液;精密量取供試品溶液1 mL,加流動相稀釋至100 mL,作為對照品溶液。照含量測定項下的色譜條件進行測定。供試品溶液的色譜圖中如有雜質峰,除溶劑峰外各雜質峰面積之和不大于對照品溶液主峰的峰面積(1.0%)。
結果表明,3 批樣品的有關物質分別為0.42%,0.37%和0.44%,均在標準規定范圍內。
3.4 含量測定[12]
參照中國藥典2010 版鹽酸格拉司瓊注射液的含量測定方法,分別配置供試品和對照品溶液,精密量取上述溶液各20 μL,進樣,記錄色譜圖。按外標法以峰面積計算。3 批樣品含量測定結果分別為100.00%,99.66%和100.73%。其含量均在標準規定范圍內。
3.5 穩定性試驗
取格注射液進行影響因素試驗和加速試驗,將外觀、pH 值、澄明度、有關物質和含量作為考察指標。
影響因素試驗中,經強光照射和高溫放置10 d,各項指標均未發生明顯變化,說明所制樣品在高溫和光照條件下均較穩定。
加速試驗中,在(40±2)℃,相對濕度(75±5)%條件下放置6個月,有關物質由0.42%增大至0.58%,pH 有所下降,由5.80 降低至5.64,其余各指標無明顯變化。
以上結果證明本品較穩定。
4 結語
該實驗制備了鹽酸格拉司瓊氯化鈉注射液,格拉司瓊水溶性很好且水溶液比較穩定,配制過程中除氯化鈉、pH 調節劑外無其他輔料及試劑,此處方工藝下無需添加穩定劑即可維持鹽酸格拉司瓊氯化鈉注射液的穩定性。與國內市場現有制劑比較,處方及制備工藝更為簡單。
通過對最適pH 值的篩選,考察出鹽酸格拉司瓊氯化鈉注射液的pH 值在5.0~7.0 之間較為穩定,而考慮到操作過程的簡便和相應的經濟效益,決定將鹽酸格拉司瓊氯化鈉注射液的pH 值調至6.0。成品滅菌后pH 會下降0.2 左右,分析原因可能是滅菌加熱時鹽酸游離出來所致,但其性狀、含量在滅菌前后無明顯變化,有關物質略有增大,故最終選擇的滅菌條件為115 ℃高壓滅菌30 min。為防止滅菌后pH 降低過多,可在配置時將pH 調節至6.2 左右。
按照本處方工藝配制的鹽酸格拉司瓊氯化鈉注射液經影響因素實驗和加速試驗考察質量穩定,說明處方設計較為合理,根據實驗結果暫定有效期為兩年。
實驗選用的處方簡單,操作簡便,經濟效益較高,值得臨床推廣應用。
[1]沈徐,孫建良,羅永香.格拉司瓊預防曲馬多術后鎮痛致惡心嘔吐50例[J].中國藥業,2012,21(19):99-100.
[2]劉朝暉,張曉鋼.格拉司瓊不同用藥方式對預防術后嗎啡鎮痛所致惡心嘔吐的影響[J].中國臨床醫生,2014(1):65-67.
[3]蘇先旭,王輝.格拉司瓊聯合甲氧氯普胺預防化療嘔吐的臨床療效觀察分析[J].四川醫學,2012,33(2):293-294.
[4]Helen Dunnington,Rodney Hunter.Granisetron Transdermal Patch for Treatment of Nausea in Patients Undergoing Cisplatin Based Chemotherapy for Cervical Cancer[J].Journal of Cancer Therapy,2013,3(6):1159-1163.
[5]Shahrbanou Keyhanian,O Taziki,MM Saravi.A Randomized Comparison of Granisetron Plus Dexamethason with Granisetron alone for the Control of Acute Chemotherapy-Induced Emesis and Nausea[J].International Journal of Hematology-Oncology and Stem Cell Research,2011,3(2):27-30.
[6]毛紅.鹽酸格拉司瓊注射液的處方篩選及穩定性研究[J].中國藥房,2006,17(19):1462-1464.
[7]周燕宜.國產與進口鹽酸格拉司瓊注射液的藥物經濟學評價[J].吉林醫學,2013,34(2):267-268.
[8]潘偉,陳志祥.鹽酸格拉司瓊注射液細菌內毒素檢查法[J].中國藥師,2005,8(2):166-168.
[9]中華人民共和國藥典委員會.中國藥典(二部)[S].北京:化學工業出版社,2010.
[10]劉明,李立威.HPLC 法測定鹽酸格拉司瓊的有關物質[J].西北藥學雜志,2013,28(6):587-591.
[11]林麗琴,石云峰.鹽酸格拉司瓊注射液中光降解產物的含量測定[J].醫藥導報,2013,32(6):791-792.
[12]Heda A,Kathiriya J.Development and validation of RP-HPLC method for simultaneous determination of granisetron and dexamethasone[J].Indian journal of pharmaceutical sciences,2011,73(6):696-699.

