打頂前后烤煙葉片microRNAs表達差異的研究
楊惠娟,王景,王紅麗,危月輝,史宏志
河南農(nóng)業(yè)大學煙草學院 國家煙草栽培生理生化研究基地 煙草行業(yè)栽培重點實驗室 ,鄭州 450002
打頂前后烤煙葉片microRNAs表達差異的研究
楊惠娟,王景,王紅麗,危月輝,史宏志
河南農(nóng)業(yè)大學煙草學院 國家煙草栽培生理生化研究基地 煙草行業(yè)栽培重點實驗室 ,鄭州 450002
為研究打頂前后烤煙葉片中差異表達的microRNAs(miRNAs),利用Solexa測序技術對打頂前后煙草葉片的小RNA文庫進行測定,分別得到4,223,982和4,993,588條unique sRNA序列讀數(shù)。打頂前后葉片樣品中分別有347條與337條序列與庫中miRNA匹配,其中注釋序列分別為83和71條。在打頂前后葉片樣品中表達具有顯著差異的miRNA有7條,在打頂后葉片中高表達的miRNA有miR-157和miR-156;在打頂后葉片中低表達的miRNA有miR-395,miR-159c,miR-159a,miR-394和 miR-399。實驗還鑒定出3條新的miRNA序列,其中Nta-miRNA*-001和Nta-miRNA*-002存在打頂前葉片樣品中,Nta-miRNA*-003存在打頂后葉片中。打頂前后烤煙葉片主要miRNA 的表達差異反應了打頂對烤煙葉片的生長及抗逆等應激過程的調(diào)節(jié)作用。
烤煙 ;葉片;打頂;miRNA
microRNAs(微小RNAs,miRNAs) 作為基因表達中的一類負調(diào)控子,主要在轉(zhuǎn)錄后水平上通過介導目標mRNA 的切割或抑制翻譯來調(diào)節(jié)植物基因的表達 [1]。
植物 miRNA 介導的調(diào)控主要取決于植物 miRNA與其靶 mRNA 的序列互補的程度[2-3]。通常情況下,miRNA 與靶 mRNA 完全互/補或接近完全互補時,則會切割 mRNA; miRNA 與靶 mRNA 不完全互補時,則抑制它的翻譯[4]。而植物 miRNA 介導的主要作用方式是對靶 mRNA 的剪切[5]。切割后,miRNA 會繼續(xù)識別并切割其他靶基因。
一個miRNA可作用于多個mRNA,如miR159可同時調(diào)控TCP2、CP3、TCP4、CP10、TCP24和GAMYB等靶基因的表達,而一個mRNA也可能受到多個不同miRNA的調(diào)節(jié),如SCL6同時受到miR30、miR46和miR58等的調(diào)節(jié)[6]。miRNA在植物體中的表達水平受到外界環(huán)境、激素、發(fā)育進程等多種因素的影響[7]。miRNA在植物根分化、葉片發(fā)育、莖尖形成、開花與性別分化等過程中均有重要作用[8-14]。
烤煙是重要的經(jīng)濟作物之一。為了獲得較好的煙葉產(chǎn)量和質(zhì)量,生產(chǎn)上通常在生長后期對烤煙進行打頂。通過摘除煙株頂端的花序及包括頂部的幾片幼葉,控制和去除煙草的頂端生長優(yōu)勢,將煙株的生長中心及時調(diào)整到打頂后保留下的煙草葉片生長發(fā)育上來。打頂對煙草葉片的生長發(fā)育及優(yōu)良品質(zhì)的形成有重要影響。本研究旨在探究打頂前后烤煙葉片中差異表達的miRNA,以期了解miRNA與打頂前后葉片的生長狀態(tài)之間的聯(lián)系,為研究烤煙打頂對葉片生長的分子調(diào)節(jié)過程提供研究線索。
1 材料與方法
1.1 實驗材料
煙草品種為K326,試驗地設在河南省平頂山市郟縣。試驗田依當?shù)爻R?guī)栽培方法管理。取移栽后60天(打頂前)和移栽后70天(打頂后10天)煙株第12葉位的葉片。葉片樣品于液氮冷凍并放入-80℃冰箱保存。
1.2 小RNA文庫構建和序列測定
總RNA提取應用TRIZOL試劑(Invitrogen,USA),按照說明書提取打頂前后葉片樣品總RNA。再通過15%的聚丙烯酰胺變性凝膠電泳分離,回收18~30個核苷酸的片段,采用SuperScriptTMⅡ(Invitrogen,USA)進行反轉(zhuǎn)錄,之后分別將5’以及3’測序接頭引物連接于反轉(zhuǎn)錄后的cDNA序列兩端,PCR擴增產(chǎn)物進行Solexa測序(北京華大基因,深圳,廣東,中國)。Solexa測序所得35nt序列,經(jīng)去接頭、去低質(zhì)量、去污染等過程完成數(shù)據(jù)處理得到干凈序列,對其進行序列長度分布的統(tǒng)計及樣品間公共序列統(tǒng)計。并分類注釋,獲得樣品中包含的各組分及表達量信息。
1.3 差異表達miRNA的鑒定和新miRNA的預測
將獲得的sRNA序列在miRNA數(shù)據(jù)庫(miRBase15.0,http://www.mirbase.org/)中擬南芥庫進行比對,篩選樣品中的已知miRNA,以錯配堿基數(shù)目小于2為標準,確定煙草葉片中的保守miRNA。表達量在樣品間差異表達大于2倍以上或小于0.5倍以下同時p小于0.01的miRNA確定為差異表達(上調(diào)/下調(diào))。使用華大研發(fā)的軟件Mireap預測新的miRNA,繪制其miRNA二級結構圖。
2 結果
2.1 序列測定結果
利用Solexa測序技術對打頂前后煙草葉片的小RNA文庫進行測序,分別獲得19,186,129和18,798,348條原始序列,經(jīng)接頭序列及低質(zhì)量序列處理,分別獲得12,269,227和11,845,980條干凈序列,再經(jīng)冗余序列去除,最終分別得到4,223,982和4,993,588條Unique sRNA序列讀數(shù),分別占總序列讀數(shù)的22.02%和26.56%(表1)。經(jīng)miRNA數(shù)據(jù)庫檢索,打頂前葉片樣品中共有347條序列與庫中miRNA匹配,其中83條序列為注釋miRNA,82條為前體miRNA序列;打頂后的葉片樣品中共有337條匹配序列,注釋miRNA序列為71條,前體miRNA序列為78條(表1)。
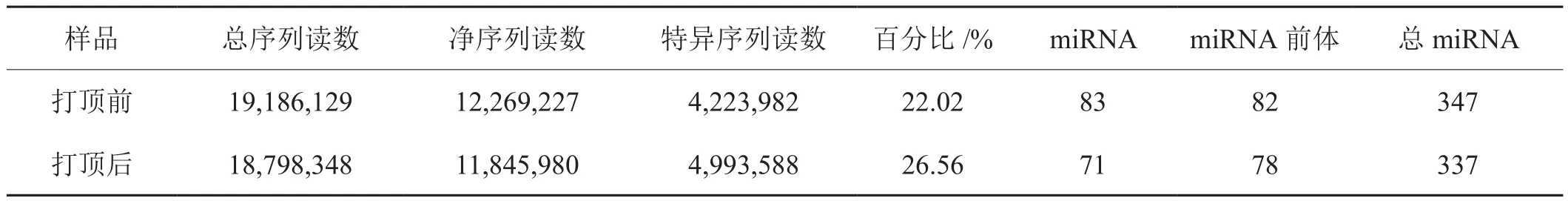
表1 打頂前后葉片中的sRNA 檢測及miRNAs 的鑒定Tab.1 Identification of sRNA and miRNAs in tobacco leaves before and after topping
2.2 差異表達miRNA的篩選和鑒定
打頂前后葉片樣品中miRNA的表達量如圖1所示,與打頂前葉片相比,打頂后葉片樣品中miRNA的表達量差異表達大于2倍以上(即在打頂后葉片中上調(diào))的miRNA有2條,分別是mir-157和miR-156;表達量小于0.5倍以下(即在打頂后葉片中下調(diào))的 miRNA 有 5條,分 別 是 miR-395,miR-159c,miR-159a,miR-394 和 miR-399 (表2)。

圖1 打頂前后葉片miRNAs 的表達水平Fig.1 Expression level of miRNAs in tobacco leaves before and after topping
2.3 新miRNA的預測
分析未匹配序列,由打頂前葉片樣品中鑒定出2條新的miRNA序列,命名為Nta-miRNA*-001 and Nta-miRNA*-002,由打頂后葉片中鑒定出1條miRNA序列,命名為Nta-miRNA*-003。預測新miRNA前體序列及其頸環(huán)結構如圖2和圖3所示,紅色框入序列為成熟miRNA序列區(qū)域。
3 討論
本實驗比較了打頂前后煙草葉片中miRNA表達譜,篩選出在兩時期葉片中差異表達的7個miRNA(表2)。打頂后葉片中上調(diào)miRNA為mir-157和miR-156,下調(diào)的 miRNA 為 miR-395,miR-159c,miR-159a,miR-394 和 miR-399。
根據(jù)靶基因功能不同,目前研究報道的miRNA及其靶基因主要可分調(diào)控植物miRNA代謝類[15-16];調(diào)控植物形態(tài)、發(fā)育類[10,16-20];調(diào)控植物抵抗逆境脅迫類[15-16,18,21-22];目前功能還不明確類[15-16,18,20]。在我們研究結果中,miR-156、miR-157和miR-159屬于調(diào)控植物形態(tài)發(fā)育類,miR-395和miR-399屬于植物抗逆調(diào)控類,miR-394的功能目前尚不明確。miR156/157與miR159是高度保守的家族,miR394是中度保守的家族,而miR395與miR399是低度保守的家族。通常在植物中鑒定的miRNA從miR156到miR408大部分是相當保守和古老的,在植物發(fā)育及脅迫響應等方面起著非常關鍵的作用[23-27]。

表2 打頂前后葉片中(打頂后/打頂前)差異表達的miRNAsTab.2 Expression differences of miRNAs in tobacco leaves before and after topping
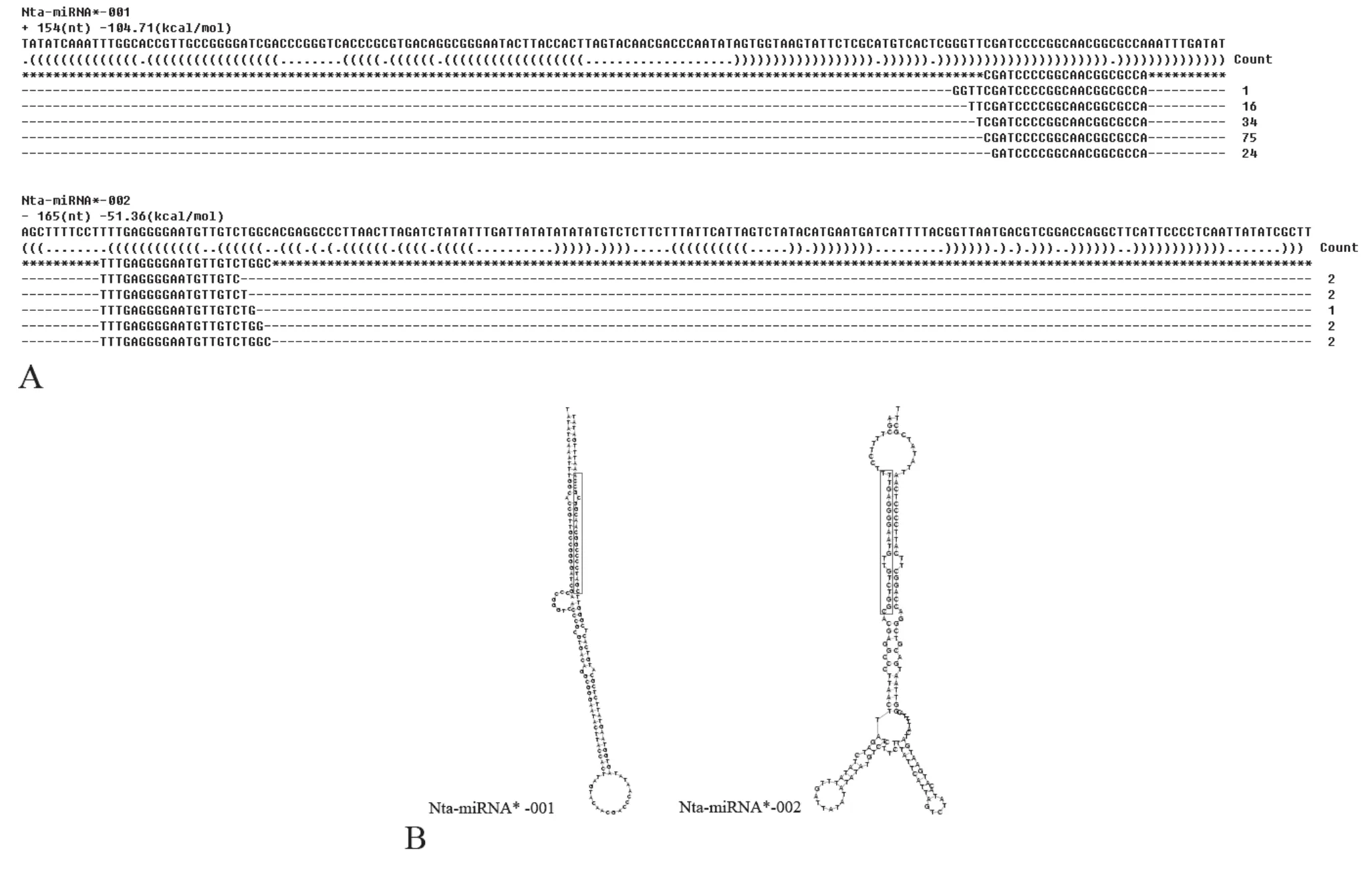
圖2 打頂前葉片中新miRNA(Nta-miRNA*-001 和 Nta-miRNA*-002)預測序列(A)及其前體預測結構圖(B)Tab.2 Diagram of predicted sequence(A)and precursor prediction(B)of miRNA(Nta-miRNA*-001 和 Nta-miRNA*-002)in tobacco leaves before topping
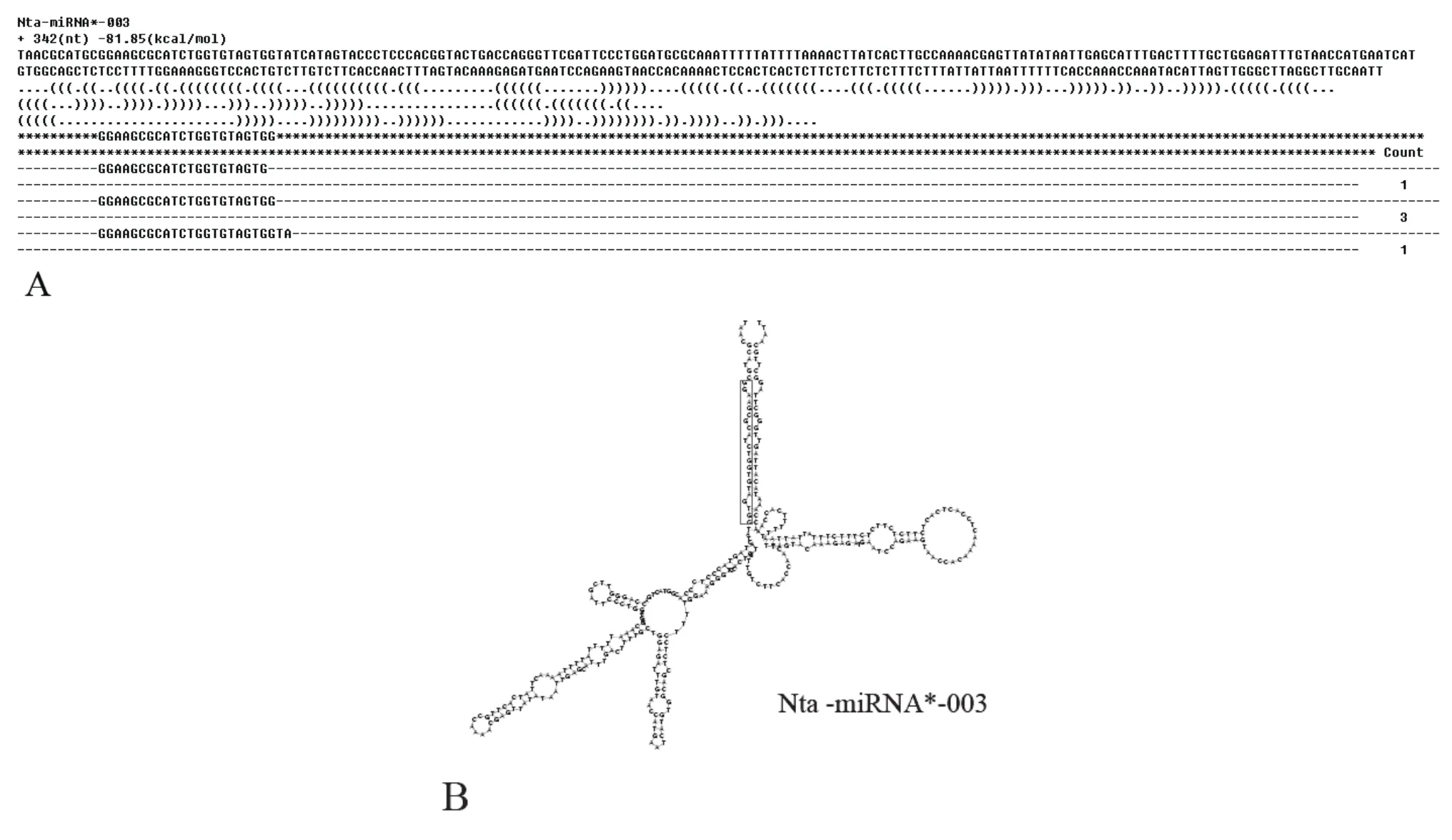
圖3 打頂后葉片中新miRNA(Nta-miRNA*-003)預測序列(A)及其前體預測結構圖Tab.3 Diagram of predicted sequence(A)and precursor prediction(B)of miRNA(Nta-miRNA*-003)in tobacco leaves after topping
實驗結果發(fā)現(xiàn)打頂后葉片中mir-156和mir-157的表現(xiàn)上調(diào),兩者可以識別共同的控制植物開花的靶基因SBP box gene SPL3[28]。miR156參與葉的啟動生長和控制幼葉到成熟葉的轉(zhuǎn)變[11]。miRl56在營養(yǎng)器官里表達量最大,過量表達 miR156能顯著增加擬南芥的葉片數(shù)目,并且開花時間出現(xiàn)延遲。miR156還控制著幼年期向成年期轉(zhuǎn)變、營養(yǎng)生長向生殖生長轉(zhuǎn)變這兩個相關聯(lián)的過程中,在營養(yǎng)生長早期 miR156表達水平較高,隨著發(fā)育進程逐漸進入生殖生長時期,其表達水平下降。擬南芥miR156表達水平的降低伴隨著向成年期轉(zhuǎn)變和早花表型[29-34]。miR156 也是一條控制開花的內(nèi)源性新途徑,這個途徑使得植物在沒有外界誘導信號的情況下依然可以開花結果,當miR156 的含量逐漸降低,而其靶基因的含量逐漸上升,當靶基因的表達到一定程度,就可以開啟下游基因的表達,誘導植物開花。相反,過量表達miR156會導致植物營養(yǎng)生長時期的延長和遲花的現(xiàn)象[29,35-36]。由此可見,增加miR156的轉(zhuǎn)錄量主要影響植株的營養(yǎng)生長時期和開花過程。我們的結果發(fā)現(xiàn)miR156在打頂后煙草葉片中表達量較高,在打頂后葉片中miR156的轉(zhuǎn)錄增加將有利于加強煙株的營養(yǎng)生長而延緩生殖生長的進程。這與打頂措施在煙草生產(chǎn)上的目的相一致,結果說明打頂在控制了煙株的生殖生長后確實對葉片的生長起到了促進作用,而miR156上調(diào)則是其中的調(diào)節(jié)機制之一。
實驗結果還發(fā)現(xiàn)打頂后葉片下調(diào)的miRNA有miR-395,miR-159c,miR-159a,miR-394 和 miR-399。這些下調(diào)的miRNA除miR-394功能不明外,其余的都與植物抗性脅迫有關。其中miR159與脫落酸(ABA)信號轉(zhuǎn)導過程有關,miR159過量表達可以降低植物對ABA的敏感性[37]。miR159在甘蔗抗鹽應激過程中也發(fā)揮了重要作用[38]。miR399可調(diào)控磷的吸收和轉(zhuǎn)運,在受到低磷脅迫下其表達量增加,使其靶基因表達量降低,從而提高了磷的積累[39-40],低硫可以誘導miR395的 表達量升高[41]。
打頂導致這些與抗逆脅迫相關miRNA的表達量降低,表明打頂在引起煙草葉片自身生長狀態(tài)改變的同時也改變了葉片對營養(yǎng)脅迫的反應及對激素信號的敏感程度。但其更為明確的調(diào)控方向尚需要進一步的深入探討和研究。
本實驗鑒定出三個與擬南芥miRNA庫未匹配的 miRNA——Nta-miRNA*-001,Nta-miRNA*-002和Nta-miRNA*-003。其中,在打頂前葉片中鑒定出Nta-miRNA*-001,Nta-miRNA*-002,在打頂后葉片中鑒定出Nta-miRNA*-003。通過軟件預測其前體結構及成熟序列的位置如圖2、圖3所示。煙草葉片中鑒定出三個新的miRNA在數(shù)據(jù)庫中沒有登錄,其功能信息還不明確。
4 結論
烤煙打頂可使葉片中miR-157和miR-156的上調(diào),miR156/157的上調(diào)可能是打頂影響煙株的生殖生長和營養(yǎng)生長的調(diào)節(jié)機制之一。打頂后烤煙葉片下調(diào)的miRNA 有 miR-395、miR-159c、miR-159a、miR-394和 miR-399,除miR-394功能不明外,其余都與植物抗性脅迫有關。表明打頂可能通過調(diào)控相關miRNA的表達來影響烤煙葉片的生長狀態(tài)和對脅迫信號的敏感程度。
[1]Schwab R,Palatnik J F,Riester M,et al.Specific effects of microRNAs on the plant transcriptome[J].Dev Cell,2005,8(4):517-527.
[2]Axtell M J,Bowman J L.Evolution of plant microRNAs and their targets [J].Trends Plant Sci,2008,13(7):343-349.
[3]Axtell M J,Snyder J A,Bartel DP.Common functionsfor diverse small RNAs of land plant-s[J].Plant Cell,2007,19(6):1750-1769
[4]Axtell M J,Bartel D P.Antiquity of microRNAs and their targets in land plants [J].Plant Cell,2005,17(6):1658-1673.
[5]Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297
[6]Bonnet E,Wuyts J,Rouze P,et al.Detection of 91 potential conserved plant microRNAs in Arabidopsis thaliana and Oryza sativa identifies important target genes[J].Proc Natl Acad Sci USA,2004,101(31):11511-11516.
[7]Kidner C A,Martienssen R A.The developmental role of microRNA in plants[J].Curr Opin Plant Biol,2005,8(1):38-44.
[8]Gutierrez L,Bussell J D,Pacurar D I,et al.Phenotypic plasticity of adventitious rooting in Arabidopsis is controlled by complex regulation of AUXIN RESPONSE FACTOR transcripts and microRNA abundance[J].Plant Cell 2009,21(10):3119-3132.
[9]Wang J W,Wang L J,MaoY B,et al.Control of root cap formation by microRNA-targeted auxin response factors in Arabidopsis[J].Plant Cell,2005,17(8):2204-2216.
[10]Mallory A C,Bartel D P,Bartel B.MicroRNA-directed regulation of Arabidopsis AUXIN RESPONSE FACTOR17 is essential for proper development and modulates expression of early auxin responsgenes[J].Plant Cell 2005,17(5):1360-1375.
[11]Pulido A,Laufs P.Co-ordination of developmental processes by small RNAs during leaf development[J].J Exp Bot,2010,61(5):1277-1291.
[12]Schmid D M,Uhlenhaut NH,Godard F,et al.Dissection of floral induction pathways using global expression analysis[J].Development,2003,130(24):6001-6012.
[13]Millar A A,Gubler F.The Arabidopsis CAMYB-like genes,MYB33 and MYB65 are microRNA-regulated genes that redundantly facilitate anther development[J].Plant Cell 2005,17(3):705-721.
[14]Kim J,Jung J H,Reyes J L,et al.microRNA-directed cleavage of ATHB15 mRNA regulates vascular development in Arabidopsisin-florescence stems [J].Plant J,2005,42(1):84-94.
[15]Xie Z,Allen E,Fahlgren N,et al.Expression of Arabidopsis MIRNA genes [J].Plant Physiol,2005,138(4):2145 -2154.
[16]Duan C,Wang C,Guo H.Regulation of microRNA on plant development and viral infection [J].Chinese Science Bulletin,2006,51(3):269-278.
[17]Mica E,Gianfranceschi L,Pè ME.Characterization of five microRNA families in maize [J].J Exp Bot,2006,57( 11):2601-2612.
[18]Lu S,Sun Y H,Shi R,et al.Novel and mechanical stress responsive microRNAs in populus trichocarpa that are absent from arabidopsis[J].Plant Cell,2005,17(8):2186-2203.
[19]Chen J,Li W X,Xie D,et al.Viral virulence protein suppresses RNA silencing–mediated defense but upregulates the role of microRNA in host gene expression [J].Plant Cell,2004,16(5):1302-1313.
[20]Dugas D V,Bartel B.MicroRNA regulation of gene expression in plants [J].Curr Opin Plant Biol ,2004,7(5):512-520.
[21]Bari R,Datt Pant B,Stitt M,et al.PHO2,microRNA399,and PHR1 define a phosphate-signaling pathway in plants[J].Plant Physiol,2006,141(3):988-999.
[22]Sunkar R,Kapoor A,Zhu JK.Posttranscriptionalinduction of two Cu/Zn superoxide dismutase genes in arabidopsis is mediated by downregulation of miR398 and important for oxidative stress tolerance [J].Plant Cell,2006,18(8):2051-2065.
[23]Zhang B,Pan X,Cannon CH,et al.Conservation and divergence of plant microRNA genes[J].Plant J,2006,46(2):243-259.
[24]Ibá?ez-Ventoso C,Vora M,Driscoll M.Sequenc relationships among C. elegans,D.melanogaster and human microRNAs highlight the extensive conservation of microRNAs in biology[J].PLoS One,2008,3(7):e2818.
[25]Sunkar R,Jagadeeswaran G.In silico identification of conserved microRNAs in large number of diverse plant species[J].BMC Plant Biol,2008,8:37.
[26]Tang G.Plant microRNAs:an insight into their gene structures and evolution[J].Semin Cell Dev Biol,2010,21(8):782-789.
[27]Ma Z,Coruh C,Axtell MJ.Arabidopsis lyrata small RNAs:transient MIRNA and small interfering RNA loci within the Arabidopsis genus[J].Plant Cell,2010,22(4):1090-1103.
[28]Gandikota M,Birkenbihl RP,H?hmann S,Cardon GH,Saedler H,Huijser P.The miRNA156/157 recognition element in the 3' UTR of the Arabidopsis SBP box gene SPL3 prevents early flowering by translational inhibition in seedlings[J].Plant J,2007,49(4):683-693.
[29]Wu G,Park M Y,Conway S R,et al.The sequential actionof miR156 and miR172 regulates developmental timing in Arabidopsis[J]. Cell,2009,138(4):750-759
[30]Fornara F,Coupland G. Plant phase transitions make a SPLash[J].Cell,2009,138(4):625 -627.
[31]Telfer A,Bollman K M,Poethig R S.Phase change and the regulation of trichome distribution in Arabidopsis thaliana[J].Development,1997,124(3):645 -654.
[32]Moose S P,Sisco P H. Glossy15 controls the epidermal juven-ile-to-adult transition in maize[J].Plant Cell,1994,6(10):1343-1355.
[33]Lauter N,Kampani A,Carlson S,et al.MicroRNA172downregulates glossy15 to promote vegetative phase change in maize[J]. Proc Natl Acad Sci USA,2005,102(26):9412-9417.
[34]Wu G,Poethig R S.Temporal regulation of shoot developmentin Arabidopsis thaliana by miR156 and its target SPL3[J].Development,2006,133(18):3539 -3547.
[35]Klein J,Saedler H,Huijser P.A new family of DNA binding proteins includes putative transcriptional regulators of the Antirrhinum majus floral meristem identity gene SQUAMOSA[J].Mol Gen Genet,1996,250(1):7-16
[36]Poethig R S.Small RNAs and developmental timing in plants[J].Curr Opin Genet Dev,2009,19(4):374-378.
[37]Reyes JL,Chua N H,ABA induction of miR159 controls transcript levels of two MYB factors during Arabidopsis seed germination[J].Plant J,2007,49(4):592-606.
[38]Patade V Y,Suprasanna P.Short-term salt and PEG stresses regulate expression of microRNA,miR159 in sugarcane leaves[J].J Crop Sci Biotech,2010.13(3):177-182.
[39]Fujii H,Chiou TJ,Lin SI,et al.A miRNA involved in phosphate-starvation responses in Arabidopsis[J].Curr Biol,2005,15(22):2083-2043.
[40]Hu B,Zhu C,Li F,et a1.Leaf Tip Necrosis 1 plays a pivotal role in regulation of multiple phosphate starvation responses in rice[J].Plant Physio1,2011,156(3):1101-1115
[41]Jones-Rhoades M W,Bartel D P.Computational identification of plant microRNAs and their targets,including a stress-induced miRNA[J].Mol Cell,2004,14(6):787-799.
Research on microRNAs expression profiles in flue-cured tobacco leaves before and after topping
YANG Huijuan,WANG Jing,WANG Hongli,WEI Yuehui,SHI Hongzhi
Expression of microRNAs(miRNAs)profiles in two sRNA libraries which come from flue-cured tobacco leaves before and after topping were shown by Solexa sequencing technology.Totally 4,223,982 and 4,993,588 unique sRNA sequence reads were obtained in before and after topping leaves libraries.The matched miRNAs in before and after leave samples were 347 and 337 in which 83 and 71 were annotated sequences,respectively.Seven miRNAs were identified to be differentially expressed ones between leaves before and after topping.Compared with the expression profiles in before topping samples MiR-157 and MiR-156 were expressed at a relative high level while MiR-395,MiR-159c,MiR-159a,MiR-394 and MiR-399 were shown to be lower expressed.Three new miRNA sequence were predicted in which Nta-miRNA*-001 and Nta-miRNA*-002 were exist in the leave sample before topping and Nta-miRNA*-003 was exist in the after topping sample.The differentially expressed miRNAs indicated that topping can regulate the leaf vegetative growth and resistance ability.
flue-cured tobacco; leaf; topping; miRNA
10.3969/j.issn.1004-5708.2014.05.018
S572.01 文獻標識碼:A 文章編號:1004-5708(2014)05-0110-06
河南省高等學校青年骨干教師資助計劃項目(2011GGJS-045);河南省教育廳自然科學基礎研究計劃項目(2013A180474)
楊惠娟(1978—),副教授,從事煙草生物技術研究,Email:huijuanyang@henau.edu.cn
史宏志(1963—),教授,從事煙草栽培生理研究,Email:shihongzhi88@163.com
2013-10-12

