桔小實蠅Rab 家族基因鑒定和表達模式研究
彭 威,鄭薇薇,彭 濤,吳方玉,張宏宇
(華中農業大學植物科學技術學院,昆蟲資源利用與害蟲可持續治理湖北省重點實驗室,城市與園藝昆蟲研究所,武漢 430070)
桔小實蠅Bactrocera dorsalis (Hendel)俗稱果蛆,又名東方果實蠅(Oriental fruit fly),屬雙翅目 Diptera、實蠅科 Tephritidae、果實蠅 屬Bactrocera Macquart,是一種能導致果蔬業、花卉業嚴重經濟損失的毀滅性害蟲,在我國尤以對番石榴、芒果、柑桔、沙田柚等危害最重(韓日疇等,2005),由于其食性雜、寄主范圍廣、繁殖力強、傳播快、防治困難,被大多數國家和地區列為水果―頭號殺手(季清娥等,2007)。Rab 蛋白為一類進化上保守的GTP 結合蛋白,是質膜運輸的重要調控因子(Salminen et al.,1987),屬GTP結合蛋白Ras 超家族的成員(Wennerberg et al.,2005)。Rab 蛋白通常作為活性和非活性狀態循環的分子開關,以時空靈敏的方式整合質膜運輸和細胞間的信號傳導(Bucci et al.,2006)。盡管這類蛋白分子量小,只有20-25 kDa,結構分析顯示它們具有多個反應表面,通過這些反應表面參與調節分子和下游效應物,從而發揮功能(Chen et al.,2003)。Rab 蛋白廣泛參與了不同的細胞功能,包括質膜融合和分裂、細胞內吞作用、胞吐作用、囊泡轉運、細胞骨架運輸。Rab 蛋白作為囊泡運輸的重要調節因子,在囊泡的出泡形成、選擇、粘附、運動、錨定、融合等過程中起重要作用(Pfeffer et al.,2004)。目前發現,在裂殖酵母中含有7個Rab 蛋白,芽殖酵母編碼11個Rab 蛋白,線蟲、果蠅分別有29 種和33 種Rab 蛋白,擬南芥基因組編碼57 種Rab 蛋白,在人類Homo sapiens 已發現超過70 種Rab 蛋白和類Rab 蛋白。大約一半已知的Rab 蛋白研究表明,Rab 蛋白對信號傳遞,以及對細胞增殖和分化的控制很重要(Schwartz et al.,2008)。隨著研究的深入,人們發現Rab 蛋白在發育過程中調節信號傳導。早期胚胎細胞的命運受分泌信號蛋白如Hh、Wnt、TGFβ/Dpp的控制,信號濃度在空間和時間上的控制對正常發育來說至關重要,而受Rab 調控的胞內運輸調控著信號梯度和轉導(Seto et al.,2008)。此外,Rab 基因突變會影響細胞生長、壽命和其他生物學進程(Schwartz et al.,2008)。
隨著對Rab 蛋白研究的深入,關于Rab 蛋白在昆蟲上的研究也有諸多報道。Uno 等對家蠶的Rab 蛋白進行研究發現,Rab 蛋白會被家蠶腦部的蛋白激酶C 磷酸化 (Uno et al.,2004)。而Hiragaki 等人(2009)發現,磷酸化的Rab8 蛋白參與了昆蟲促前胸腺激素的分泌。對家蠶腦部的小分子GTP 結合蛋白Rab的研究發現,Rab7、Rab8 參與了家蠶腦部神經元中的蛋白運輸,而且它們可能在控制生理節律方面發揮了作用(Uno et al.,2010)。侯麗等人在對棉鈴蟲幼蟲到成蟲的發育研究中發現,Rab32 參與了成蟲腸道的重建(Hou et al.,2011)。除此之外,目前,Rab 在昆蟲發育中的作用研究主要集中在果蠅。例如,在果蠅卵母細胞的發育過程中,Rab6 對微管細胞骨架的組織和定位是必須的(Coutelis et al.,2007)。而Rab30 蛋白在果蠅胚胎發育中的背部閉合、胚胎頭部對合、胸部閉合等過程是必須的(Thomas et al.,2009)。張軍等人對果蠅的Rab35 蛋白研究發現,Rab35 蛋白調節剛毛發育過程肌動蛋白纖絲的聚集,以及可培養細胞偽足的形成 (Zhang et al.,2010)。由此可見,Rab 家族基因參與了果蠅諸多重要的生命活動。基因表達是生物體中遺傳信息傳遞和實現的中間環節,而基因表達模式是基因表達調控的體現和結果,因此對全基因組基因表達模式的研究有助于揭示基因表達途徑及其調控規律,同時揭示生物體基因型和表型之間的特定關系(謝建明等,2003)。對桔小實蠅7個Rab 家族成員進行鑒定并研究它們的基因表達模式能為揭示桔小實蠅Rab 家族基因功能提供基礎資料,同時對于篩選合適的基因功能研究靶標基因具有重要意義。
1 材料與方法
1.1 供試昆蟲
本研究中桔小實蠅來自華中農業大學城市與園藝昆蟲研究所建立的實驗室種群。飼養條件如下:溫度28℃,室內的相對濕度保持在70%-80%,光周期設置為12 h ∶12 h (L ∶D)(Li et al.,2011)。
1.2 主要試劑及試劑盒
主要試劑、試劑盒:Gibco/BRL 公司(美國)的瓊脂糖、Sigma 公司(美國)的焦磷酸二乙酯(DEPC)、北京博邁德生物的2× Tag PCR Master Mix、上海申能博彩公司的Taq DNA 聚合酶、北京百泰克生物技術有限公司的高純總RNA 快速提取試劑盒、TaKaRa 公司(日本)的RT-PCR 第一鏈合成試劑盒、Bio-Rad 公司(美國)的iQTM SYBR ?Green Supermix 試劑盒。
1.3 生物信息學和系統進化樹分析
從轉錄組文庫中獲取得到桔小實蠅7個Rab基因的核苷酸序列信息(Zheng et al.,2012)。用DNAman 完成核苷酸序列編輯及氨基酸序列推導。通過美國國家生物技術信息中心(NCBI)站點的BLASTX (http://www.nebi.nlm.nih.gov)查找各Rab 基因的高相似性序列。用ClustalX 2.0 對桔小實蠅Rab 家族基因氨基酸序列進行多重比對,分析其保守性,揭示其活性位點。用MEGA5.0 軟件neighbor-joining 方法構建Rab 蛋白進化樹,根據bootstrap 方法用1000個重復進行統計分析。
1.4 桔小實蠅各發育階段總RNA的提取
取桔小實蠅二齡幼蟲、三齡幼蟲、預蛹、蛹、成蟲各10 頭,分別提取各組整蟲總RNA。總RNA提取采用Bioteke 公司的高純總RNA 快速提取試劑盒(北京),具體操作參照試劑盒說明書。
1.5 1st-Strand cDNA的合成、cDNA 質量檢測
將各組樣本的總RNA 反轉錄為cDNA,具體操作參照TaKaRa 公司(日本)的RT-PCR 第一鏈合成試劑盒說明書。
取各樣本cDNA為模板,以桔小實蠅核糖體16S rRNA 設計引物,進行PCR 擴增,然后瓊脂糖凝膠檢測產物片段大小。
1.6 實時熒光定量PCR
根據轉錄組測序信息設計Rab 家族基因的熒光引物,桔小實蠅16SrRNA 作為內參基因。實驗中用到的引物名稱、堿基序列 (5' →3'):Rab1RTF (GCAGCGGAATACGCAAGTC)、Rab1RTR(TATCTCGGCAGCCATCGTC);Rab5RTF (AGCT CCTATGTACTATCGTGGTG)、Rab5RTR (TTTATG CAGTTCCTTGACCC);Rab7RTF (ACTTTCCTTTCG TGGTGCTCG)、Rab7RTR (GTACAGTTCAACCTCG GCTTC);Rab14RTF (TACTATCGTGGTGCTGCTG GTG)、Rab14RTR (GCAAACTCTTTGGCCTCTTCA);Rab18RTF (AAGTCAAGCCTCATTCGTCG)、Rab18 RTR (CTTCGGAATCTTTCAGCACC);Rab35RTF(G TAGACTTCAAGATACGCACCG)、Rab35RTR (CTA ACCATCGTCGTACATTCG);Rab40RTF (ACATGA GATATTATCCTGCCTTGA)、Rab40RTR (GCTTGA CACGTTTCCCTTCC);16s rRNARTF (CTCGTCCA ACCGTTCATACC)、16s rRNARTR (CTGACCTGCC CACTGAAGTT)。
實時熒光定量PCR 用iQTM SYBR ?Green Supermix (Bio-Rad,USA)試劑盒在Bio-RadiQ5 雙色實時熒光定量PCR 儀上進行。每個樣品設三個重復。熒光定量PCR 結束后分析溶解曲線,以確保特異性擴增。實時熒光定量PCR 結果由Opticon Monitor 軟 件2.03Version (MJ research,USA)量值2-ΔCt方法分析,以16S rRNA 表達量校正目的基因的相對表達量。
2 結果與分析
2.1 桔小實蠅Rab 基因生物信息學分析
我們從桔小實蠅轉錄組文庫中鑒定得到了7個Rab 基因全長 cDNA 序列 (Rab1 Genbank accession number:KF 859977;Rab5 Genbank accession number:KF 859978;Rab7 Genbank accession number:KF 859979;Rab14 Genbank accession number:KF 859980;Rab18 Genbank accession number:KF 859981;Rab35 Genbank accession number:KF 859982;Rab40 Genbank accession number:KF859983)。
通過NCBI的BLASTX 查找到與桔小實蠅7個Rab 基因的氨基酸序列對應的相似序列,相似性比對結果如表2 所示。結果顯示,除BdRab18 氨基酸序列與刺舌蠅Glossina morsitans Rab18的氨基酸序列相似度達到85%外,桔小實蠅其余Rab 基因的氨基酸序列均與黑腹果蠅D.melanogaster 所對應的Rab 基因的氨基酸序列相似度最高,相似度最高達到96%,最低也到達85%。
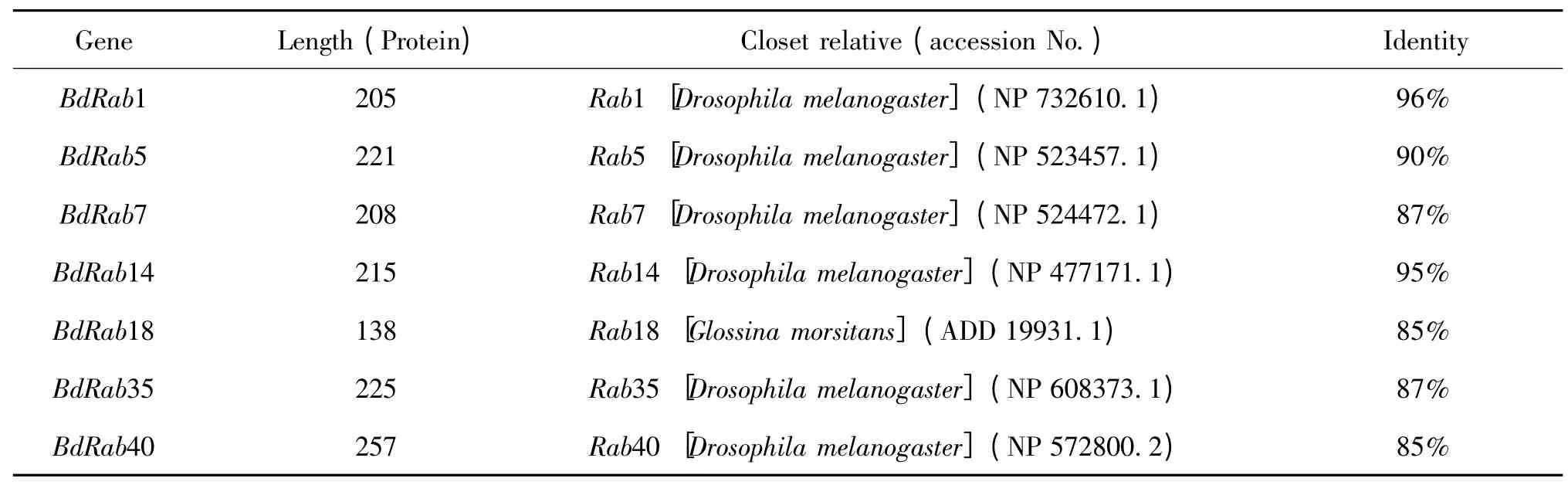
表1 桔小實蠅7個Rab 基因的氨基酸序列同源比對結果Table 1 Identity of amino acid sequence for Bactrocera dorsalis Rab genes
對桔小實蠅7個Rab 基因氨基酸序列進行比對分析,結果如圖1 所示。氨基酸序列比對顯示這7個Rab 氨基酸序列存在部分保守序列。而這些區域構成GTP/Mg2+結合位點和Rab 蛋白分子特征序列。其中,68 位F 和147-151 位GNKCD 構成GTP 結合位點,38-44 位GDSGVGK 構成Mg2+結合位點,64-68 位IGVDF、82-86KLQTW、94-97 位RFRSIT、100-104 位YYRGA、109-114位LVYDIT 均是Rab 蛋白特征序列。
2.2 桔小實蠅Rab 基因系統發育分析
對桔小實蠅7個Rab 基因構建系統發育樹,結果如圖2 所示。

圖1 桔小實蠅7個Rab 基因氨基酸序列多重比對結果Fig.1 Multiple alignment of amino acid sequences of 7 Rab genes for Bactrocera dorsalis

圖2 桔小實蠅7個Rab 基因的系統進化樹Fig.2 Phylogenetic analyses of 7 BdRab genes with other similar genes
桔小實蠅7個Rab 基因屬于不同的同源蛋白。結果顯示桔小實蠅7個Rab 基因與黑腹果蠅對應的7個Rab 基因進化距離最近。總共分為三大支,BdRab1、BdRab35、BdRab40 同屬一支,分別與DmRab1、DmRab35、DmRab40 進化距 離最近。BdRab5、BdRab14、BdRab18 同屬一支,分別與DmRab5、DmRab14、DmRab18 進化距離最近。BdRab7 對應DmRab7。
2.3 桔小實蠅Rab 基因表達模式分析
我們通過實時熒光定量PCR 檢測了桔小實蠅Rab 基因在不同發育階段的表達模式(圖3)。

圖3 BdRab 在桔小實蠅生命周期各階段的表達模式Fig.3 The expression pattern of BdRab in the life cycle of Bactrocera dorsalis
由圖3 可知,BdRab1 在三齡和蛹期表達量最高,BdRab5 在成蟲期高表達,BdRab7 在預蛹期高表達,BdRab14、BdRab18 均在三齡幼蟲期表達量顯著上調,BdRab35 在三齡和蛹期大量表達,BdRab40 在三齡幼蟲和成蟲期大量表達,暗示各基因在桔小實蠅不同發育過程中發揮功能。三齡幼蟲是化蛹前的準備階段,完全變態昆蟲蛹期進行著劇烈的舊組織解離和新組織的發生,需要大量營養物質和能量,化蛹前昆蟲大量取食并迅速生長,形態體積增大,為化蛹做好營養積累的準備。表明BdRab14、BdRab18 可能參與化蛹的準備活動。
3 結論與討論
我們對桔小實蠅Rab 基因的7個成員進行了生物信息學分析和表達模式研究。對桔小實蠅Rab家族成員基因進行表達模式研究,發現各基因表達模式有差異,暗示各基因在桔小實蠅生長發育過程中發揮不同的功能作用。其中BdRab5 在成蟲期顯著表達,而其它階段的表達則處于極低水平,說明其可能參與了成蟲期的重要生命活動過程。Seto 等研究發現Rab5 在果蠅翅的發育中通過錨定Wnt 蛋白調節了Wnt 信號通路 (Seto et al.,2006),這一報道則驗證了BdRab5 可能參與成蟲重要生命活動的假設。小分子GTP 結合蛋白亞家族成員Rab7 在桔小實蠅幼蟲二齡蛻皮、三齡變態階段尤其是預蛹階段有顯著表達,而這些階段與桔小實蠅幼蟲的化蛹發育階段有時間上重合,Rab7 可能參與到該過程。Rab7 屬于小分子GTP 結合蛋白亞家族Rab 家族,該家族成員較多,人類Homo sapiens 身上已發現超過70 種Rab 蛋白和Rab樣蛋白,它們在生命活動中扮演多種重要角色,大約一半已知的Rab 蛋白研究表明,Rab 蛋白對信號傳遞,以及對細胞增殖和分化的控制很重要,Rab 蛋白的突變會影響細胞生長、壽命和其他生物學進程 (Schwartz et al.,2008)。BdRab 14、BdRab 18 均在三齡幼蟲期顯著表達,在其它階段表達量都很低,而三齡幼蟲是化蛹前的準備階段,完全變態昆蟲蛹期進行著劇烈的舊組織解離和新組織的發生,需要大量營養物質和能量,化蛹前昆蟲大量取食并迅速生長,形態體積增大,為化蛹做好營養積累的準備。所以推測三者可能與化蛹的準備活動有關。然而,目前有關Rab 基因在桔小實蠅化蛹準備活動中的具體功能還未見報道,需要進一步的研究。Rab 蛋白是一類小分子GTP結合蛋白,對囊泡運輸和信號傳遞十分重要,對Rab 基因在桔小實蠅變態發育中表達模式的研究,不僅有助于闡明桔小實蠅變態發育的分子機制,而且可為桔小實蠅防治提供新思路和途徑。
References)
Bucci C,Chiariello M.Signal transduction gRABs attention [J].Cellular Signalling,2006,18 (1):1-8.
Chen J,Anderson JB,Weese-Scott CD,et al.MMDB:Entrez's 3Dstructure database [J].Nucleic Acids Research,2003,31:474-477.
Coutelis JB,Ephrussi A.Rab6 mediates membrane organization and determinant localization during Drosophila oogenesis [J].Development,2007,134:1419-1430.
Hiragaki S,Uno T,Takeda M.Putative regulatory mechanism of prothoracicotropic hormone (PTTH)secretion in the American cockroach,Periplaneta americana as inferred from co-localization of Rab8,PTTH,and protein kinase C in neurosecretory cells [J].Cell and Tissue Research,2009,335 (3):607-615.
Hou L,Wang JX,Zhao XF.Rab32 and the remodeling of the imaginal midgut in Helicoverpa armigera [J].Amino Acids,2011,40 (3):953-961.
Huang SQ,Han RC.Advance in the research on the quarantine pest Bactrocera dorsalis [J].Chinese Bulletin of Entomology,2005,42(5):479-484.[黃素青,韓日疇.橘小實蠅的研究進展.昆蟲知識,2005,42 (5):479-484]
Ji QE,Hou WR,Chen JH.Development of a genetic sexing strain and the sterile male technique of the Oriental fruit fly,Bactrocera dorsalis (Hendel)[J].Acta Entomologica Sinica,2007,50:1002-1008.[季清娥,侯偉榮,陳家驊.橘小實蠅遺傳性別品系的建立及雄性不育技術.昆蟲學報,2007,50:1002-1008]
Li XX,Zhang MY,Zhang HY.RNA interference of four genes in adult Bactrocera dorsalis by feeding their dsRNAs [J].PLoS One,2011,6,e17788.
Pfeffer S,Aivazian D.Targeting Rab GTPases to distinct membrane compartments [J].Nature Reviews Molecular Cell Biology,2004,11:886-896.
Salminen A,Novick PJ.A ras-like protein is required for a post-Golgi event in yeast secretion [J].Cell,1987,49 (04):527-538.
Schwartz1 SL,Cao CC,Pylypenko O,et al.Rab GTPase at a glance[J].Journal of Cell Science,2008,120:3904-3910.
Seto ES,Bellen HJ.Internalization is required for proper Wingless signaling in Drosophila melanogaster [J].The Journal of Cell Biology,2006,173 (01):95-106.
Thomas C,Rousset R,Noselli S.JNK signalling influences intracellular trafficking during Drosophila morphogenesis through regulation of the novel target gene Rab30 [J].Developmental Biology,2009,331(2):250-260.
Uno T,Hata K,Hiragaki S,Isoyama Y,et al.Small GTPases of the Rab family in the brain of Bombyx mori [J].Histochemistry and Cell Biology,2010,134 (6):615-622.
Uno T,Nakao A,Katsurauma C.Phosphorylation of Rab proteins from the brain of Bombyx mori [J].Archives of Insect Biochemistry and Physiology,2004,57 (2):68-77.
Wennerberg K,Rossman KL,Der CJ.The Ras superfamily at a glance[J].Journal of Cell Science,2005,118:843-846.
Xie JM,Sun X,Xie XY.Gene expression profile analysis and software system [J].Journal of Southeast University (Natural Science Edition),2003,1 (2):201-204.[謝建明,孫嘯,謝雪英.基因表達模式分析及軟件系統[J].東南大學學報,2003,01(02):201-204]
Zhang JZ,Enbo M,Kun YZ,et al.Silencing of two alternative splicing-derived mRNA variants of chitin synthasel gene by RNAi is lethal to the oriental migratory locust,Locusta migratoria manilensis(Meyen)[J].Insect Biochemistry and Molecular Biology,2010,40 (11):824-833.
Zheng W,Peng T,He W,et al.High-throughput sequencing to reveal genes involved in reproduction and development in Bactrocera dorsalis (Diptera:Tephritidae) [J].PLoS One,2012,7:e36463.

