SIRT1 mRNA在C2C12成肌細胞增殖過程中的時相性變化
李方暉
(肇慶學院 體育與健康學院,廣東 肇慶 526061)
骨骼肌衛星細胞(satellite cell,SC)是位于骨骼肌纖維的肌膜和基底膜之間的一種肌源性干細胞.SC所具有的再生及分化多潛能功能使其在骨骼肌損傷修復和可塑性方面起到關鍵性作用[1].在骨骼肌損傷的再生修復過程中,機體可通過自分泌和旁分泌的方式分泌生長因子,后者通過調控細胞內信號蛋白酶表達來實現對SC激活、分裂、增殖的控制.目前關于SC增殖過程中細胞應激蛋白酶的表達變化規律的研究較少.本研究從與SC增殖關系密切的第Ⅲ類組蛋白去乙酰化酶1(sirtuin1,SIRT1)入手,通過體外細胞培養技術培養小鼠C3H骨骼肌成肌細胞系(C2C12),采用MTT比色法測定細胞的增殖活性,運用實時熒光定量–聚合酶鏈反應(RT-PCR)技術檢測細胞增殖過程中SIRT1 mRNA的時相性表達,為進一步探討SC增殖影響因素,了解SC的生物特性,更好地利用影響因素指導臨床對骨骼肌損傷的治療,提供理論基礎.
1 材料與方法
1.1 細胞培養及處理
將含雙抗(青霉素100mg/mL、鏈霉素100mg/L)和10%胎牛血清(FBS)(杭州四季青)、22.5mmol/L D-葡萄糖的(DMEM)(Hyclone)培養液,置于含5%二氧化碳(CO2)、37℃的細胞培養箱中培養.細胞傳代常規胰酶消化,注意消化時間不宜過長,按1:3傳代,隔天換液.
1.2 指標測試
1.2.1 骨骼成肌細胞標準曲線和生長曲線
將生長良好的C2C12成肌細胞(中國科學院上海細胞庫)制成細胞懸液,取對數生長期細胞,以2×103個細胞接種于96孔板,細胞生長匯合后1~2 d開始實驗.取接種培養1 d的96孔板分別在移殖后1~5 d進行MTT檢測.具體步驟:加入10μL每孔5.00 g/L的MTT,37℃孵育4 h,不吸出培養基直接加入甲瓚裂解液100μL每孔,繼續置CO2培養箱內孵育4 h至甲瓚全部溶解,于微量振蕩器上輕輕震蕩混勻,用酶標儀(BIO-RAD550型,美國)測定570/655 nm處的吸光度值(OD值).每次實驗重復3次.根據擬合的標準曲線計算細胞數目.
1.2.2 信使核糖核酸提取和檢測
分別在移殖后1~5 d收取細胞樣品,用RT-PCR檢測SIRT1、甘油醛–3–磷酸脫氫酶(GAPDH)的mRNA表達.去除培養皿中細胞培養液,用Trizol一步法提取總核糖核酸(RNA),反轉錄和熒光定量聚合酶鏈式反應均參照試劑盒說明書(TaKaRa),引物見表1.反應條件:預變性(95℃,20 s);40個PCR循環(95℃,5 s;60℃,20 s,收集熒光),擴增反應結束后,再變性(95℃,75s),退火(55℃,60 s),然后從55℃緩慢加熱到95℃,15 s;每1℃收集熒光.結果表明,熔解曲線只顯示一個主波峰.說明PCR擴增的特異性較高,符合熒光定量PCR的技術要求(如圖1).反應結束后,RT-PCR儀給出各反應孔的Ct值,以GAPDH基因為內參,根據公式2-△△Ct計算各樣品目的基因的相對表達量.

表1 用于實時熒光定量PCR的引物序列一覽表

圖1 SIRT1基因PCR的擴增曲線(a)和溶解曲線(b)
1.3 統計學處理
實驗數據由SPSS 18.0統計軟件處理.結果以平均值和標準差(M±SD)表示,同一指標不同組間進行方差分析,統計學顯著性水平定為P<0.05,OD值與SIRT1 mRNA表達量之間進行相關性分析.
2 結果
2.1 體外培養C2C12成肌細胞的生長特性
圖2顯示,接種后由于細胞的貼壁和伸展,潛伏期為1~2 d.接種后第3天的細胞增殖活性與第1和第2天都有顯著性差異(P<0.05),第4天和第5天與第1和第2天相比都有極顯著性差異(P<0.01).這說明,骨骼肌衛星細胞自接種后第3天進入對數生長期,至第5天開始進入到平臺期.加入MTT溶液之前觀察細胞形態,發現已有部分骨骼肌衛星細胞開始相互融合形成肌管細胞.
2.2 SIRT1 mRNA表達
圖3結果顯示:與第1天相比,盡管第2天的SIRT1 mRNA表達增加1.5倍,但沒有顯著性差異(P>0.05);第3天增加了1.8倍(P<0.05);第4天和第5天分別增加2.3和2.4倍(P<0.01).此外,與第2天相比,第4天和第5天SIRT1 mRNA表達也分別增加1.5和1.6倍(P<0.05).

圖2 C2C12成肌細胞體外培養的生長曲線
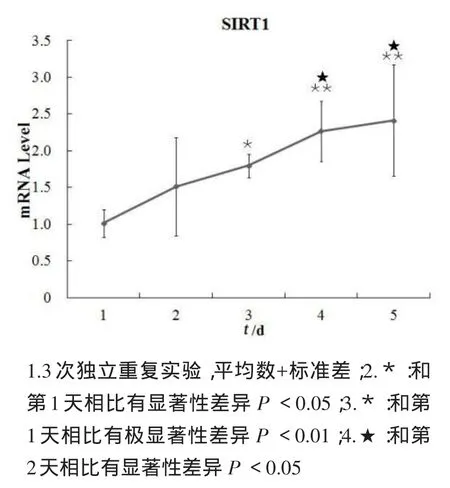
圖3 C2C12成肌細胞SIRT1 mRNA表達的時相性
2.3 相關性分析
將細胞增殖的OD值和3個基因的mRNA進行相關分析發現,SIRT1 mRNA相對表達水平與細胞增殖活性呈中度正相關(R2=0.873;P=0.02)(見圖4).
3 討論
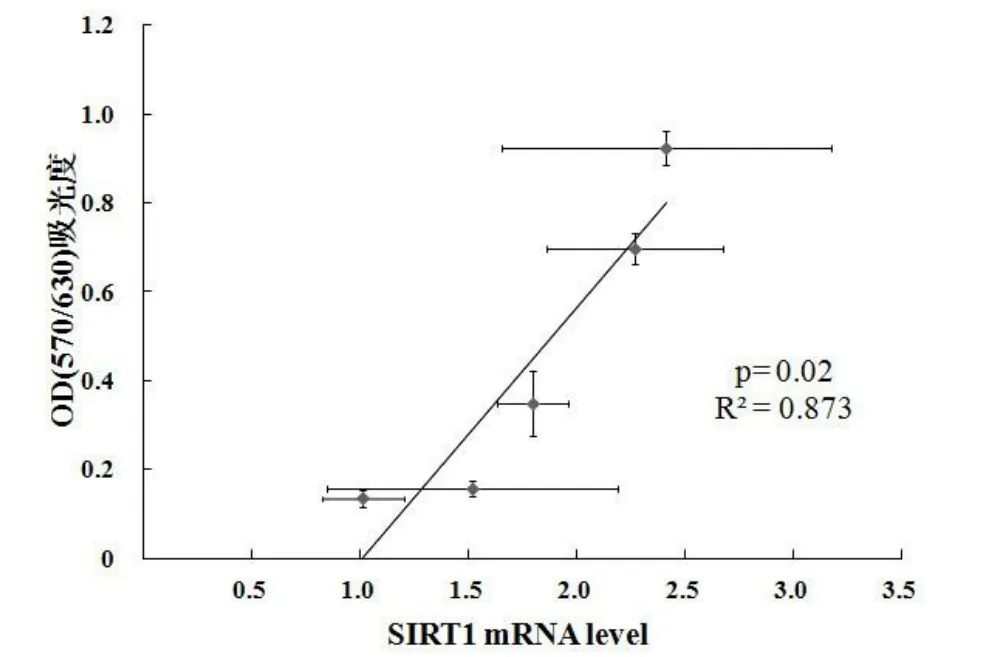
圖4 C2C12成肌細胞的增殖活性(OD值)和SIRT1 mRNA相關性
第Ⅲ類組蛋白去乙酰化酶1(SIRT1)作為應激因子,可通過調控細胞多種生理功能延長壽命[2].研究表明,SIRT1可調控成肌細胞生理功能,如增殖和分化[3-6].MCBURNEY MW等[3]通過敲除SIRT1基因發現,大鼠肌衛星細胞增殖活性削弱.衰老個體成肌細胞增殖活性降低可能與SIRT1活性降低有關[4].LIFanghui等[5]研究發現,SIRT1 mRNA表達減少跟高糖誘導的C2C12成肌細胞增殖功能紊亂相關.與高糖培養類似,高氧(20%)也能導致成肌細胞增殖功能失調.RATHBONE等[6]研究發現SIRT1表達減少介導高氧誘導的肌衛星細胞增殖抑制作用.直接補充SIRT1小分子活性物質白藜蘆醇能促進高氧條件或高糖環境下的成肌細胞增殖[6].提示成肌細胞增殖失調與SIRT1表達下調有關.
本文進一步研究了C2C12成肌細胞正常增殖過程的中SIRT1 mRNA表達后發現:前2 d增殖潛伏期的SIRT1表達是穩定的,盡管稍微有所增加,但不具有顯著性差異;第3天后SIRT1 mRNA表達出現遞增趨勢.前人研究也發現,潛伏期單個細胞分裂周期過程中的2~18 h SIRT1表達是穩定的[7],第3 d后細胞增殖進入對數期,細胞增殖速度加快.增殖速度越快勢必導致細胞內的DNA復制速率越快,DNA復制過程的錯誤率就會增加.由于SIRT1具有維持基因組的功能穩定[7]和端粒酶活性[8]的作用,因此,SIRT1表達增加剛好配合對數增殖期的細胞增殖速度,進而維持增殖穩定性.圖4顯示C2C12成肌細胞整個增殖過程與SIRT1 mRNA表達有中度的相關性.這也得到了成纖維細胞研究的佐證[8].增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)是評價細胞增殖狀態的重要指標.成纖維細胞研究發現,SIRT1蛋白表達與PCNA成中度正相關[8].人胚胎干細胞增殖潛能強于誘導多潛能干細胞來源的血管內皮細胞,而后者強于正常成人血管內皮細胞.研究也發現,這3種細胞增殖潛能的高低是由SIRT1表達決定的,人胚胎干細胞SIRT1表達最高,誘導多潛能干細胞來源的血管內皮細胞次之,成人血管內皮細胞最低[9].這也間接說明了SIRT1表達跟不同類型細胞增殖活性成正相關.
[1]YEL,LEEK O,SU L P,et al.Skeletal myoblast transplantation for attenuation of hyperglycaemia,hyperinsulinaemia and glu cose intolerance in a mouse model of type2 diabetes mellitus[J].Diabetologia,2009,52(9):1925-1934.
[2]李方暉,曹偉,趙軍,等.Sirtuins去乙酰化酶的功能及其在體育科學中的應用[J].體育學刊,2011,18(6):138-144.
[3]MCBURNEY M W,YANG X,JARDINEK,et al.The absence of SIR2alpha protein has no effect on global gene silencing in mouse embryonic stem cells[J].Mol Cancer Res,2003,1(5):402-409.
[4]MACHIDA S,BOOTH FW.Insulin-like growth factor 1 and muscle growth:implication for satellite cell proliferation[J].Proceedingsof the Nutrition Society,2004,63,337-340.
[5]LI Fanghui,WEI Enxiu,LIU Yanying,et al.PI-3K mediated modulation of red light and resveratrol on high glucose induced dysfunctional myoblasts[J].Lasers Surg Med,2011,43(S23):54-55.
[6]RATHBONE C R,BOOTH F W,LEESSJ.Sirt1 increases skeletal muscle precursor cell proliferation[J].Eur JCell Biol,2009,88(1):35-44.
[7]YUAN J,PU M,ZHANG Z,et al.Histone H3-K56 acetylation is important for genomic stability in mammals[J].Cell Cycle,2009,8(11):1747-1753.
[8]PALACIOSJA,HERRANZ D,DE BONISM L,et al.SIRT1 contributes to telomere maintenance and augments global ho mologous recombination[J].JCell Biol,2010,191(7):1299-1313.
[9]SASAKIT,MAIERB,BARTKEA,et al.Progressive loss of SIRT1 with cell cycle withdrawal[J].Aging Cell,2006,5(5):413-422.
[10]HOMMA K,SONEM,TAURA D,et al.sirt1 plays an important rolein mediating greater functionality of human ES/iPS-derived vascular endothelial cells[J].Atherosclerosis,2010,212(1):42-47.
- 肇慶學院學報的其它文章
- 磁控RF-SIM卡的設計與實現

