響應面分析法優(yōu)化紫茄皮花色苷的提取工藝
郭 菲,劉 繼,黃 彭,劉東杰,熊亞波,秦 文
(四川農(nóng)業(yè)大學食品學院,四川雅安 625014)
響應面分析法優(yōu)化紫茄皮花色苷的提取工藝
郭 菲,劉 繼,黃 彭,劉東杰,熊亞波,秦 文*
(四川農(nóng)業(yè)大學食品學院,四川雅安 625014)
以紫茄皮為研究對象,利用有機溶劑提取花色苷,并以花色苷提取液的吸光值作為提取效果指標,采用響應面分析法優(yōu)化紫茄皮花色苷的提取條件。在單因素實驗的基礎上,選取提取溫度(℃)、液料比(mL/g)、提取時間作為自變量,A525V/m(V:提取劑用量,m:樣品質(zhì)量)作為響應值,利用Box-Behnken中心組合設計原理和響應面分析法,研究各自變量及其交互作用對花色苷提取效果的影響,在提取劑為70%乙醇(含0.05%鹽酸,V/V)的條件下,確定最佳提取條件為提取溫度38℃、液料比19∶1mL/g、提取時間95min。在此工藝條件下,花色苷提取效果A525為12.752,與理論預測值12.876相差0.124。說明通過響應面優(yōu)化后得出的方程具有一定的實踐指導意義。
紫茄皮,花色苷,提取,響應面分析法
茄子(eggplant),學名(SolanummelongenaL.),也叫落蘇、昆侖瓜,是茄科(Solanaceae)茄屬茄種的一年生草本植物,熱帶為多年生。茄子最早產(chǎn)于印度,公元4~5世紀傳入中國,全國大部地區(qū)有栽培[1]。花青素(Anthocyanidin)類為2-苯基苯并吡喃陽離子衍生物,屬類黃酮物質(zhì)的一種,結構中有多個酚羥基或酚羥基與烷基或糖基而形成的醚或苷,當分子中有糖基時稱為花色苷[2]。花青素在自然界分布廣泛,是植物的主要水溶性色素之一。初步統(tǒng)計就有27個科72個屬的植物都含花青素[3]。人們試圖從各種動植物資源中獲取天然色素,同時探索其生理活性,來緩解并解決由合成色素所帶來的各種問題,因此天然色素具有廣泛的應用潛力[4]。國內(nèi)外學者對花色苷的功能已有相關報道,在保健食品應用中,這一類植物色素具有抗氧化[5-7]、降低血脂[8]、增強人體免疫機能[9]等作用。目前,對紫茄皮花色苷的提取方法主要有有機溶劑提取法[10]、微波法[11]、超聲波法[12]和超臨界CO2萃取[13]等方法。在有些研究中,對比了溶劑法和超聲波提取法,由于超聲波的作用,使得提取液粘度增大,從而效果不理想。可見,溶劑法要比超聲波法提取效果好[14-15]。而超臨界萃取法的設備和操作復雜,不主張作為主要的提取方法,所以在本實驗中采用有機溶劑來提取紫茄皮中的花色苷。在國內(nèi)目前在食用茄子時多將茄子皮丟棄[16],這不僅造成了資源浪費也給環(huán)境造成負擔。本實驗利用有機溶劑對紫茄皮中的花色苷提取進行研究,在單因素實驗基礎上通過響應面法來優(yōu)化紫茄皮中花色苷最佳提取工藝條件,為今后的紫茄皮的綜合開發(fā)利用提供了可行性依據(jù),為使用天然色素提供了基礎研究資料。
1 材料與方法
1.1 材料與儀器
紫茄 購于蔬菜批發(fā)市場;乙醇、鹽酸 均為分析純。
DHG-9245A型電熱恒溫鼓風干燥箱 上海一恒科技有限公司;V-3200型紫外可見分光光度計 上海尤尼柯儀器有限公司;BS210S型電子天平 塞多利斯北京天平有限公司;PHS-3C型酸度計 上海雷磁公司;W80高速萬能粉碎機 天津市泰斯特儀器有限公司。
1.2 實驗方法
1.2.1 紫茄皮預處理 將紫茄洗凈,均勻削皮,烘箱30℃烘24h,粉碎,過40目標準篩,棕色瓶冷藏保存。
1.2.2 紫茄皮花色苷的提取 以70%乙醇(含0.05%鹽酸,V/V)為提取劑,40℃浸提90min,抽濾過后取上清液,40℃真空濃縮回收乙醇,得到花色苷濃縮液。
1.2.3 紫茄皮花色苷可見光最大吸收波長的確定 取適量濃縮液用pH3.0檸檬酸-磷酸二氫鈉緩沖溶液稀釋,穩(wěn)定1h,200~700nm全波長掃描,繪制光譜圖,并與文獻[17-18]中花色苷光譜進行比較,同時確定可見光區(qū)最大吸收波長。
1.2.4 花色苷的測定 本實驗采用單pH測定法[19]。將待測花色苷溶液的溶劑用緩沖溶液替換,把pH調(diào)節(jié)至3.0,再采用分光光度法,根據(jù)朗伯-比爾定律,即A=εbc,其中:ε為摩爾吸收系數(shù),是吸光系數(shù)在給定的波長和溶劑下的特征常數(shù),所以在一定溫度和介質(zhì)條件下,ε為定值,b=1.0cm。因此在一定范圍內(nèi)A與花色苷的濃度成正比。本實驗部分以吸光度Aλmax作為實驗指標,衡量提取花色苷的提取效果。
1.2.5 提取工藝參數(shù)的確定
1.2.5.1 提取劑濃度的確定 以不同濃度乙醇(含0.05%鹽酸)為提取劑,其濃度分別為20%、30%、40%、50%、60%、70%、80%和90%。提取溫度40℃,液料比20∶1,提取時間90min,最后測定A525。
1.2.5.2 提取劑pH的確定 依據(jù)1.2.5.1研究基礎,選取70%乙醇為提取劑,用5%鹽酸和5%氫氧化鈉溶液調(diào)節(jié)pH分別為1、2、3、4、5、6。提取溫度40℃,液料比20∶1,提取時間90min,最后測定A525。
1.2.5.3 單因素實驗 a.提取溫度的確定:準確稱取紫茄皮1.00g置于50mL三角瓶中,液料比為20∶1,封口浸提,遮光,浸提溫度為30、40、50、60、70、80℃,時間為90min,測定A525。
b.液料比的確定:準確稱取紫茄皮1.00g置于50mL三角瓶中,液料比為15∶1、20∶1、25∶1、30∶1、35∶1、40∶1,封口浸提,遮光,浸提溫度40℃,時間為90min,測定A525V/m。其中V為提取劑用量(mL),m為樣品量(g)。在提取的過程中,由于液料比不同則提取劑的體積不同,即不同的稀釋比例會有不同的測定值。在單因素的提取溫度和時間的實驗中液料比為定值,不存在提取劑造成的體積差距而影響測定值,所以在料液比的實驗和響應面分析實驗中以A525V/m來表示提取效果[20]。
c.提取時間的確定:準確稱取紫茄皮1.00g于50mL三角瓶中,液料比為20∶1,封口浸提,遮光,浸提溫度為40℃,時間為30、60、90、120、150、180min,測定A525。
1.2.6 紫茄皮花色苷提取響應面實驗 在提取溫度、液料比、提取時間3個單因素實驗基礎上,把單因素定為自變量,A525V/m定為花色苷提取效果指標,設計三因素三水平17個實驗點的響應面實驗對紫茄皮花色苷提取工藝條件進行優(yōu)化,因素水平見表1。
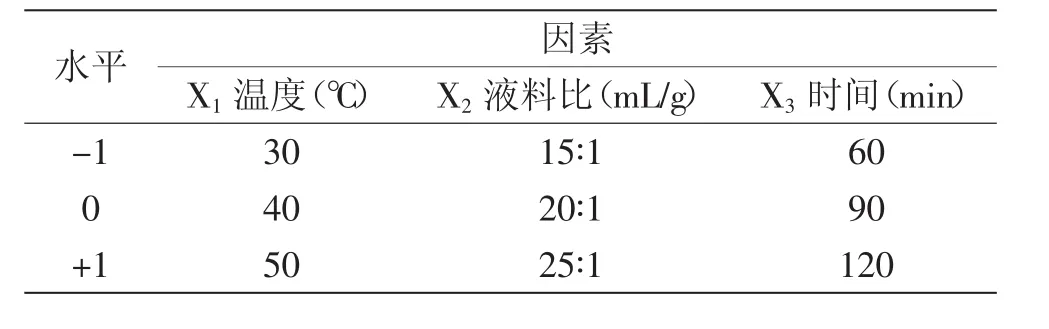
表1 響應面分析因子與水平表Table 1 Independent variables and their coded and actual values used for optimization
2 結果與分析
2.1 紫茄皮花色苷的紫外-可見掃描光譜分析
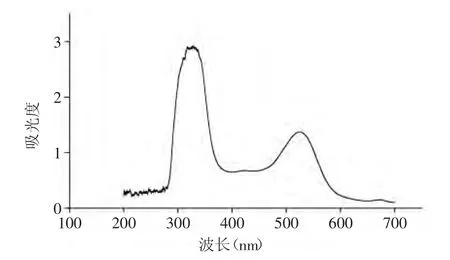
圖1 紫茄皮花色苷紫外-可見掃描光譜圖Fig.1 UV-visible scanning spectrum of purple eggplant-peel anthocyanins
由圖1可知,紫茄皮花色苷有2個明顯的吸收峰,分別出現(xiàn)在320~340nm,52~530nm。其中320nm~340nm為有機酸類物質(zhì)羧基的特征吸收峰,520~530nm為花色苷類物質(zhì)特征吸收峰[21]。由圖1可知,在525nm出現(xiàn)可見光范圍內(nèi)的最大吸收波長,并且紫茄皮色素為花色苷類色素,因此選擇525nm作為實驗的檢驗波長。
2.2 提取工藝參數(shù)結果
2.2.1 乙醇濃度對提取效果的影響 由圖2可知,在乙醇濃度為20%~70%時隨著乙醇濃度的增加提取量逐漸上升,在70%時達到最大值,吸光度為0.95,在乙醇濃度為70%~90%范圍內(nèi)隨著乙醇濃度的增加提取量逐漸降低,這主要是隨著乙醇濃度的增加導致溶液極性的改變使提取液中雜質(zhì)的含量增加,因此選擇70%的酸化乙醇作為提取劑。
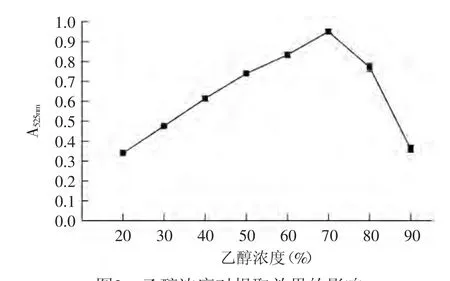
圖2 乙醇濃度對提取效果的影響Fig.2 Effect of alcohol concentrations on the extraction efficiency
2.2.2 pH對提取效果的影響 從表2可知,提取劑pH對色素提取效果有明顯影響,在pH1~3時,紫茄皮花色苷的提取量較高。因pH1.0強酸性條件下,加熱并長時間提取時,容易發(fā)生花色苷部分水解[22],所以選取提取劑pH3.0為最佳。經(jīng)測定,70%乙醇(含0.05%鹽酸)pH=2.86~2.98,故后續(xù)實驗采用70%(含0.05%鹽酸)作為提取劑。
2.2.3 單因素實驗結果與分析
2.2.3.1 溫度對紫茄皮花色苷提取效果的影響 液料比為20∶1,以70%(含0.05%鹽酸)乙醇作為提取劑,在不同溫度下提取90min。各條件3次重復。如圖3所示,在30~40℃范圍內(nèi),花色苷提取效果隨著溫度的升高而上升,溫度升高增加了溶劑分子和活性物質(zhì)分子的動能,加速了分子運動進而促進擴散作用,在40℃時吸光度達到最大值1.0185,提取效果最好。在50~80℃范圍內(nèi),花色苷提取效果隨溫度的升高而下降,80℃時提取效果最差,吸光值只有0.74。說明提取溫度不能過高,過高的溫度會導致花色苷降解。因此提取溫度應控制在40℃。本研究符合花色苷熱降解動力學理論[23]。
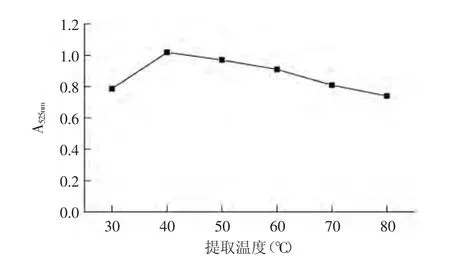
圖3 溫度對提取效果的影響Fig.3 Effect of temperature affect on the extraction efficiency
2.2.3.2 液料比對紫茄皮花色苷提取效果的影響 溫度40℃,以70%(含0.05%鹽酸)乙醇作為提取劑,在不同的液料比下提取90min。各條件3次重復。如圖4所示,在乙醇濃度、溫度、時間一定的情況下,液料比為15∶1~20∶1時,花色苷的提取效果呈上升趨勢,在液料比為20∶1時A525V/m最大為22.466。隨著液料比的增大提取效果變小,當液料比在30∶1后,提取效果的變化較小,這主要是因為對于固定原料的量隨著提取劑量的增加,溶質(zhì)能逐漸充分溶于提取劑中,所以A525V/m變化不大。因此選擇固定液料比在20∶1進行下實驗。
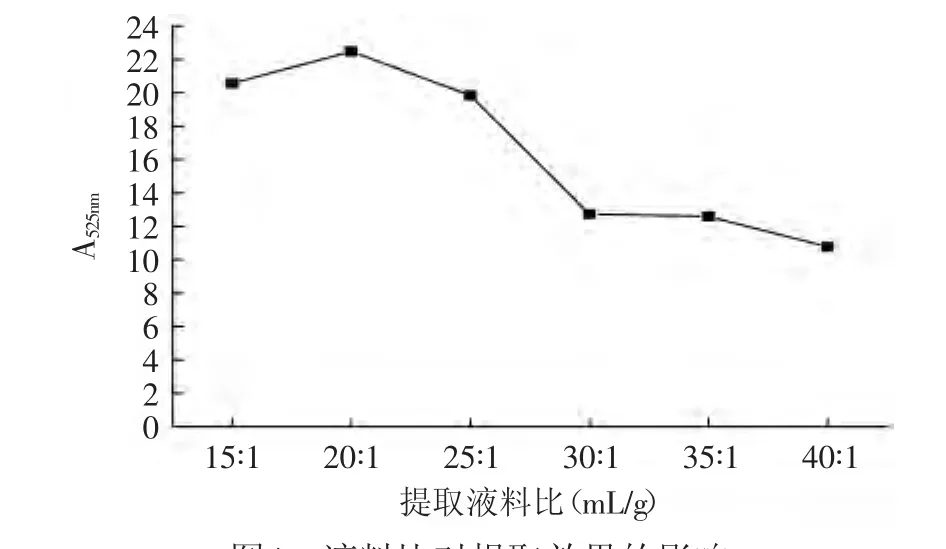
圖4 液料比對提取效果的影響Fig.4 Effect of liquid-solid ratio on the extraction efficiency
2.2.3.3 提取時間對紫茄皮花色苷提取效果的影響
液料比20∶1,溫度為40℃,以70%(含0.05%鹽酸)乙醇作為提取劑,設定不同的提取時間。各條件3次重復。如圖5所示,乙醇濃度、提取溫度和液料比一定時,隨著提取時間的延長,花色苷的提取效果先升高,在90min時提取效果最好,吸光值達到0.752。當提取時間超過90min后,提取效果呈下降趨勢。分析原因可能是在90min以前,隨著時間的延長,花色苷的積累越來越多,但超過90min,長時間的高溫破壞了花色苷的結構,花色苷發(fā)生熱降解,加之光照及氧化作用,導致花色苷穩(wěn)定性下降[24],故不宜在加熱情況下長時間提取。因此提取時間應該控制在90min。

圖5 時間對提取效果的影響Fig.5 Time affect on the extraction efficiency

表2 pH對提取效果的影響Table 2 Effect of solvent pH on extraction yield(20∶1,40℃,90min)
2.3 響應面法優(yōu)化提取工藝結果分析
2.3.1 響應面實驗設計及結果 根據(jù)Box-Behnken的中心組合實驗設計原理,總結單因素實驗結果,選取液料比、提取時間、提取溫度對花色苷提取影響顯著的3個因素,采用Design Expert 8.0.6設計軟件設計響應面實驗,分別用X1、X2、X3來表示提取溫度、液料比、提取時間,并以-1、0、+1分別代表變量的水平,實驗設計及結果見表3。

表3 Box-Behnken響應面實驗設計及結果Table 3 Box-Behnken experimental design and result
2.3.2 響應面法實驗數(shù)據(jù)處理及數(shù)值分析 為了研究不同條件對紫茄皮花色苷制備的影響和確定最佳制備條件,在單因素實驗基礎上進行響應面曲面分析實驗,在17個實驗點中有1~12是析因點,13~17是零點,也就是區(qū)域的中心點,利用這5個點可以估計整個實驗誤差。以A525V/m為響應值,通過響應面分析法分析后,得到各實驗因子對響應值的影響的二階多項式方程:
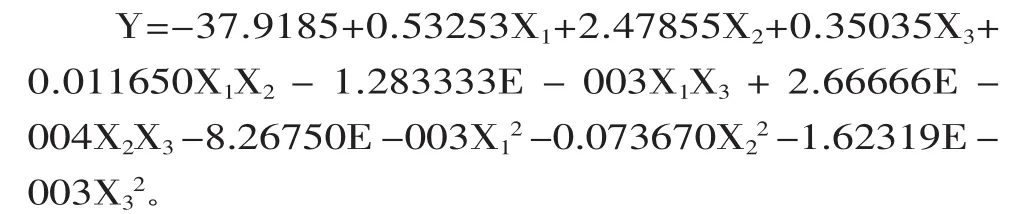
對二階多項式方程進行分析,其結果見表4。
由表4可知,此響應面回歸模型達到顯著水平(p<0.05),且模型p=0.0001,表明模型的顯著性極高,不同處理之間的差異性極大。CV值為3較低,說明實驗操作的可信度較高。
模型的調(diào)整系數(shù)R2Adj=94.59%(表4),說明該模型能解釋94.59%的響應值的變化,擬合程度良好,實驗誤差較小。決定系數(shù)(R2)和調(diào)整系數(shù)(R2Adj)分別為97.63%和94.59%,具有很好的一致性,可以用此模型來對紫茄皮花色苷得率進行分析和預測[25]。對模型回歸方程系數(shù)的顯著性實驗表明:影響花色苷提取效果的主要因素的次序是X2>X1>X3,二次項X12、X22、X32,交互項X1X2、X1X3顯著,表明提取溫度與液料比及提取溫度與提取時間等的交互作用等對紫茄皮花色苷的提取效果有較為顯著的影響[26-27]。

表4 回歸模型的方差分析Table 4 Variance Analysis of regression model
2.3.3 響應面曲面分析 響應面圖形是響應值對各因素所構成的三維空間的曲面圖[28]。等高線的形狀反映交互效應的強弱大小,橢圓形表示兩個因素交互作用顯著[29]。為進一步考察3個因素兩兩之間的交互作用對花色苷提取效果的影響,對其響應面曲線進行分析,從響應面圖中找到優(yōu)化區(qū)域,在優(yōu)化區(qū)域內(nèi)通過調(diào)整各因素的數(shù)值大小來滿足花色苷提取過程中的實際需要,最終得到較好的花色苷提取條件。
2.3.3.1 提取溫度和液料比對花色苷提取效果的影響 由圖6可知,當提取時間為90min時,隨著提取溫度和液料比的升高,紫茄皮花色苷提取效果先升高后降低,響應面相對較陡,表明對提取溫度和液料比對花色苷提取效果的影響較大。一方面,當溫度過高時,花色苷會降解,不利于花色苷的穩(wěn)定。另一方面,隨著液料比的升高,花色苷的提取效果升高,但是當超過一定范圍后,其提取效果不升反降。
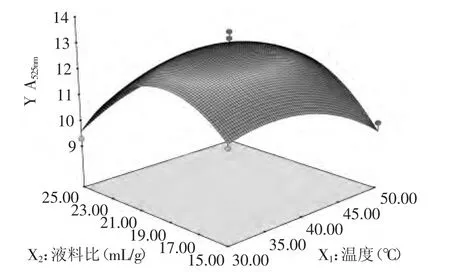
圖6 提取溫度和液料比對花色苷提取效果影響的曲面線圖Fig.6 Response surface diagram of effect between extraction temperature and liquid-solid ratio
2.3.3.2 提取溫度和提取時間對花色苷提取效果的影響 由圖7可知,響應曲面的坡度較抖,表明花色苷的提取效果對提取溫度和提取時間的變化較敏感。特別是提取時間變化對花色苷提取效果的影響比提取溫度的影響大。提取溫度選擇35~45℃之間,提取時間選擇80~95min之間可以得到較好的花色苷提取效果。
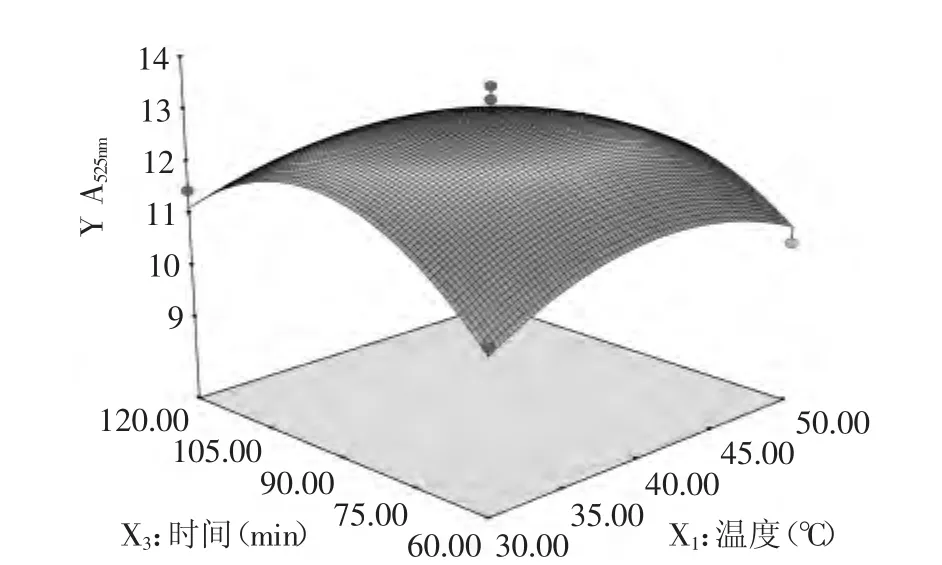
圖7 提取溫度和提取時間對花色苷提取效果影響的曲面線圖Fig.7 Response surface diagram of effect between extraction temperature and extraction time
2.4 驗證實驗
經(jīng)Design-Expert 8.0.6軟件分析優(yōu)化,可得到紫茄皮花色苷最佳提取工藝參數(shù)為提取溫度37.60℃、液料比18.90∶1mL/g、提取時間93.49min,在此最佳工藝條件下花色苷提取效果A525理論值為12.876。考慮到可操作性,將最優(yōu)提取條件調(diào)整為提取溫度38℃、液料比19∶1mL/g、提取時間95min。用此條件進行驗證實驗,得到花色苷提取效果A525為12.752,與理論預測值12.876僅相差0.124,兩者一致性高,說明優(yōu)化結果可靠。
3 結論
本文以紫茄皮為原料,乙醇作為提取劑,花色苷提取液的吸光值作為提取效果指標,采用響應面分析法優(yōu)化紫茄皮花色苷的提取條件。實驗中不同濃度的乙醇對花色苷的提取效果不同,提取劑的pH同樣影響紫茄皮花色苷的提取效果。經(jīng)實驗確定,在紫茄皮中提取花色苷宜采用70%乙醇(含0.05%鹽酸)作為提取劑。通過單因素實驗可知,最佳的單因素組合為溫度40℃、時間90min、液料比20∶1。在單因素的基礎上利用實驗設計軟件Design-Expert 8.0.6,采用Box-Behnken中心組合實驗設計以及響應面分析對紫茄皮花色苷提取工藝進行優(yōu)化,得出了紫茄皮花色苷提取各因素變量的二次方程模型,該模型具有統(tǒng)計學意義,對實驗擬合較好,并獲得優(yōu)化工藝的條件為提取溫度38℃、液料比19∶1mL/g、提取時間95min。在此工藝條件下,花色苷提取效果A525為12.752,與理論預測值12.876相差0.124。由此可以看出,采用酸性乙醇作為提取溶劑,經(jīng)過響應面法優(yōu)化提取工藝,能夠更好地提取紫茄皮中的花色苷。
[1]貢樹銘.佳蔬良藥話紫茄[J].中醫(yī)藥文化,2013(2):41-42.
[2]陳俊成.食用天然色素——花青素簡介[N].中國食品質(zhì)量報,2004-04-03(7).
[3]McDougall G J,F(xiàn)yffe S,Dobson P,et al.Anthocyanins from red cabbage-stability to simulated gastrointestinal digestion[J].Phytochemistry,2007,68(9):1285-1294.
[4]孫曉俠,吳珊珊,王改玲.超聲波強化提取黑米皮色素的工藝研究[J].中國釀造,2010(9):133-136.
[5]Ogawa K,Sakakibara H,Iwata R,et al.Anthocyanin composition and antioxidant activity of the Crowberry(Empetrum nigrum)and other berries[J].J Agric Food Chem,2008,56(12):4457-4462.
[6]Boulekbache-Makhlouf L,Medouni L,Medouni-Adrar S,et al.Effect of solvents extraction on phenolic content and antioxidant activity of the byproduct of eggplant[J].Industrial Crops and Products,2013,49(1):668-674.
[7]趙芳,邊麗,胡棟梁.茄子皮紅色素抗氧化活性研究[J].食品與機械,2008(2):62-64.
[8]趙海田,王振宇,王路,等.花色苷類物質(zhì)降血脂機制研究進展[J].東北農(nóng)業(yè)大學學報,2012(3):139-144.
[9]孟憲軍,畢菀芩,張琦,等.藍莓花色苷對大鼠視網(wǎng)膜光損傷的保護作用及其機制[J].食品科學,2013(11):242-245.
[10]董麗花,閆超.茄子皮色素的最佳提取工藝和穩(wěn)定性研究[J].中國調(diào)味品,2008(12):80-83.
[11]梁黨,張會香,楊世軍.茄子皮中紫色素的微波法提取工藝和穩(wěn)定性研究[J].食品研究與開發(fā),2010(8):237-240.
[12]王順民,郭紅轉,周麗娟,等.茄子皮天然紅色素超聲波提取及理化性質(zhì)研究[J].農(nóng)產(chǎn)品加工·學刊,2008(2):12-14.
[13]Chatterjee D,Jadhav N T,Bhattacharjee P.Solvent and supercritical carbon dioxide extraction of color from eggplants:Characterization and food applications[J].LWT-Food Science and Technology,2013,51(1):319-324.
[14]滕學峰.黑大豆皮中色素的提取純化、結構鑒定及其性質(zhì)的研究[D].哈爾濱:東北農(nóng)業(yè)大學,2008.
[15]劉妍妍.紅甘藍花色苷的提取純化、穩(wěn)定性及抗氧化活性研究[D].哈爾濱:東北農(nóng)業(yè)大學,2009.
[16]呂明.拌茄泥吃茄子營養(yǎng)損失少[J].農(nóng)業(yè)知識,2012(23):60.
[17]盧鋒波,劉桂玲,王爍,等.響應面法優(yōu)化果膠酶酶解提取黑莓花色苷的工藝參數(shù)[J].食品科學,2010(16):11-15.
[18]陳冠林,胡坤,高永清,等.紫紅肉火龍果果皮色素提取工藝的響應面法優(yōu)化[J].湖北農(nóng)業(yè)科學,2013(2):418-422.
[19]黃昉,徐志宏,李汴生,等.黑豆種皮色素的測定和提取[J].食品工業(yè)科技,2004(4):117-119.
[20]鄧潔紅.刺葡萄皮色素的研究[D].長沙:湖南農(nóng)業(yè)大學,2007.
[21]韓永斌.紫甘薯花色苷提取工藝與組分分析及其穩(wěn)定性和抗氧化性研究[D].南京:南京農(nóng)業(yè)大學,2007.
[22]Bonilla F,Mayen M,Merida J,et al.Extraction of phenolic compounds from red grape marc for use as food lipid antioxidants [J].Food Chemistry,1999,66(2):209-215.
[23]何玲,唐愛均,洪鋒.紅提葡萄紅色素穩(wěn)定性的研究[J].西北農(nóng)林科技大學學報:自然科學版,2005(9):73-76.
[24]Chigurupati N,Saiki L,Gayser Jr C,et al.Evaluation of red cabbage dye as a potential natural color for pharmaceutical use [J].International Journal of Pharmaceutics,2002,241(2):293-299.
[25]Bai X L,Yue T L,Yuan Y H,et al.Optimization of microwave-assisted extraction of polyphenols from apple pomace using response surface methodology and HPLC analysis[J].J Sep Sci,2010,33(23-24):3751-3758.
[26]卞清德,馬英昌,羅淑年,等.固定化磷脂酶用于大豆油脫膠的研究[J].中國油脂,2009(7):1-4.
[27]馬志虎,侯喜林,湯興利,等.響應面法優(yōu)化超臨界CO2萃取韭菜籽油[J].中國油脂,2009(7):13-17.
[28]王淑霞,李愛梅,張俊杰,等.響應面分析法優(yōu)化龍眼核中多酚物質(zhì)提取工藝[J].食品科學,2011(10):35-39.
[29]范龔健,韓永斌,顧振新.用響應面法優(yōu)化紅甘藍色素提取工藝參數(shù)[J].南京農(nóng)業(yè)大學學報,2006(1):103-107.
Optimization of anthocyanins extraction conditions of purple eggplant-peel by response surface methodology
GUO Fei,LIU Ji,HUANG Peng,LIU Dong-jie,XIONG Ya-bo,QIN Wen*
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
Using purple eggplant-peel as the research object,organic solvent extraction as the method,with the anthocyanin solution absorbance as a measure indicator.Response surface analysis method was used to optimize the extraction condition of purple eggplant-peel anthocyanins.On the basis of single factor experiments,extraction temperature,liquid-solid ratio(mL/g)and extraction time were chosen as arguments and A525V/m(V:extracting agent,m:the sample quality)as response value.The interaction of the respective variables and their influence on the extraction rate were studied by using Box-Benhnken central composite design and response surface analysis theory.Under the condition of 70%ethanol(containing 0.05%hydrochloric acid,V/V),the optimum extraction condition for extraction was obtained.Results showed that optimum conditions were:the temperature was 38℃,liquid-solid ratio was 19∶1,extraction time was 95min.Under these conditions,A525,the effect of anthocyanins extraction was 12.752.Comparing with the theoretical value 12.876,the relative error was 0.124.Results indicated that the equation derived by response regression equation had some practical significance.
purple eggplant-peel;anthocyanins;extraction;response surface method
TS255.1
B
1002-0306(2014)06-0268-06
2013-07-30 *通訊聯(lián)系人
郭菲(1987-),女,碩士研究生,研究方向:食品科學。

