陽離子對 8-氧 -7,8-二氫 -2′-去氧鳥嘌呤核苷構型的影響
鄭 妍, 梁曉琴, 李來才
(四川師范大學化學與材料科學學院,四川成都610066)
1 研究背景
去氧鳥苷是DNA的基本組成之一,由一個鳥嘌呤堿基和一個去氧核糖通過N—糖苷鍵連接而成.活性氧(ROS)進攻鳥嘌呤導致幾種氧化產物,其中最容易進攻的位置是C8原子,而相應的氧化產物是8-氧-7,8-二氫鳥嘌呤(8-oxoG).在DNA復制時,8-oxoG可直接引起堿基對由G∶C到T∶A轉化,因為8-oxoG具有與腺嘌呤配對的趨勢[1].8-oxoG被普遍認為是引起變異發生、致癌作用和老化的高度危險因素之一,因此,8-oxoG在過去的數十年里受到了廣泛的關注[2-3].在8-氧-7,8-二氫-2′-去氧鳥嘌呤核苷(8-oxodG)中,N—糖苷鍵連接著8-oxoG堿基和去氧核糖糖環.N—糖苷鍵的斷裂和水解是其堿基剪切修復(BER)中最重要的過程,也由此維持儲存在基因中的遺傳信息的完整性.人體8-羥基鳥嘌呤DNA糖苷酶(hOGG1)能選擇性地識別8-oxoG∶C堿基對,并破壞8-氧-2′-去氧鳥苷(8-oxodG)中8-oxoG堿基與去氧核糖環間的N—糖苷鍵從而將氧化形式的8-oxoG敲除[4-5].這樣的反應依賴于特殊糖苷鍵的活性,具有重要意義的是研究8-oxodG中N—糖苷鍵的內在性質和評估某些因素,比如氧化、質子化和陽離子化等對N—糖苷鍵穩定性的影響.近年來,有許多實驗對核苷中N—糖苷鍵性質進行了研究.比如,N—糖苷鍵的非酶催化水解反應,環境和化學物質(如:H+,金屬離子,烷基化的化合物)對N—糖苷鍵的影響.這些研究旨在了解N—糖苷鍵水解的內在化學性質.最近,針對這方面進行的理論計算有所增加.M.Hotokka等[6]用半經驗和從頭算法HF/3-21G方法計算了腺苷及其衍生物的電子分布、質子親和力和N—糖苷鍵的異裂,R.Rios-Font等[7]用量子化學的 B3LYP、MP2和CCSD(T)方法研究了氧化、質子化和用Cu+和Cu2+陽離子化對2′-去氧鳥苷中N—糖苷鍵強度的影響;他們的研究結果表明,鳥嘌呤上引入正電荷將抑制N—糖苷鍵的均裂過程,但是在很大程度上支持N—糖苷鍵的異裂過程.有關8-oxodG的陽離子化的理論研究仍不足.選取Na+是因為這個離子非常普通并且是在生物體內與生物學最相關的金屬陽離子,存在于富含AT序列的小空穴中[8].本文重點研究8-oxodG的陽離子化(H+和Na+)對N—糖苷鍵的構型和穩定性的影響.
2 計算方法
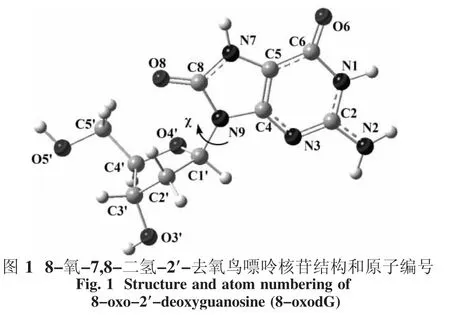
依照以前報道的類似2′-去氧鳥苷的結構[9],計算模型和原子編號見圖1.在這個模型中,堿基相對于糖環來說處于反式(90.0°≦χ≦270.0°,表示二面角O4′-C1′-N9-C4的值).事實上,在8-oxodG的堿基環上,有3個位點,即N3、O6和O8原子,可與質子和鈉離子結合,由此將在這3個位點引起競爭.本文中研究的化合物包括堿基環上所有可能的單質子化和陽離子化衍生物.氣態中,用密度泛函方法和6-311++G(d,p)基組對化合物進行結構優化[10].M05方法用于開殼層體系的計算,穩定點的性質通過在相同水平上的振動頻率分析來確認:每個穩定點的所有頻率都為正.在298.15 K和一個標準大氣壓下通過頻率分析也得到零點能(ZPVE).在相同水平下,應用自然鍵軌道(NBO)[11]計算了自然原子電荷,并用極化連續模型[12-13]計算了溶劑效應,用氣態優化結構考慮水作為溶劑.所有的計算用Gaussian09程序包計算[14].
鍵的斷裂通常遵循以下2種典型的過程,即均裂和異裂過程:
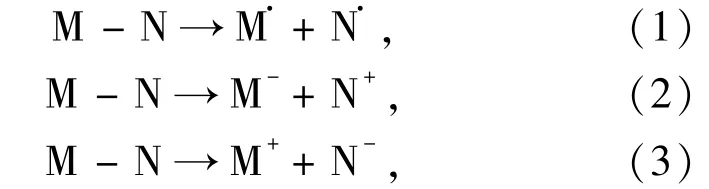
這里,(1)式表示均裂過程,而(2)和(3)式表示異裂過程.就8-oxodG及其衍生物而言,M和N分別代表8-oxoA或相應的衍生物和去氧糖環.然而,N—糖苷鍵以(3)式的方式異裂在能量上并不占優勢,因此在本文中沒有考慮(3)式的異裂.
3 結果與討論
本研究工作以8-氧-7,8-二氫-2′-去氧鳥嘌呤核苷為研究對象,考慮了質子化和陽離子對8-oxodG的構型和N—糖苷鍵穩定性的影響.研究結果表明,質子化和陽離子降低了N—糖苷鍵的穩定性,有利于N—糖苷鍵的斷裂,且支持異裂過程.所研究體系的優化結構及部分結構參數如圖2所示,而相關的部分重要結構參數列于表1和2列出了8-oxodG的質子化產物離解能.為敘述方便,文中采用了下述符號:a代表8-oxodG的質子化產物,而b則代表8-oxodG與陽離子的絡合物,而堿基上3個配位點N3、O6和O8原子分別用3、6和8表示.例如,b3表示Na+通過與N3原子相互作用得到的8-oxodG-Na+的絡合物.
3.1 各物質的幾何結構分析如圖2~3所示,8-oxodG與其衍生物在結構上表現出顯著的差別,以下的討論都是以8-oxodG這個物質為參照物進行的.在a3和b3中,Na+(或H+)同時與N3和O4′原子相互作用,Na—N3和Na—O4′鍵長分別約為0.225 2和0.226 9 nm;而H—N3和H—O4′鍵長分別約為0.102 6和0.191 7 nm.N3和O4′原子的孤對電子分別與Na+(或H+)的空軌道相互作用,分別導致 N3—N2、N3—C4、C1′—O4′和 C4′—O4′等鍵減弱,鍵長增長;結果,在b3中,C1′原子和N9原子的相互作用增加,使N9—C1′鍵強度增強,鍵長縮短(△d=-0.001 1 nm).同時O4′原子和鈉離子的相互作用也引起去氧核苷構型的改變和糖環構型的改變.分子內相互作用,N3—H(Na)…O4′,導致N—糖苷鍵的扭轉而使化合物由初始物的反式結構轉變為最終的順式結構,其χ值在a3和b3中分別為328.3°和 281.3°.
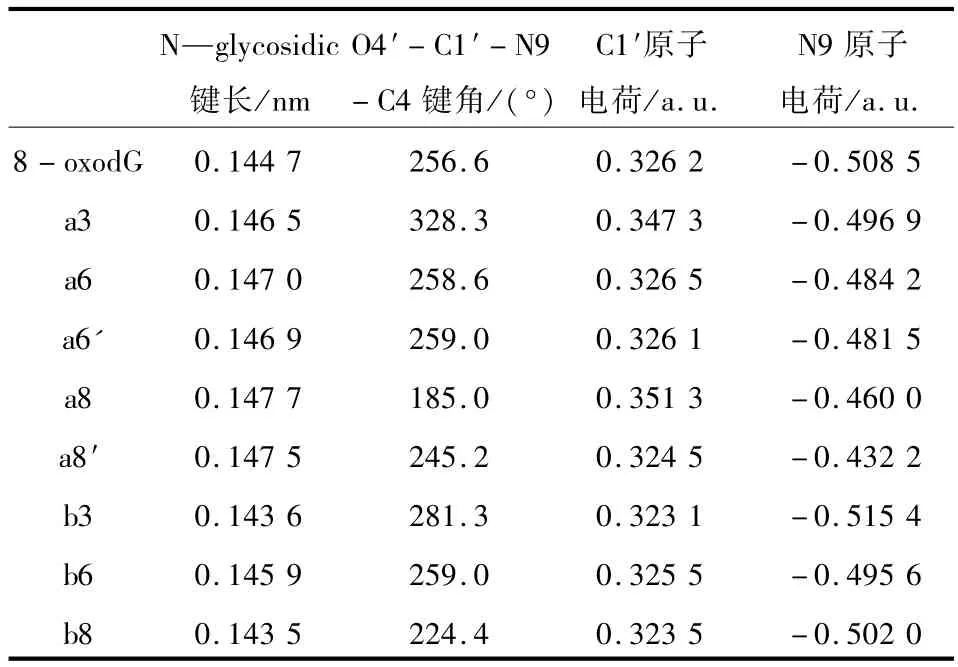
表1 N—糖苷鍵的分析結果Table 1 Structural parameters of N—glycosidic
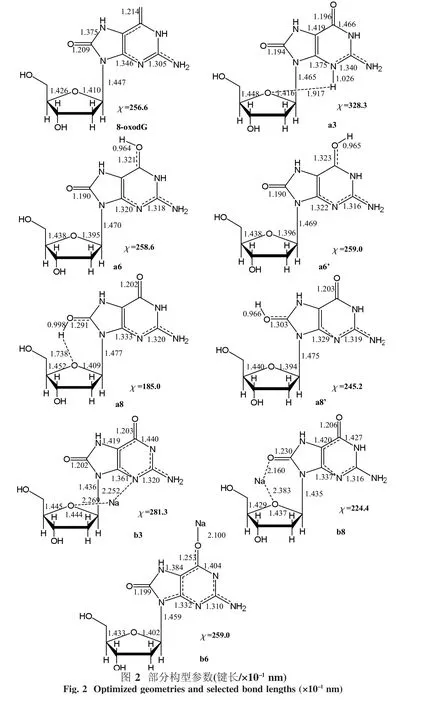
在a8和b8中,Na+(或H+)分別與O8′和O4′相互作用.當質子以順式或鈉離子與O8原子結合,存在分子內的相互作用,即 O8—H(Na)…O4′,同時O4′原子也會轉移出部分電子密度.因此,O4′原子和C1′原子間的相互作用減弱,這也導致C1′—O4′鍵鍵長增加(b8)或幾乎保持不變(a8).另一方面,分子內的相互作用也引起N—糖苷鍵的改變.例如,在a8中,N9—C1′鍵增長0.003 0 nm,而在b8中,N9—C1′鍵縮短了0.001 2 nm.這些變化與2個因素有關:體系引入正電荷和O4′原子與正離子間的相互作用.
如圖2和3所示,除了以上討論的差別外,核苷衍生物與核苷相比較仍有一些規律可循.由于引入正電荷,N9—C1′鍵鍵長(表2)增長,其變化范圍從0.001 2 nm(b6)到0.002 8 nm(a8′)(除 b8 和b3外).對糖環而言,首先,C4′—O4′鍵鍵長增長而C1′—O4′鍵鍵長縮短(除 b8 和 b3 外).其次,堿基相對于糖環來說是反式,相應的χ值在187.5°~258.5°之間.
8-oxodG衍生物相對于8-oxodG的變化主要歸結于以下幾個因素:一方面,在去氧糖環中,“異頭碳影響”和反平面孤對假設(ALPH)有利于電子流從糖環向離去基團偏移,從而促進N—糖苷鍵斷裂.結果,N—糖苷鍵鍵長增長而C1′—O4′鍵鍵長縮短.另一方面,當堿基與質子或陽離子結合時,堿基環處于缺電子狀態而成為電子受體.因此,那些與堿基環結合的富電子基團傾向于向堿基環提供電子以補償電子不足.事實上,除了上述主要原因外,仍有其它的因素影響所研究的體系,比如,分子間相互作用、靜電影響和極化影響等,并且上述變化是這些因素同時作用的結果.
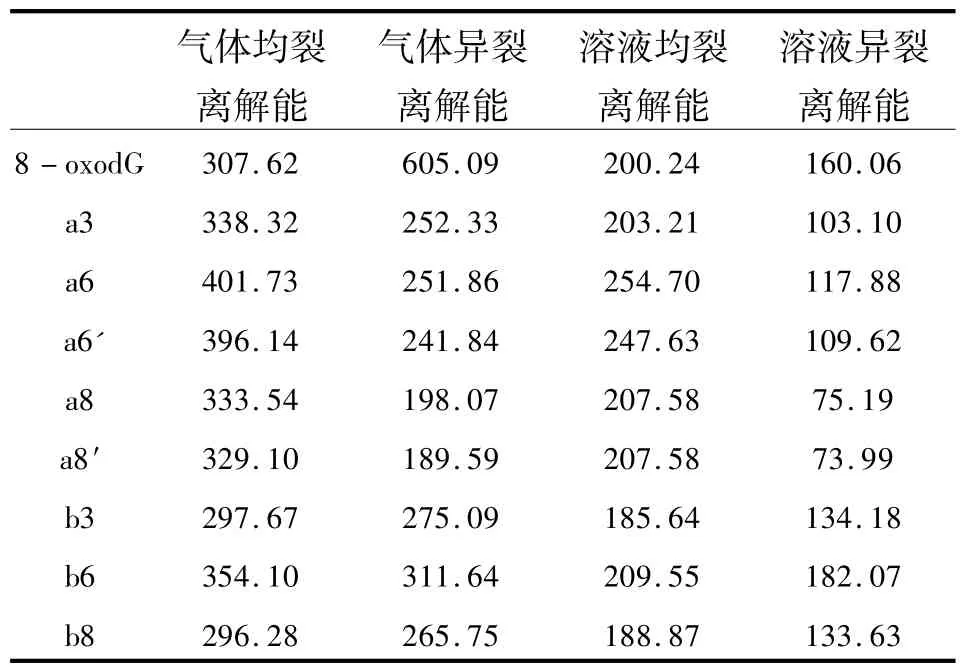
表2 均裂過程和異裂過程的離解能Table 2 Dissociation energies of homolytic and heterolytic processes kJ/mol
3.2 離解能分析N—糖苷鍵的強度能夠通過計算鍵的離解能評估.鍵離解能定義為各部分離解產物的能量和與反應物的差值.表2列出了所有研究體系的離解能.
氣態時,核苷的陽離子化可以改變N—糖苷鍵的離解能.對8-oxodG而言,N—糖苷鍵均裂過程的離解能比其異裂過程的離解能低大約298 kJ/mol,因而均裂過程在氣態中是首選離解方式.有趣的是,其衍生物體系的N—糖苷鍵異裂過程的離解能比8-oxodG的異裂過程的離解能減弱293~416 kJ/mol,而均裂過程的裂解能與中性物質相比則變化要小得多( |△E |≤94 kJ/mol),即對 8-oxodG的衍生物體系而言,異裂過程的離解能較低,是優勢離解方式.因此,堿基團引入正離子非常有利于N—糖苷鍵的異裂過程從而使異裂成為首選過程而均裂過程相對較難進行.這些結果表明堿基基團的陽離子化對促進核苷中N—糖苷鍵的斷裂起著重要的作用.
由于真實的裂解反應都是在溶劑中進行的,所以對于所有體系也考慮了溶劑化效應.溶劑化效應對離解能帶來顯著的變化.其中受溶劑效應影響最大的是8-oxodG.其異裂過程的離解能降低了大約440 kJ/mol,而其均裂的離解能僅僅下降了約107 kJ/mol.結果,考慮到溶劑效應,對8-oxodG而言首選裂解過程是異裂過程.而對其衍生物體系來說,雖然均裂和異裂過程的離解能也都有所下降,但是異裂過程的離解能仍然比對應的均裂過程的離解能低得多,所以前者仍然是首選的裂解過程.因此,異裂過程占據優勢地位,正電荷引入能促進N—糖苷鍵的斷裂.
4 結語
在本研究工作中,采用了DFT理論的M05方法選用6-311++G(d,p)機組對8-氧-7,8-二氫-2′-去氧鳥嘌呤核苷的構型和糖苷鍵的穩定性進行了研究,考慮了質子和陽離子對8-oxodG的N—糖苷鍵穩定性的影響.研究結果表明,質子化和陽離子降低了N—糖苷鍵的穩定性,有利于N—糖苷鍵的斷裂.與8-oxodG相比較而言,其衍生物在結構上表現出顯著的差別.N9—C1′鍵鍵長增長(除b3和b8外),其變化范圍從0.001 2 nm(b6)到0.002 8 nm(a8′);C4′—O4′鍵鍵長增長而C1′—O4′鍵鍵長縮短(除b8和b3外).研究表明,“異頭碳影響”和由于在堿基引入正電荷而引起的缺電子影響促進N—糖苷鍵以異裂過程進行裂解,正電荷引入對促進N—糖苷鍵的斷裂起著重要的作用.而且,異裂過程是糖苷鍵斷裂的首選方式,這與文獻[7]的結論吻合.
[1] Francoise D,Magnar B,Luisa L,et al.Comparative analysis of 8-oxoG∶C,8-oxoG∶A,A∶C and C∶C DNA repair in extracts from wild type or 8-oxoG DNA glycosylase deficient mammalian and bacterial cells[J].DNA Repair,2003,2(6):707-718.
[2] Elisabeth L,Kyungrim K,Frederic C,et al.Transcription activities at 8-oxoG lesions in DNA[J].DNA Repair,2004,3(11):1457-1468.
[3] Barone F,Lankas F,Spackova N,et al.Structural and dynamic effects of single 7-hydro-8-oxoguanine bases located in a frameshift target DNA sequence[J].Biophys Chem,2005,118(1):31-41.
[4]Fujimoto H,Pinak M,Nemoto T,et al.Molecular dynamics simulation of clustered DNA damage sites containing 8-oxoguanine and abasic site[J].J Comput Chem,2005,26(8):788-798.
[5] Berti P J,McCann J A B.Toward a detailed understanding of base excision repair enzymes:transition state and mechanistic analyses of N—glycoside hydrolysis and N—glycoside transfer[J].Chem Rev,2006,106(2):506-555.
[6] Hotokka M,L? nnberg H.Hydrolysis of adenosine:a semiempirical and ab initio study[J].J Mol Struct:Theo Chem,1996,363(2):191-201.
[7] Rios-Font R,Rodrí guez-Santiago L,Bertran J,et al.Influence of N7 protonation on the mechanism of the N—glycosidic bond hydrolysis in 2′-deoxyguanosine:a theoretical study[J].J Phys Chem,2007,B111(21):6071-6077.
[8] Hamelberg D,Williams L D,Wilson W D.Influence of the dynamic positions of cations on the structure of the DNA minor groove:sequence-dependent effects[J].J Am Chem Soc,2001,123(23):7745-7755.
[9] Hocquet A,Leulliot N,Ghomi M.Ground-state properties of nucleic acid constituents studied by density functional calculations 3:role of sugar puckering and base orientation on the energetics and geometry of 2′-deoxyribonucleosides and ribonucleosides[J].J Phys Chem,2000,B104(18):4560-4568.
[10]Petersson G A,Al-Laham M A.A complete basis set model chemistry (II):open-shel1 systems and the total energies of the first-row atoms[J].J Chem Phys,1991,94(9):6081-6090.
[11] Reed A E,Curtiss L A,Weinhold F.Intermolecular interactions from a natural bond orbital,donor-acceptor viewpoint[J].Chem Rev,1988,88(6):899-926.
[12]Barone V,Cossi M.Quantum calculation of molecular energies and energy gradients in solution by a conductor solvent model [J].J Phys Chem,1998,A102(11):1995-2001.
[13]Cossi M,Rega N,Scalmani G,et al.Energies,structures,and electronic properties of molecules in solution with the C-PCM solvation model[J].J Comput Chem,2003,24(6):669-681.
[14] Frisch M J,Trucks G W,Schlegel H B,et al.Gaussian 09 A.01[S].Pittsburgh:Gaussian Inc,2009.

