左側乳腺癌保乳術后調強放療的劑量學研究
艾秀清 木妮熱·木沙江 司馬義力·買買提尼亞孜 朱相露
三維適形照射(three dimensional conformal radiotherapy)是精確放療方法之一,臨床研究發現3D-CRT治療食管癌、肺癌等存在劑量分布不均勻,并發癥發生率較高等不足[1-2]。調強放療(intensitymodulation radiated therapy,IMRT)是放療技術的高級階段,現觀察左側乳腺癌保乳術后調強放療(IMRT)靶區以及心臟、同側肺的照射劑量分布,分析其治療優勢。
1 資料與方法
1.1 一般資料
選取2012年11月-2013年11月我院收治的保乳術后接受調強放療的37例女性左側乳腺癌患者,年齡33~61歲 ,平均(43.7±8.9)歲。腫瘤部位:9例內上象限,2例內下象限,22例外上象限,4例外下象限。按2002年AJCC 分期標準,其中Ⅰ期31例,Ⅱ期6例;浸潤性導管癌34例,原位癌1例,髓樣癌2例。
1.2 擺位固定和 CT 掃描
將患者在平板體架上擺好體位,然后將熱塑體膜放入70 ℃熱水中,約2 min待透明軟化后快速罩在患者對應體部,同時固定于底座。用雙手按摩面網直到與皮膚充分接觸完好,待涼后取下,大孔徑CT下掃描并傳至Varian計劃系統,臨床醫師進行靶區勾畫。
1.3 放射治療方法
照射范圍:腋窩淋巴結未發生轉移患者,僅需行患側乳腺組織、胸壁照射;腋窩淋巴結轉移患者,需行患側乳腺胸壁、鎖骨區照射。乳腺胸壁照射野邊界:前界為皮膚表面的下方5 mm,下界為肋骨前緣,內界為胸骨旁,外界為腋中線。鎖骨區野邊界:上界為環甲切跡水平,下界為鎖骨頭下緣,內界為氣管旁,外界為肱骨頭內側緣。照射劑量:患者調強放射治療照射的總劑量為50 Gy/5周。每周行常規分割劑量5次照射。放療方案為四-五野調強計劃。若患者乳腺瘤床有銀夾標記,就給予患者乳腺瘤床推量調強放療劑量2.15 Gy/次,乳腺胸壁+鎖骨區劑量1.8 Gy/次,共行28次放療,即乳腺瘤床劑量60 Gy、乳腺胸壁+鎖骨區放療劑量50 Gy。若患者瘤床無銀夾標記即給予患者乳腺胸壁+鎖骨區劑量50 cy,2 Gy/次,25次放療結束后,瘤床電子線補量2 Gy/次,共5次,劑量達到60 Gy。
1.4 治療計劃設計
計劃靶區(planning tumor volume,PTV )勾畫。
靶區勾畫完后行危及器官雙肺,心臟及對側乳腺輪廓的勾畫,并對三維立體體積進行修改調整,注意保持層面之間的連續性、平滑度。保持前方在皮下0.5 cm,后方不進入肺組織,適當調整平滑度。
1.5 評價方法
應用PTV劑量體積、劑量分布圖,評估靶區組織、正常組織的劑量分布均勻性指數(homogeneity indices,HI),HI越接近1,提示劑量均勻性越好。HI=D5/D95,D5為5%PTV的最低劑量,D95為95%PTV的最低劑量。
1.6 統計學處理
2 結果
2.1 計劃靶區的劑量學分析
IMRT計劃的D95劑量高于3D- CRT的,IMRT的V105%、V110%、HI明顯低于3D- CRT,具有統計學差異(P<0.05),提示IMRT靶區劑量更接近于處方劑量,靶區劑量分布較3D- CRT更均勻,具有更好的適形性和劑量均勻性,見表1。
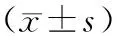
表1 3D- CRT和IMRT計劃PTV劑量學比較
注:*為與3D- CRT比較,P<0.05。
2.2 兩種放療計劃周圍重要器官劑量學比較
IMRT計劃的肺V20、V30、V40及心臟V5、V30、V40均顯著低于3D-CRT,有統計學差異(P<0.05),提示IMRT計劃能顯著減少周圍重要器官的照射劑量與體積,能更好地保護肺、心臟等周圍組織,見表2。
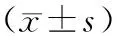
表2 兩種放療計劃肺、心臟劑量體積比較
注:*為與3D-CRT比較,P<0.05。
2.3 不同CTV患者IMRT治療劑量學比較
根據左側乳腺體積將患者分為兩組,≥500 cm315例為一組,<500 cm322例為另一組,經比較發現, 兩組患者D95、V105、V110、HI比較無顯著差異(P>0.05),提示IMRT放射治療受PTV影響較小,靶區內劑量均勻性較好。見表3。
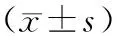
表3 不同PTV患者IMRT治療的劑量學比較
注:#為與≥500 cm3比較,P<0.05。
3 討論
調強放射治療(intensity modulated radiation therapy,IMRT)在提高早期乳腺癌局部控制率,改善患者預后中具有重要的作用。放療的劑量學分布是臨床評價治療效果的重要指標,放療計劃首先必須符合劑量學的要求,合理的劑量分布是影響患者治療效果和毒副反應重要因素。早期乳腺癌保乳術后采用3D-CRT放療,受乳腺外形不規則、不同部位寬度變化較大,放療時各部位與皮膚距離不同,是影響靶區劑量均勻性的主要原因[3]。
既往研究發現3D-CRT放療計劃中,乳腺上、下邊緣部位照射劑量與中心軸參考劑量差異較大,IMRT可使靶區內劑量更加均勻,在食管癌、前列腺癌等放療研究中發現IMRT可減少靶區周圍重要器官的照射劑量[4]。應用三維劑量學分析3D-CRT乳腺胸壁野,乳腺上、下及兩側和乳頭局部均存在高劑量區,最高為處方劑量的115%~120%。本次研究結果提示IMRT計劃與3D-CRT比較,IMRT的D95劑量高于3D-CRT,而IMRT的V105%、V110%、HI明顯低于3D-CRT,提示IMRT靶區劑量更接近于處方劑量,靶區劑量分布比3D-CRT更均勻,具有更好的適形性和均勻性。李勝業等[5]研究IMRT照射計劃的劑量學參數,指出IMRT可使乳腺內劑量更均勻,本次結果與之相符。IMRT可消除3D-CRT計劃中乳房上、下部位的高劑量區,IMRT可在保證靶區覆蓋率的前提下改善靶區的劑量均勻性。我們進一步對比不同PTV體積的IMRT劑量學指標,乳腺超過500 cm3與低于500 cm3患者的D95、V105、V110無顯著差異。我們認為IMRT更能體現改善靶區劑量均勻性的優勢,乳房體積不會顯著影響劑量的均勻性。
早期乳腺癌保乳手術后的長期存活率較高,放射性肺炎、放療誘發的心臟疾病( radiation induced heart disease,RIHD)等放療相關并發癥是影響患者生活質量的重要因素, RIHD是指胸部腫瘤患者接受放療后引起的心臟放射性損傷的癥狀,Filopei 等[6]報道 RIHD與大劑量分割、受照劑量、體積、是否同期化療等有關,其中放射劑量、體積的影響尤為明顯。有關文獻報道[7]研究發現放射性肺炎與放療過程中的照射體積有關,體積越大,發生放射性肺炎的風險越高;V10增加 10%引起放射性肺炎的風險也增加10%。另外,皮膚區域的高劑量照射也會影響術后的美觀,理論上減少高劑量區可降低局部皮膚損傷和正常乳腺腺體的纖維化程度,從而避免保乳術后的乳房外觀受影響[8]。本次研究發現IMRT中的肺V20、V30、V40以及心臟V5、V30、V40均顯著低于3D-CRT組,提示標準IMRT計劃可限定危及器官的受量和體積,保護心臟、肺等重要器官。
綜上所述,IMRT靶區劑量更接近于處方劑量,靶區劑量分布比3D-CRT更均勻,具有更好的適形性,能更好地保護肺臟、心臟等周圍組織,而且IMRT放射治療受CTV影響較小,靶區內劑量均勻性較好。已有部分臨床研究發現IMRT可降低放療相關后遺癥的發生率,但由于本次研究因隨訪時間較短,同時非劑量學因素也可影響這些后遺癥的發生率,例如化療、高血壓、糖尿病等,因此IMRT是否降低RIHD、放射性肺炎的發生率尚需進一步隨訪研究。
[1] Anhui S,GuanGying Z,Hao W,et al.Analysis of clinical and dosimetric factors associated with severe acute radiation pneumonitis in patients with locally advanced non-small cell lung cancer treated with concurrent chemotherapy and intensity - modulated radiotherapy 〔J〕.Radiat Oncol,2010,5:35.
[2] 張富利,王 平,鄭明民.乳腺癌保乳術后常規、三維適形和直接子野優化調強放療技術劑量學評估〔J〕.中國醫學物理學雜志,2011,28(2):2491-2494,2540.
[3] 洪 衛,冉 立,盧 冰,等.乳腺癌改良根治術后放療降低患側肺受量的劑量學研究〔J〕.中華放射醫學與防護雜志,2011,31(6):684-687.
[4] 劉桂紅,徐鈺梅,唐天友,等.左側乳腺癌保乳術后各種放療技術劑量學評價〔J〕.徐州醫學院學報,2011,31(10):666-669.
[5] 李勝業,戴安偉,費明來,等.左側乳腺癌保乳術后調強放療與三維適形放療的劑量學比較〔J〕.實用癌癥雜志,2012,27(5):524-526.
[6] Filopei J,Frishman W. Radiation - Induced Heart Disease〔J〕.CardioloGy in Review,2012,20:184-188.
[7] 賀春鈺,張建慶,木妮熱·木沙江,等.乳腺癌術后逆向調強放療致放射性肺損傷的劑量學研究〔J〕.中國全科醫學,2012,15(3C):969-971.
[8] 丁 喆, 夏新舍, 葉紅強,等.左側乳腺癌保乳術后三維適形放療與常規放療的劑量學比較〔J〕.寧夏醫科大學學報,2012,34(12):1297-1299.

