腦梗死患者外周血血清和血漿中白細胞基質金屬蛋白酶9及基質金屬蛋白酶組織抑制因子1水平差異分析
湯加 周春剛 蘇偉 張志斌
細胞外基質合成與降解的平衡失調是血管重構和動脈粥樣硬化性腦梗死的主要病理過程,基質金屬蛋白酶(MMPs)屬于基質蛋白酶家族,能夠降解所有細胞外基質成分,同時也是變性和炎癥過程的主要調節分子,在血管壁重構以及心腦血管病發病機制中扮演重要角色,目前MMPs已經作為動脈粥樣硬化和心腦血管病的預測因子[1]。本研究旨在探討血清及血漿中白細胞基質金屬蛋白酶9(MMP9)和基質金屬蛋白酶組織抑制因子1(TIMP-1)的水平差異,為腦組織損傷生物標志物的選擇提供依據。
1 對象和方法
1.1 一般資料 收集臨床資料:腦梗死患者116例為腦梗死組,男61例,女55例。年齡51~77歲,平均(68.0±6.6)歲。健康體檢者43例為健康組,男 23例,女20例。 年齡48~59歲,平均(53.0±5.7)歲。 所有病例經頭顱CT或MRI證實,臨床表現符合《中國腦血管病防治指南》的診斷標準,發病<1周的患者。腦梗死納入標準:符合動脈粥樣硬化性血栓性腦梗死、腔隙性梗死的診斷,并具有神經功能缺損的臨床表現者。排除標準:短暫性腦缺血發作(TIA);腦出血;發病>1周;經檢查證實由腦腫瘤、腦外傷、血液病等引起的卒中患者,因風濕性心臟病、冠心病及其他心臟病合并房顫引起腦栓塞者;合并有肝、腎、造血系統、內分泌系統等嚴重疾病及骨關節病、精神病者。
1.2 方法 血清、血漿采集:分別采用無促凝劑的采血管、含EDTAK2抗凝管(購自上海科華)清晨空腹采血,3000 r/min離心20 min,取上清置于-80℃保存,避免反復凍融。
MMP9和TIMP-1的水平檢測:采用ELISA法,樣本和標準品均設復孔,以標準品的濃度為縱坐標,OD值為橫坐標,采用ELISA-0.2軟件計算標準曲線的四參數Logistic曲線擬合方程,再乘以稀釋倍數,即為樣品的實際濃度。ELISA試劑購自蘇州科創生物技術公司,Biotek酶標儀(美國 ELX800)。
1.3 統計學處理 數據分析采用統計軟件SPSS 11.5,血清和血漿組間MMP9及TIMP-1含量差異采用配對t檢驗。腦梗死組與健康組血漿 MMP9和TIMP-1差異比較采用成組t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 腦梗死組血清和血漿MMP9和TIMP-1水平比較 116例腦梗死患者血清和血漿中MMP9水平及TIMP-1水平均呈線性相關,血清MMP9水平顯著高于血漿MMP9水平,差異具有統計學意義(P<0.01)。血清TIMP-1水平亦顯著高于血漿TIMP-1水平,差異具有統計學意義(P<0.01)。見表1。
表1 腦梗死組血清和血漿MMP9、TIMP-1比較(±s,μg/L,n=116)

表1 腦梗死組血清和血漿MMP9、TIMP-1比較(±s,μg/L,n=116)
注:與血清比較,??P<0.01
指標 血清 血漿 相關系數(r)
2.2 腦梗死組與健康組血漿MMP9和TIMP-1水平比較 本研究腦梗死組MMP9血漿水平顯著高于健康組,差異具有統計學意義(P<0.01)。而腦梗死組TIMP-1血漿水平顯著低于健康組,差異具有統計學意義(P<0.01),見表 2。
3 討論
正常和病態血管壁細胞能夠在可溶性細胞因子以及細胞和細胞血小板白細胞之間相互作用活化和上調MMPs水平,MMPs活性增強有益于基質的轉化,血管的修復和動脈粥樣硬化斑塊的穩定,但是也能導致血管內膜增厚動脈粥樣硬化和血栓形成[2]。MMP9和TIMP-1水平的不同不僅與疾病狀態相關,同時也與血凝和纖維溶解途徑相關。凝血過程中凝血酶能夠促進MMP9前體和MMP9的活化,凝血酶產生纖維蛋白,連接MMP9單體的纖維蛋白連接域,繼而活化的MMP9單體在血清聚集,在纖維蛋白溶解過程,尿激酶纖溶酶原激活劑促進白細胞產生MMP9[3],外周血中MMPs和TIMP-1水平在血清與血漿水平存在差異,血清MMP9和TIMP-1的水平高于含有抗凝劑的血漿,本研究結果與相關報道相一致[4],由于血小板和白細胞在聚集或活化時能夠釋放MMP9和TIMP-1,而使用抗凝劑能夠抑制血小板和白細胞釋放MMP9和TIMP-1[5]。因此對于研究MMP9和TIMP-1作為生物學標志和其在病理生理過程中的角色,采血方法和樣本前處理非常重要。忽視采血方法對結果的影響,可能影響對正常結果的判斷分析。
表2 2組血漿MMP9、TIMP-1水平比較(±s,μg/L)
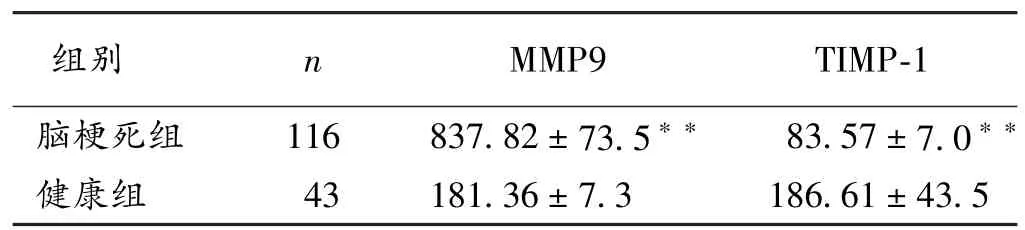
表2 2組血漿MMP9、TIMP-1水平比較(±s,μg/L)
注:與健康組比較,??P<0.01
組別 n MMP9 TIMP-1腦梗死組 116 837.82±73.5?? 83.57±7.0??健康組 43 181.36±7.3 186.61±43.5
腦梗死在缺血組織內以及其周圍出現高水平MMP9,可能引起出血原因是毛細血管基底膜大量Ⅳ膠原降解,紅細胞和白細胞外滲。MMPs由腦細胞和循環至腦組織的外周血白細胞產生,局部缺血后滲透的白細胞是MMP9的主要來源[6]。白細胞MMP9敲除嵌合子小鼠與MMP9敲除鼠具有相同表現。腦組織和血中MMP9促進神經元死亡、炎癥、滲透、神經血管損傷。MMP9參與神經和血管病理生理過程。血漿水平MMPs已經作為腦組織損傷的潛在生物學標志[7-8]。與健康人比較,缺血性腦卒中患者外周血MMP9水平增高,且與缺血面積及神經癥狀有關[9],TIMP-1作為MMP9活性的主要抑制物,與MMP9特異性結合,TIMP-1和MMP9之間平衡調節是血管重構的關鍵,TIMP-1和MMP9之間平衡失調可能導致腦卒中后梗死擴大,損傷血腦屏障[8]。
總之,血漿水平MMP9和TIMP-1更適合作為腦組織損傷的潛在生物學標志,使用血清標本檢測MMP9和TIMP-1可能產生分析前的偏倚。
[1]Sundstr?m J, Vasan RS.Circulating biomarkers of extracellular matrix remodeling and risk of atherosclerotic events[J].Curr Opin Lipidol, 2006,17(1):45-53.
[2]Androulakis E, Tousoulis D, Papageorgiou N, et al.The role of matrix metalloproteinases in essential hypertension[J].Curr Top Med Chem, 2012,12(10): 1149-1158.
[3]Mannello F.Effects of blood collection methods on gelatin zymography of matrix metalloproteinases [J].Clin Chem,2003,49(2):339-340.
[4]John M,Jung K.Pre-analytical conditions for the assessment of circulating MMP-9 and TIMP-1:consideration of pitfalls[J].Eur Respir J,2005,26(2):364-366.
[5]Jung K, Gerlach RF, Tanus-Santos JE.Preanalytical pitfalls of blood sampling to measure true circulating matrix metalloproteinase 9 and tissue inhibitors of matrix metalloproteinases[J].Clin Chim Acta, 2006, 373 (1/2):180-181.
[6]Gidday JM,Gasche YG,Copin JC,et al.Leukocyte-derived matrix metalloproteinase-9 mediates blood—brain barrier breakdown and isproinflammatory aftertransientfocal cerebral ischemia [ J].Am J Physiol Heart Circ Physiol,2005, 289(2):H558-H568.
[7]梁恒,韓江全,李繼中,等.MMP9、hs-CRP、BNP、S-100 和DD在急性缺血性腦卒中患者中的臨床診斷意義[J].中國實用醫藥, 2012, 7(24):4-6.
[8]謝明劍,薛偉新,邱楚雄,等.腦梗死病人梗死面積與MMP1、MMP9、TIMP-1 的關系探討[J].中西醫結合心腦血管病雜志, 2011, 9(2):173-174.
[9]劉長海.血清MMP-9、Hs-CRP檢測在缺血性腦卒中患者中的意義[J].中國實用神經疾病雜志,2013,16(2):35-37.

