一氧化氮對鉛脅迫下雜花苜蓿種子萌發及幼苗生理特性的影響
向 華,南麗麗,李春曉,王克婧,杜 璽
(甘肅農業大學 草業學院/草業生態系統教育部重點實驗室/甘肅省草業工程實驗室/中-美草地畜牧業可持續發展研究中心,甘肅 蘭州 730070)
鉛是重金屬“五毒”之一,它不僅阻礙植物生長發育,降低作物產量和質量,還可通過食物鏈的富集,被吸收到人體并嚴重危害人體健康[1]。NO是生物體中氧化還原信號分子和毒性分子,也是一種活性氮(RNS)。在植物體內通過一氧化氮合酶(NOS)和硝酸還原酶(NR)催化形成[2]。研究表明,鉛對植物種子萌發及幼苗生長的影響通過其改變植物生理生化過程實現。魏學玲等[3]利用室內水培試驗研究發現,外源NO促進Pb2+脅迫下小麥種子萌發及幼苗生長,增強小麥對Pb2+脅迫的適應性,并能有效地緩解Pb2+脅迫下葉綠素a、葉綠素b和葉綠素總量的降低。張遠兵等[4]發現,外源NO對Pb2+1 000 mg/L脅迫下高羊茅生長影響具有劑量效應,適宜濃度能緩解鉛毒害,提高耐鉛性。孫立榮等[5]研究發現,50~100 μmol/L的外源NO供體硝普鈉(SNP)可以促進鹽脅迫下黑麥草幼苗的生長,且100 μmol/L SNP促進效果最明顯。雍山玉等[6]發現NO對植物體的作用具有雙重性,低濃度(100和300 μmol/L)SNP浸種處理能顯著緩解NaCl脅迫,抑制辣椒種子的萌發。
苜蓿為優質豆科牧草,具有產量高、持久性好、飼用價值高、用途廣等眾多優點,在世界各地的畜牧業中發揮著重要的作用。苜蓿除了用于飼養牲畜之外,還可以作為護坡植物,園林上多用作鹽堿地、貧瘠土地的綠化草種和景觀野花用草種,同時也是很有利用價值的土壤鉛污染修復植物。為此,研究外源NO供體SNP結合Pb2+處理對雜花苜蓿種子萌發及幼苗生理生化特性的影響,以期通過調節NO水平來改善植物生理狀況,為深入研究農作物Pb2+毒害的緩解技術提供理論參考。
1 材料和方法
1.1 試驗設計
1.1.1 供試苜蓿品種為雜花苜蓿阿爾岡金,種子由甘肅農業大學草業學院提供。發芽試驗于2012年5~6月在培養室進行。雜花苜蓿種子用蒸餾水反復沖洗然后吸干,于25 ℃下,設置6個處理,分別為CK完全Hoagland營養液;T1 Hoagland營養液+100 μmol/L SNP;T2 Hoagland營養液+250 mg/L氯化鉛;T3 Hoagland營養液+500 mg/L氯化鉛;T4 Hoagland營養液+100 μmol/L SNP+250 mg/L氯化鉛;T5 Hoagland營養液+100 μmol/L SNP+500 mg/L 氯化鉛,先浸種24 h,再于28 ℃催芽24 h后,選發芽一致的種子,播于放有濕潤濾紙10 cm的培養皿中,每蒸發皿100粒,置25 ℃,光照強度3 000 lx,每天光照12 h的培養室中培養,定時取樣分析測定,每組重復7次。
1.1.2 幼苗培養 試驗選用清洗干凈的細沙,用去離子水反復沖洗后烘干備用。選發芽一致的種子,播于裝有280 g干燥細沙的塑料杯內。待幼苗長出真葉時,選長勢良好且一致的幼苗轉移到含Hoagland營養液的培養缽中繼續培養至三葉期時,設置6個處理,完全隨機設計,重復4次。各處理繼續培養20 d后,沖洗干凈葉片,用濾紙吸干多余水分,封入密封袋并迅速放入液氮中速凍,貯存于-80 ℃超低溫冰箱,用于各生理指標的測定。
1.2 測定指標及方法
1.2.1 發芽勢、發芽率、胚芽、胚根的測定 發芽期間每隔24 h記錄1次,第4 d統計發芽勢、第10 d統計發芽率,胚根長和胚芽長采用精度0.1 mm游標卡尺測量,每處理隨機抽取20株幼苗,分別測定,求平均數。
1.2.2 生理指標的測定 植株根系活力采用氯化三苯基四氮唑(TTC)法測定,可溶性糖含量采用蒽酮比色法測定,游離脯氨酸含量采用酸性茚三酮法測定,丙二醛含量采用硫代巴比妥酸法測定,可溶性蛋白質含量采用考馬斯亮藍G-250染色法測定,超氧化物歧化酶(SOD)活性采用氮藍四唑光化還原法測定,過氧化氫酶活性采用高錳酸鉀滴定法測定[7]。
1.3 數據處理
用Excel 2003處理數據和繪圖,SPSS 16.0統計軟件進行方差分析。
2 結果與分析
2.1 SNP對Pb脅迫下雜花苜蓿種子萌發的影響
種子萌發是作物對外界有所反應的開始,也是作物對外界反應的敏感期。T1處理100 μmol/L SNP、T2處理250 mg/L氯化鉛(低Pb2+濃度)、T4處理100 μmol/L SNP+250 mg/L 氯化鉛(SNP與低Pb2+濃度組合)均提高了苜蓿種子的發芽勢、發芽率和胚根胚芽長(表1),與對照相比,發芽勢、發芽率、胚根長、胚芽長依次提高6.49%,10.17%和22.03%,3.11%,10.17%和2.28%,4.93%,2.35%和22.77%,4.84%,17.44%和20.90%;T3處理500 mg/L氯化鉛(高Pb2+濃度)明顯降低了苜蓿種子的發芽勢、發芽率、胚根長(P<0.05),與CK相比,分別降低了9.04%,6.57%和11.74%;T5處理100 μmol/L SNP+500 mg/L氯化鉛(SNP與高 Pb2+濃度組合)處理明顯緩解了高鉛脅迫對種子發芽勢、胚根長的抑制作用,分別較T3處理增加了9.32%和11.17%(P<0.05)。

表1 SNP對Pb脅迫下雜花苜蓿種子萌發的影響Table 1 Effects of nitric oxide on seed germination under Pb stress
注:同列不同小寫字母表示差異顯著(P<0.05),下同
2.2 SNP對Pb脅迫下雜花苜蓿脯氨酸和可溶性蛋白含量的影響
各處理脯氨酸含量均顯著高于對照(P<0.05)(圖1),分別較對照增加了49.19%、55.37%、128.62%、207.66%和57.28%。T4和T3處理可溶性蛋白質含量顯著高于對照(P<0.05),分別較對照增加3.84%和2.14%,其他處理與對照差異均不顯著。
2.3 SNP對Pb脅迫下雜花苜蓿可溶性糖和根系活力的影響
由圖2可知,T1,T4和T5處理的可溶性糖含量增幅顯著(P<0.05);T2和T3處理可溶性糖含量降幅顯著(P<0.05),分別下降了26.81%和21.06%。T1和T2處理的根系活力均顯著高于對照(P<0.05),分別較對照增加13.28%和21.30%,其他處理均顯著低于對照(P<0.05)。
2.4 SNP對Pb脅迫下苜蓿MDA含量的影響
由圖3可知,T3,T4和T5處理的MDA含量均顯著大于對照(P<0.05),分別是對照的2.26,1.55和2.13倍;T2顯著小于對照(P<0.05),比對照小23.33%;T1處理與對照差異不明顯。
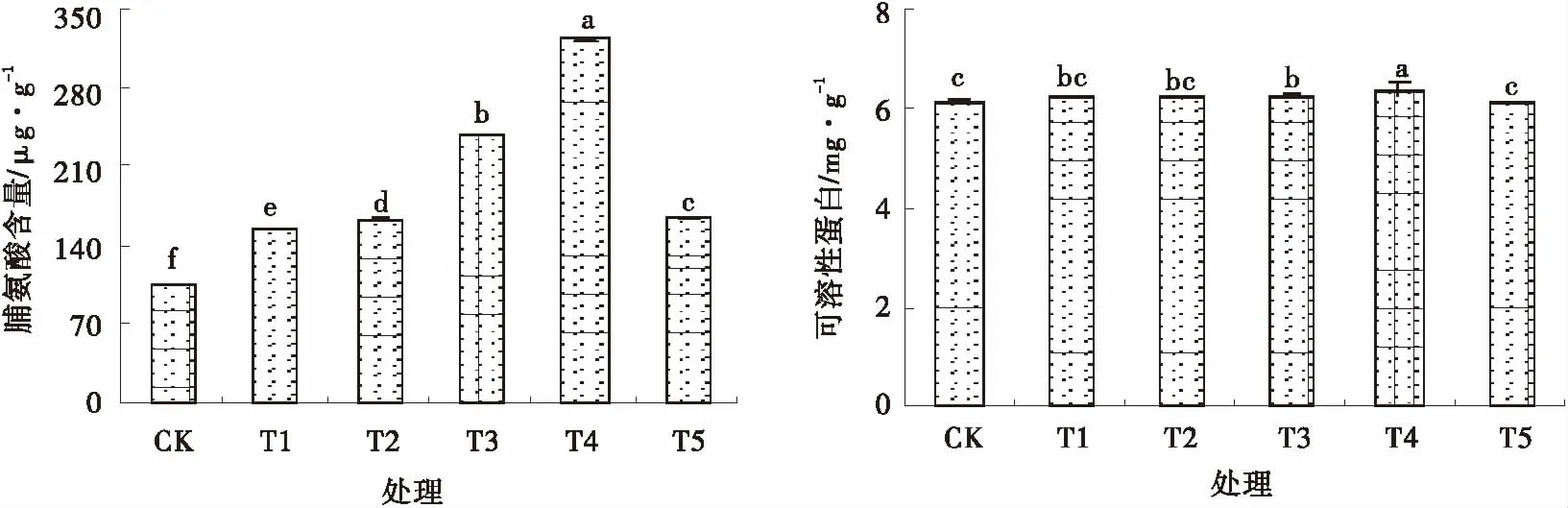
圖1 SNP對Pb脅迫下雜花苜蓿脯氨酸和可溶性蛋白含量的影響Fig.1 Effects of NO on proline and protein contents under Pb stress
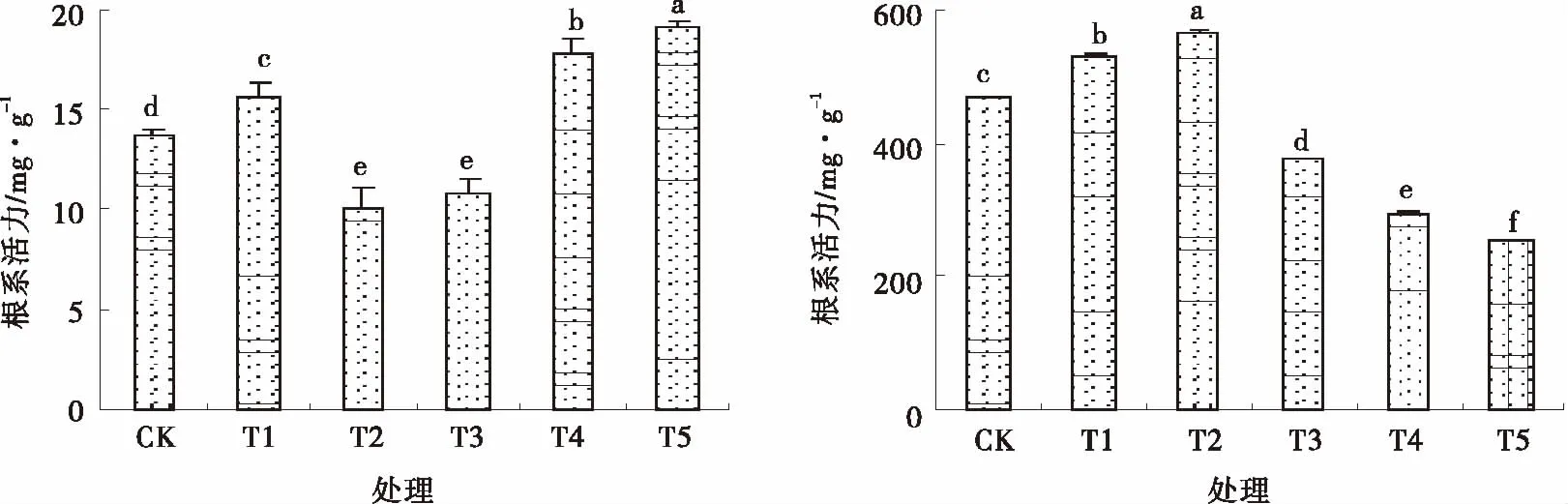
圖2 SNP對Pb脅迫下苜蓿可溶性糖和根系活力的影響Fig.2 Effects of NO on water soluble sugar content and root activity under Pb stress
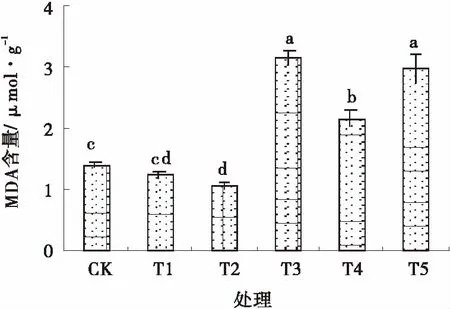
圖3 SNP對Pb脅迫下雜花苜蓿MDA含量的影響Fig.3 Effects of NO on MDA content under Pb stress
3 討論與結論
Pb2+是一種對植物生長發育有毒害的重金屬元素。種子能否正常萌發是某物種在某一地區形成自然群落的關鍵因素[8]。研究種子萌發對逆境脅迫的反應,是系統認識逆境傷害機理的較好途徑。NO作為一種信號分子能促進種子萌發、提高種子的發芽率、促進胚芽和胚根生長[9]。在試驗中,T1(SNP)、T2(低Pb2+濃度)和T4(SNP與低Pb2+濃度組合)處理下,苜蓿種子的發芽勢、發芽率、胚芽胚根長均高于相應對照,說明NO、低鉛濃度、NO與低鉛濃度組合脅迫均對苜蓿種子的萌發有促進作用。
研究表明,Pb2+進入植物體內后絕大部分累積在根部[10],其原因是Pb2+在根系主要以Pb(PO4)2和PbCO3等沉淀形式存在,在植物汁液中也有離子態和絡合態Pb,由于吸持、鈍化或沉淀作用,植物根系所吸收的Pb向地上部運輸較困難,根系活力是反映其生長狀況的重要指標。脯氨酸作為重要的滲透調節物與植物體內活性氧自由基的清除以及膜脂過氧化作用的減弱有密切的關系[11]。植物在逆境條件下通過積累可溶性糖等有機物來調節細胞滲透壓,以增加適應環境的能力[12]。可溶性蛋白含量升高有助于提高植物對逆境的抵抗力[13,14]。MDA是膜脂過氧化的產物,其含量的變化可作為檢測逆境條件下膜系統受傷害程度的指標[15,16]。試驗表明,與對照比較,T2處理下的雜花苜蓿幼苗,其MDA含量顯著下降,表明雜花苜蓿幼苗對鉛具有一定的耐性,低濃度促進其生長,這與王艷等[17]在剪股穎、白彥真等[18]在紫花苜蓿上的研究結果一致;用T1處理雜花苜蓿幼苗,其MDA含量與對照差異不顯著,但小于對照,表明外源NO供體SNP可促進雜花苜蓿幼苗的生長,這與前人在水稻[19]、向日葵[20]、白羽扇豆幼苗[21]、辣椒[6]和黑麥草[22]的研究結果相似,說明NO是一種植物生長調節劑,能夠像生長素一樣調控植物生長;用T3(高Pb2+濃度)和T5(SNP與高Pb2+濃度組合)處理雜花苜縮幼苗,其MDA含量顯著增加,表明高濃度鉛脅迫下苜蓿幼苗膜脂過氧化水平提高,膜系統的穩定性下降;用T4處理雜花苜蓿幼苗,MDA含量雖高于對照,但顯著小于T3和T5處理,表明植株體內的可溶性糖、可溶性蛋白質、脯氨酸等滲透調節物質已經啟動,提高了植株清除自由基防御系統的防御能力,緩解了高鉛脅迫對苜蓿幼苗的氧化損傷作用,使細胞膜受活性氧的傷害減輕。
綜上所述,低Pb2+濃度(250 mg/L )、SNP(100 μmol/L)、SNP與低Pb2+濃度(100 μmol/L SNP+250 mg/L)組合處理均增加了雜花苜蓿種子發芽勢、發芽率、胚芽胚根長,提高了幼苗脯氨酸、可溶性糖及可溶性蛋白質的含量,增強了根系活力,降低了MDA含量;高Pb2+濃度(500 mg/L)抑制了雜花苜蓿種子萌發和幼苗的生長,且100 μmol/L SNP不能緩解高鉛脅迫對植株的影響。
參考文獻:
[1] 任艷芳,何俊瑜,張沖,等.鉛脅迫對萵苣種子萌發和部分生理代謝的影響[J].江蘇農業學報,2010,26(4):740-744.
[2] Wendehenne D,Pugin A,Klessig D F.Nitric oxide:comparative synthesis and signaling in animal and plant cells[J].Trends Plant Science,2001,6(4):177-183.
[3] 魏學玲,史如霞,賈凌云,等.外源一氧化氮對鉛脅迫下小麥種子萌發及幼苗生理特性的影響[J].植物研究,2011,31(1):34-39.
[4] 張遠兵,劉愛榮,張雪平,等.外源一氧化氮對鉛脅迫下高羊茅生長和無機離子含量的影響[J].廣西植物,2009,29(3):360-365.
[5] 孫立榮,郝福順,呂建洲,等.外源一氧化氮對鹽脅迫下黑麥草幼苗生長及生理特性的影響[J].生態學報,2008,28(11):5714-5722.
[6] 雍山玉,郁繼華,王燕燕,等.外源一氧化氮對鹽脅迫下辣椒種子萌發和幼苗生理的影響[J].甘肅農業大學學報,2007(4):51-55.
[7] 鄒琦.植物生理學實驗指導[M].北京:中國農業出版社,2000.
[8] 顏宏,趙偉,秦峰梅.鹽堿脅迫對堿地膚、地膚種子萌發以及幼苗生長的影響[J].東北師范大學學報,2006,38(4):117-123.
[9] 袁芳,楊劍超,陳敏,等.NaCl脅迫下外源NO供體硝普鈉(SNP)對鹽地堿蓬種子萌發的影響[J].植物生理學通訊,2010,46(1):24-28.
[10] 劉秀梅,聶俊華,王慶仁.6種植物對Pb的吸收與耐性研究[J].植物生態學報,2002,26(5):533-537.
[11] 孫小霞.高羊茅對鉛遞進脅迫的生理響應[J].河南科技大學學報,2006,27(6):75-78.
[12] 劉家堯,衣艷君,張其德.鹽脅迫對不同植物鹽性小麥葉片熒光誘導動力學的影響[J].植物學通報,1998,15(20):46-49.
[13] 張明生,謝波,談鋒,等.甘薯可溶性蛋白、葉綠素及ATP含量變化與品種抗旱性關系的研究[J].中國農業科學,2003,36(1):13-16.
[14] 趙紅洋,陳莉.鹽分脅迫對5種園林灌木生理生化指標的影響[J].草原與草坪,2012,32 (2):7-14.
[15] 馮瑞章,魏琴.外源NO對NaCl脅迫下燕麥幼苗氧化損傷的緩解效應[J].草原與草坪,2012,32 (6):7-10,16.
[16] 尚小娟,王靜,多立安.堆肥基質馴化的高羊茅對鹽脅迫的生理生態響應[J].草原與草坪,2011,31 (1):28-33.
[17] 王艷,辛士剛,馬蓮菊,等.翦股穎和高羊茅對銅、鉛吸收及耐受性[J].應用生態學報,2007,18(3):625-630.
[18] 白彥真,謝英荷,陳燦燦,等.鉛對紫花苜蓿生長及氮、磷、鉀、鉛含量影響初探[J].山西農業大學學報,2006,26(3):261-263.
[19] Hsu YT,Kao KH.Cadmium toxicity is reduced by nitricoxide in rice leaves[J].Plant Growth Regul,2004,42:227-238.
[20] Laspina NV,Groppa M D,Tomaro M L,etal.Nitric oxide protects sunflower leaves against Cd-induced oxidative stress[J].Plant Science,2005,169(2):323-330.
[21] Kopyra M,Gwóz′dz′E A.Nitric oxide stimulates seed germination and counteracts the inhibitory effect of heavy metals and salinity on root growth of Lupinusalbus L.[J].Plant Physiol Biochem,2003,41:1011-1017.
[22] 孫立榮,郝福順,呂建洲,等.外源一氧化氮對鹽脅迫下黑麥草幼苗生長及生理特性的影響[J].生態學報,2008,28(11):5714-5722.

