2-甲基菲加氫反應熱力學研究
楊惠斌,張 晴,江洪波,翁惠新
(華東理工大學石油加工研究所,上海 200237)
2-甲基菲加氫反應熱力學研究
楊惠斌,張 晴,江洪波,翁惠新
(華東理工大學石油加工研究所,上海 200237)
以2-甲基菲加氫反應為研究對象,采用對比態法和基團貢獻法對各化合物的物性進行估算,并以物性數據為基礎,對不同反應溫度下反應網絡中各步反應的吉布斯自由能變、平衡常數和反應焓變進行計算,根據平衡常數計算不同氫分壓和反應溫度下的加氫反應產物平衡組成及反應氫耗。計算結果表明:2-甲基菲加氫的各步反應均為放熱反應,反應平衡常數隨著反應溫度的升高逐漸降低,較高的反應溫度或較低的氫分壓均有利于中間環加氫產物的生成并使反應過程的總氫耗降低。
2-甲基菲 多環芳烴 加氫 熱力學 選擇性
石油資源短缺以及世界原油品質的重質化、劣質化,使得石油加工的難度增大,隨著全球車用燃料市場對輕質油品需求量的逐漸增加,如何將重質油中的多環芳烴在較低的成本下最大量地轉化為輕質油品成為煉油領域研究的核心[1-2]。多環芳烴是重質油品中最難輕質化的化合物,在幾種成熟的重油輕質化工藝中,熱裂解無法將多環芳烴開環,多環芳烴在熱裂解反應過程中只能以結焦前身物的形式存在;催化裂化反應過程中存在的氫轉移反應和裂化反應可將少部分多環芳烴轉化成輕質油品,但多環芳烴仍主要發生脫氫積炭反應;加氫裂化可將多環芳烴加氫、開環、裂化成輕質化合物,但多環芳烴的氫碳比很低,傳統的加氫裂化技術往往是將多環芳烴全加氫再開環、裂化成輕質油品,反應條件苛刻,反應過程氫耗高,液體產物收率低。與全加氫反應不同,多環芳烴中間環加氫飽和反應氫耗低,中間環加氫產物經裂化反應后可得到單環芳烴類高附加值產品,近年來受到學者的普遍關注[3-5]。多環芳烴的芳環數較多,其加氫反應是一個極其復雜的過程,存在多條反應路徑。傳統的芳烴加氫催化劑對中間環加氫選擇性較低,因此有必要開發多環芳烴中間環選擇性加氫催化劑[3-4]。多環芳烴加氫反應熱力學是研究多環芳烴加氫反應限度和開發加氫催化劑的基礎,目前公開報道的文獻較少。
原油中常見的多環芳烴包括蒽、菲、芘、芴、熒蒽及其衍生物等,它們主要存在于較重的餾分油中[5],三環芳烴菲作為一種典型的多環芳烴,常常作為模型化合物用于多環芳烴加氫實驗中,但實際油品中的多環芳烴大部分都是帶側鏈的多環芳烴。本課題選擇2-甲基菲作為研究對象,通過對比態法和基團貢獻法[6-7]估算反應體系中各物質的物性及熱力學性質,考察2-甲基菲加氫反應體系的熱力學特點及中間環選擇性加氫的優化操作條件,為多環芳烴選擇性加氫催化劑的開發提供理論指導。
1 2-甲基菲加氫反應體系
據文獻[8-9]報道,2-甲基菲加氫反應過程中出現的主要物質有:2-甲基菲(A)、氫氣(B)、2-甲基-9,10-二氫菲(C)、2-甲基-1,2,3,4-四氫菲(D)、2-甲基-5,6,7,8-四氫菲(H)、2-甲基-1,8-八氫菲(E)、2-甲基-1,10-八氫菲(F)、2-甲基-5,10-八氫菲(I)和2-甲基全氫菲(G)。考慮各種可能的反應路徑,2-甲基菲的加氫反應網絡如圖1所示(圖中氫氣未示出),其中C是2-甲基菲中間環加氫產物。
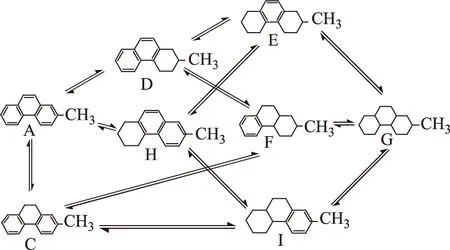
圖1 2-甲基菲加氫反應網絡
從圖1可以看出,2-甲基菲的加氫反應網絡極其復雜,從2-甲基菲加氫到2-甲基全氫菲的反應過程存在多條反應路徑,需要通過每一種化合物的物化性質來計算相應加氫反應的熱力學參數。然而,該反應體系中除氫氣的物性可以通過相關數據手冊查到外,其余物質的許多性質很難直接從物性手冊中查得,但可以通過合適的分子性質估算方法計算得到。本課題組曾經利用對比態法和基團貢獻法對菲加氫反應體系的熱力學性質進行了估算,并將求得的熱力學平衡常數在反應動力學參數估算過程中加以應用,實驗數據擬合效果良好,且正負反應速率常數之比符合平衡關系[10]。
2 2-甲基菲加氫反應熱力學性質計算
2.1 標準狀態下各物質的物性
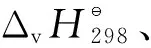
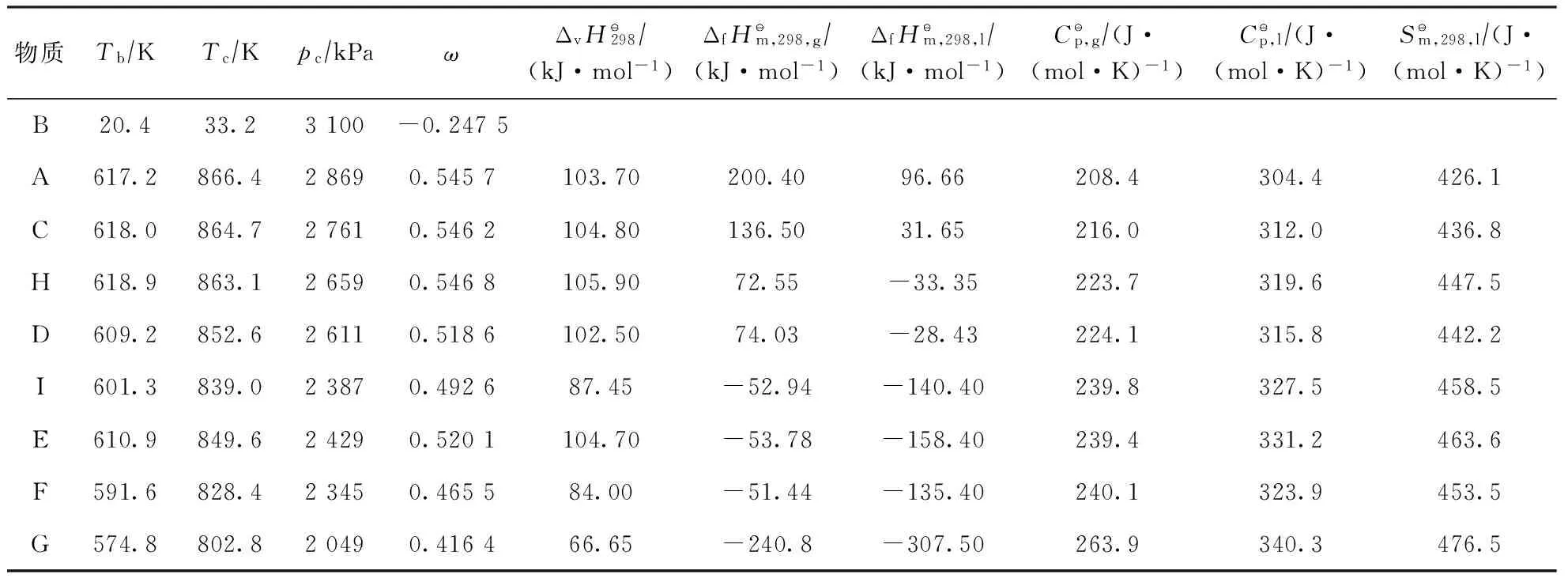
表1 2-甲基菲加氫反應體系中各物質的物性
2.2 標準狀態下反應焓變、熵變和吉布斯自由能變
2.3 不同反應條件下吉布斯自由能變、平衡常數和焓變


表2 標準狀態下各反應的焓變、熵變和吉布斯自由能變

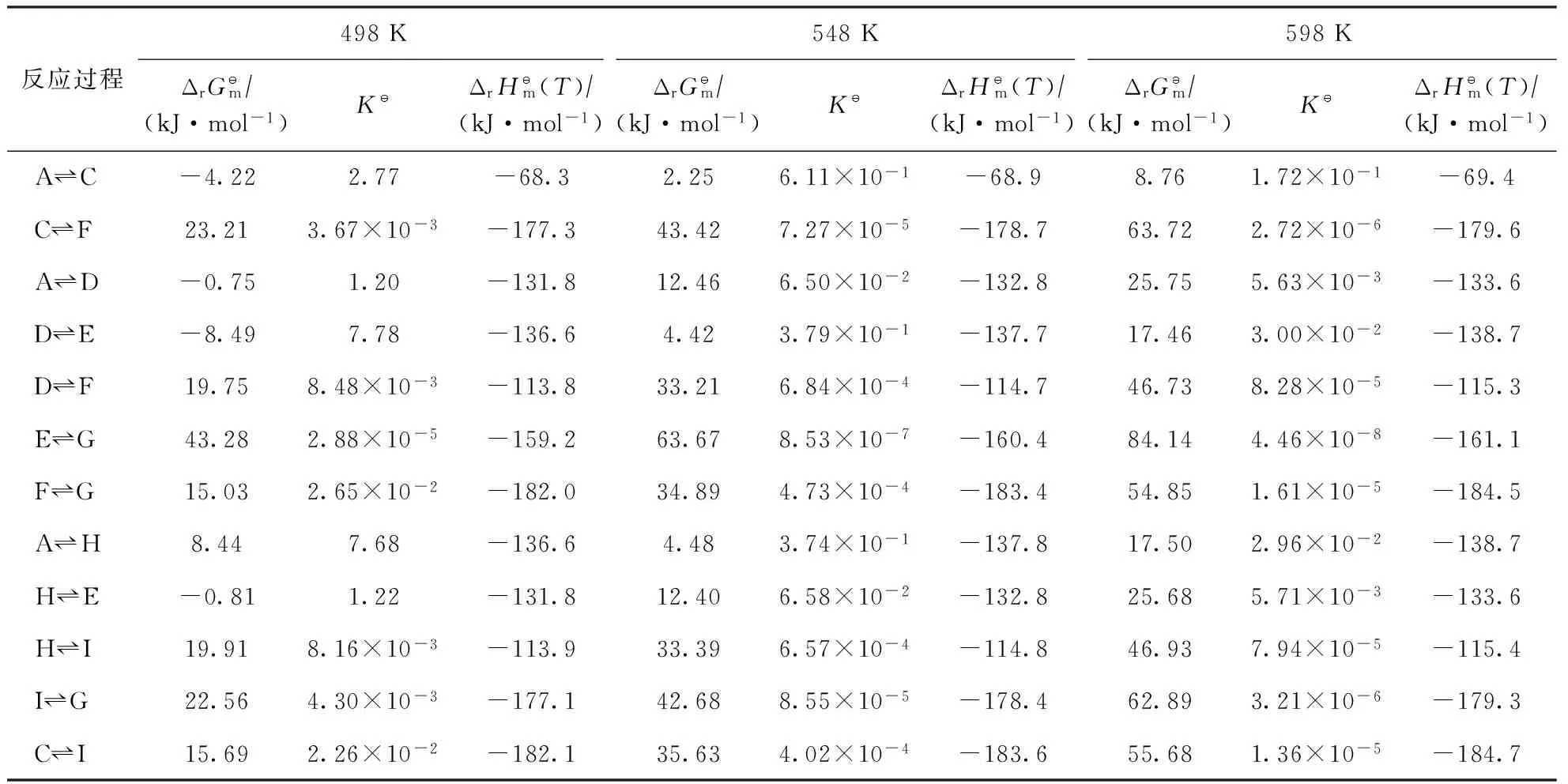
表3 498,548,598 K時各反應的吉布斯自由能變、平衡常數和焓變
由表3可知,當反應溫度為498~598 K時,2-甲基菲加氫反應網絡中的各反應焓變均小于零,表明該反應網絡中的各反應均為放熱反應,但隨著反應溫度的升高,熱效應的增加并不明顯。當反應溫度為498 K時,2-甲基菲加氫反應網絡中部分反應的吉布斯自由能變小于零,表明這些反應可自發進行,而當反應溫度升高到548 K和598 K時,反應網絡中各反應的吉布斯自由能變均大于零,表明各反應均不可自發進行。隨著反應溫度的升高,各反應的吉布斯自由能變增加比較明顯,同時表現出平衡常數減小,表明相應的加氫產物熱力學平衡濃度降低。從熱力學角度分析,降低反應溫度有利于加氫產物熱力學平衡濃度的增加,而由阿倫尼烏斯方程可知,反應溫度是影響反應速率的關鍵因素,反應溫度升高,加氫反應速率增大,獲得相同濃度的加氫產物時所需的反應時間減小。因此,存在使反應速率和產物濃度均達到最優值的最佳反應溫度。
3 反應平衡濃度與氫耗
3.1 不同反應條件下各物質的平衡濃度
通過計算得到不同溫度下2-甲基菲加氫反應的平衡常數,并得到不同氫分壓下2-甲基菲及其加氫產物的熱力學平衡濃度(Ci,摩爾分數)隨反應溫度(T)的變化關系,結果見圖2。
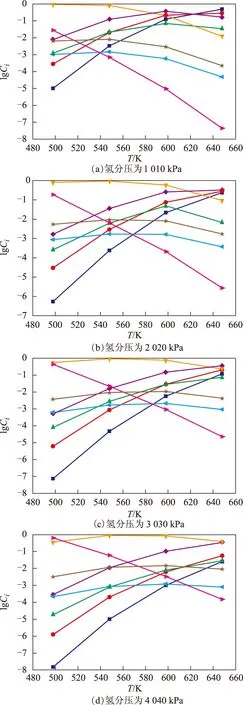
圖2 不同氫分壓下反應體系平衡濃度與反應溫度的關系■—2-甲基菲; ●—2-甲基-9,10-二氫菲; ▲—2-甲基-1,2,3,4-四氫菲; 甲基-1,8-八氫菲; 甲基-1,10-八氫菲; 甲基全氫菲;◆—2-甲基-5,6,7,8-四氫菲; ★—2-甲基-5,10-八氫菲
從圖2可以看出,在相同的氫分壓下,隨著反應溫度的升高,2-甲基菲的平衡濃度逐漸增加,中間環加氫產物2-甲基-9,10-二氫菲的平衡濃度逐漸增加,而2-甲基全氫菲的平衡濃度逐漸降低。在相同的反應溫度下,隨著氫分壓的升高,2-甲基菲的平衡濃度逐漸減小,2-甲基-9,10-二氫菲的平衡濃度減小,2-甲基全氫菲的平衡濃度逐漸增加。反應體系中的其它組分,隨著反應條件的變化其平衡組成濃度變化趨勢各有不同。因此,適當地提高反應溫度或降低反應壓力均可使中間環加氫產物2-甲基-9,10-二氫菲的平衡濃度得到提高。
3.2 不同反應條件下的總氫耗
2-甲基菲加氫反應深度不同其反應氫耗也不同,其中由1 mol 2-甲基菲加氫生成1 mol 2-甲基-9,10-二氫菲需要1 mol H2,生成1 mol的2-甲基-1,2,3,4-四氫菲或2-甲基-5,6,7,8-四氫菲需要2 mol 的H2,生成1 mol 2-甲基-1,8-八氫菲或2-甲基-1,10-八氫菲或2-甲基-5,10-八氫菲需要4 mol H2,生成1 mol 2-甲基全氫菲需要7 mol H2。隨著加氫深度的增加,氫耗逐漸增加。
根據生成每種加氫產物的反應氫耗,計算不同反應條件下1 mol 2-甲基菲的加氫反應達到熱力學平衡狀態時所需要消耗的氫氣物質的量,結果見表4。
由表4可看出:在相同的反應溫度下,隨著氫分壓的升高,總反應氫耗逐漸增加;在相同的反應壓力下,隨著反應溫度的升高,總反應氫耗逐漸減小。因此,適當提高反應溫度或降低氫分壓均有利于降低2-甲基菲加氫反應的氫耗。同時,對照圖2的各加氫產物熱力學平衡濃度分布規律,通過改變反應溫度和氫分壓可以控制加氫反應深度和反應氫耗,獲得更多的中間環加氫產物。從表4可以看出,在反應溫度為648 K、氫分壓為1 010 kPa的反應條件下,總反應氫耗為0.75 mol/mol,是全部計算結果中的最低值;由圖2可知,在該反應條件下,中間環加氫產物2-甲基-9,10-二氫菲的平衡濃度是全部計算結果中的最高值,表明高溫、低壓有利于提高2-甲基菲中間環加氫反應的選擇性。在實際生產過程中,由于生產條件和經濟性等方面的限制,多環芳烴加氫反應的停留時間往往較短,反應很難完全達到熱力學平衡狀態,很多工況下的加氫反應深度還遠未達到熱力學平衡狀態,因此,實際氫耗往往低于理論氫耗。
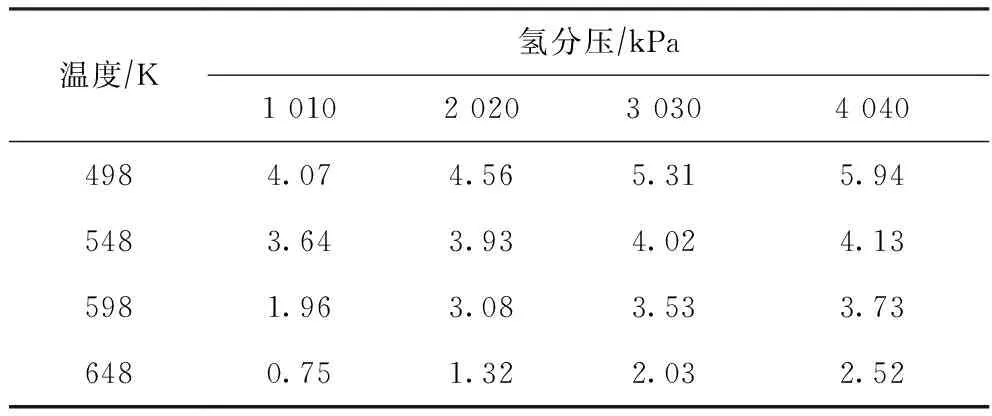
表4 不同反應條件下1 mol 2-甲基菲的加氫反應達到熱力學平衡時的總氫耗 mol
4 結 論
以2-甲基菲加氫反應為研究對象,通過熱力學計算得到了不同反應條件下的產物濃度分布規律,較高的反應溫度或較低的氫分壓均有利于中間環加氫產物2-甲基-9,10-二氫菲的生成并使反應體系的總氫耗降低,從而獲得較多的選擇性加氫產物并降低加氫反應的生產成本。
[1] 錢伯章.2010年中國石化進口高硫原油加工量增長17%[J].煉油技術與工程,2011,41(3):64
[2] 曹志濤,高原.含硫和高硫原油的加工技術[J].化學工業與工程技術,2010,31(2):24-27
[3] Yasuda H,Higo M,Yoshitomi S,et al.Hydrogenation of tetralin over sulfided nickel-tungstate/alumina and nickel-molybdate/alumina catalysts[J].Catalysis Today,1997,39(1/2):77-87
[4] Ahuja S P,Derrien M L,Le Page J F.Activity and selectivity of hydrotreating catalysts[J].Industry & Engineering Chemical Product Research and Development,1970,9(3):272-281
[5] 張成,周涵,王麗新,等.芘加氫分子模擬研究[J].計算機與應用化學,2012,29(2):161-164
[6] 董新法,方利國,陳礪.物性估算原理及計算機計算[M].北京:化學工業出版社,2006:30-237
[7] 馬沛生.化工熱力學(通用型)[M].北京:化學工業出版社,2005:261-291
[8] Korre S C,Klein M T.Hydrocracking of polynuclear aromatic hydrocarbons.Development of rate laws through inhibition studies [J].Industry Engineering Chemistry Research,1997,36(6):2041-2050
[9] Michele Nuzzi,Bruno Marcandalli.Hydrogenation of phenanthrene in the presence of Ni catalyst.Thermal dehydrogenation of hydrophenanthrenes and role of individual species in hydrogen transfers for coal liquefaction[J].Fuel Processing Technology,2003,80(1):35-45
[10]楊惠斌,常小瑞,江洪波,等.菲加氫反應體系的熱力學計算和分析[J].化學反應工程與工藝,2012,28(6):499-505
[11]孫世剛,陳良坦,李海燕,等.物理化學(上)[M].廈門:廈門大學出版社,2008:356-406
[12]Speight J G.Lange’s Handbook of Chemistry[M].16th ed.New York:McGraw-Hill,2005:135-1233
[13]Lide D R.CRC Handbook of Chemistry and Physics[M].87th ed.Boca Raton FL:Taylor and Francis Group,2007:3-10
THERMODYNAMICS OF 2-METHYLPHENANTHRENE HYDROGENATION REACTION
Yang Huibin, Zhang Qing, Jiang Hongbo, Weng Huixin
(ResearchInstituteofPetroleumProcessing,EastChinaUniversityofScienceandTechnology,Shanghai200237)
The hydrogenation of 2-methylphenanthrene was studied by group contributions and corresponding state methods to investigate the physicochemical properties of compounds involved. The Gibbs free energy change, equilibrium constants and enthalpy changes of each step of the reaction network at different temperatures were calculated based on the physicochemical properties obtained. The calculations of the product compositions and hydrogen consumptions under different pressures and temperatures according to the equilibrium constants were conducted. The calculation results show that all step reactions are exothermic, their equilibrium constants decrease as the reaction temperature increases. High temperature and low pressure are beneficial for the production of intermediate 2-methyl-9,10-dihydro-phenanthrene and for the reduction of total hydrogen consumption.
2-methylphenanthrene; polycyclic aromatics; hydrogenation; thermodynamics; selectivity
2014-01-03; 修改稿收到日期: 2014-02-18。
楊惠斌,高級工程師,博士研究生,從事反應動力學的研究及人事管理工作。
江洪波,E-mail:hbjiang@ecust.edu.cn。

