北京地區實驗動物中嗜肺巴斯德桿菌的表型分析
邢 進,馮育芳,岳秉飛,賀爭鳴
(中國食品藥品檢定研究院 實驗動物資源研究所,北京 100050)
嗜肺巴斯德桿菌(Pasteurellapneumotropica, PP)是一種主要感染嚙齒類動物的條件致病菌。其主要存在于嚙齒類動物的上呼吸道、肺、消化道和泌尿道[1]。一般PP不會影響到免疫功能正常動物的健康,但是會引起免疫缺陷動物嚴重的肺炎,并可能導致死亡[2,3]。PP是實驗動物檢測國家標準[4]中SPF級動物必須要排除的病原菌之一。國家標準中對PP的檢測方法進行了說明[5]。但是在實際的檢測工作中,巴斯德桿菌所屬的巴斯德菌科中,放線桿菌屬、嗜血桿菌屬以及巴斯德菌屬的很多菌株都會給鑒別造成困難,經常會遇到難以鑒別的情況。本研究通過對PP的分離株的生化結果進行分析,通過16S rDNA的測序對結果進行驗證,改進國家標準中的PP的生化鑒定項目,提高對PP檢測的準確性。
1 材料和方法
1.1 材料
1.1.1 菌種:嗜肺巴斯德桿菌Heyl型ATCC12555和Jawetz型ATCC35149,購自美國ATCC。采用國家標準分離鑒定的306株PP分離株,小鼠258株,大鼠39株,豚鼠3株,沙鼠6株。
1.1.2 試劑:OXIOD哥倫比亞血瓊脂培養基;BD革蘭氏陰性菌生化鑒定板,梅里埃氧化酶試劑;PP診斷血清由本實驗室制備。Qiagen DNA提取試劑盒;PCR和瓊脂糖電泳相關試劑購自寶生物工程(大連)公司。
1.1.3 主要儀器:上海安亭WGP-600隔水式恒溫培養箱,BD Phoenix100全自動細菌鑒定儀, ABI Verit PCR儀。
1. 2 方法
1.2.1 菌株鑒定:所有菌株接種于5%脫纖維羊血的哥倫比亞血瓊脂平皿,置37℃培養48 h。觀察菌落的大小、顏色、溶血特性等表型特征。
1.2.2 生化鑒定:所有菌株在血瓊脂平皿上37℃培養16 h,培養物用BD的革蘭氏陰性細菌鑒定板進行生化鑒定,其生化項目與國家標準中的生化項目、菌落顏色、溶血特性合并組成表型譜,共53個特征數據,應用Bionumerics 3.0軟件進行聚類分析。
1.2.3 DNA測序:受試菌株基因組DNA用Qiagen提取試劑盒提取。參考Weiburg[6]的方法,對16S rDNA進行擴增,產物送上海生工測序,測序結果在NCBI中進行Blast比對,取得16S rDNA鑒定結果。
1.2.4 生物型區分:Jawetz和Heyl型的鑒別參考Benga等[7]設計的多重PCR方法,針對巴斯德菌屬16S-23S間隔區,分別設計巴斯德菌屬,Jawetz型和Heyl型的特異性引物,見表1。對生化鑒定和測序結果為陽性的菌株進行多重PCR,反應體系為20 μL,其中10× buffer(含Mg2+)2 μL,dNTP(2.5 mM)1.6 μL,TaqHS酶(5 U/μL)0.2 μL,PastF、PastR和HeylR(均10 μmol/L)各0.5 μL,JawR(10 μmol/L)0.4 μL,菌株模板DNA 2 μL,ddH2O 12.3 μL。PCR擴增條件為:95℃預變性5 min;94℃變性1 min, 58℃退火30 s, 72℃延伸30 s,30個循環;最后72℃ 延伸4 min。
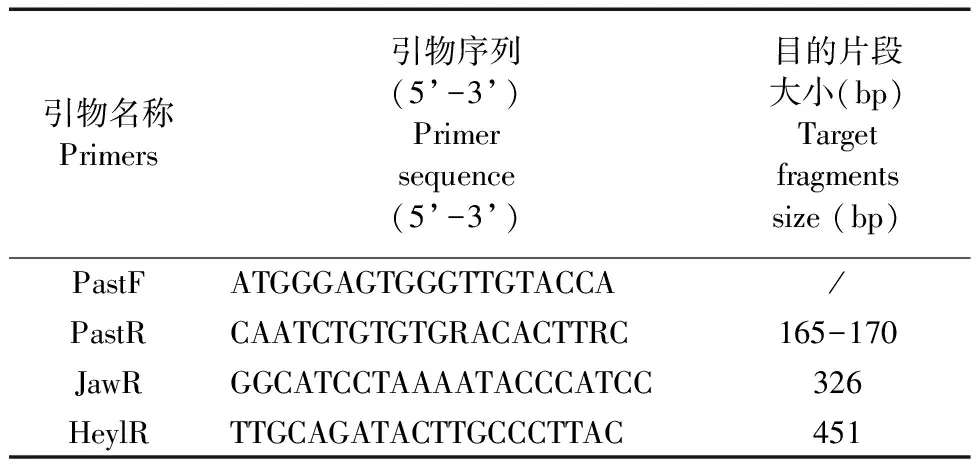
表1 巴斯德菌屬,Jawetz型和Heyl型特異性引物
2 結果
2.1 菌株鑒定
2.1.1 生化和菌落特征鑒定:所有306菌株分離株按照國家標準鑒定符合PP陽性條件。其中輕微a溶血菌株有70株,用棉簽刮取菌落,顏色灰白色的有35株,黃色的有189株。使用BD自動細菌鑒定系統進行再次鑒定,有164株鑒定為PP。
2.1.2 16 S rDNA測序鑒定:經16S rDNA的測序,與NCBI上BLAST比對后又確定有63株為PP。結合菌落形態、生化反應以及16S rDNA測序結果綜合分析,排除BD細菌鑒定儀鑒定結果中2株假陽性。在306株可疑PP分離株中共確定真陽性菌株227株。不同動物分離株生化和測序鑒定結果真陽性比例見表2。
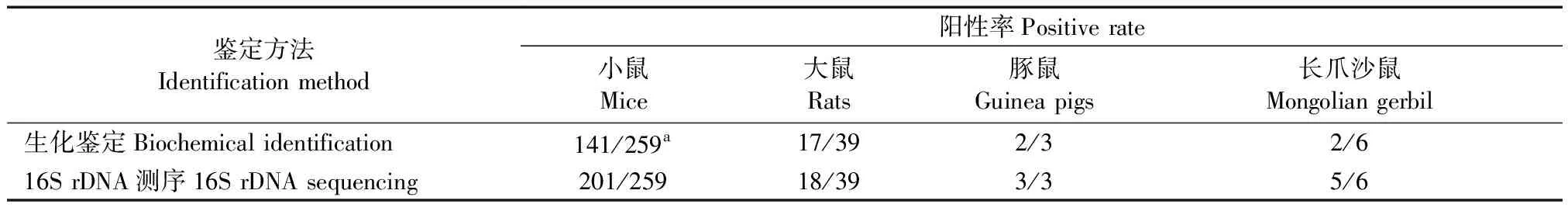
表2 分離自不同動物嗜肺巴斯德桿菌生化鑒定和16S rDNA測序鑒定結果
227株真陽性菌株主要生化項目陽性率,見表3。其中國家標準中要求的幾項生化試驗:氧化酶、過氧化氫酶、硫化氫、硝酸鹽均為陽性,動力和明膠液化均為陰性,尿素陽性率95.2%,靛基質陽性率5.3%。其中靛基質為陽性的菌株以Jawetz生物型居多,占52.6%(10/19),Heyl生物型只有21.1%(4/19)。在國家標準外的生化試驗:ONPG全部為陽性;麥芽糖、鼠李糖、山梨醇和七葉苷全部為陰性;另外磷酸鹽和醋酸鹽試驗陽性率分別為98.2%和1.3%。
在之前分離的306株菌株中,鑒定出與PP相似的菌株有產氣巴斯德桿菌(Pasteurellaaerogenes)22株、林氏放線桿菌(Actinobacilluslignieresii)15株和小鼠放線桿菌(Actinobacillusmuris)10株。
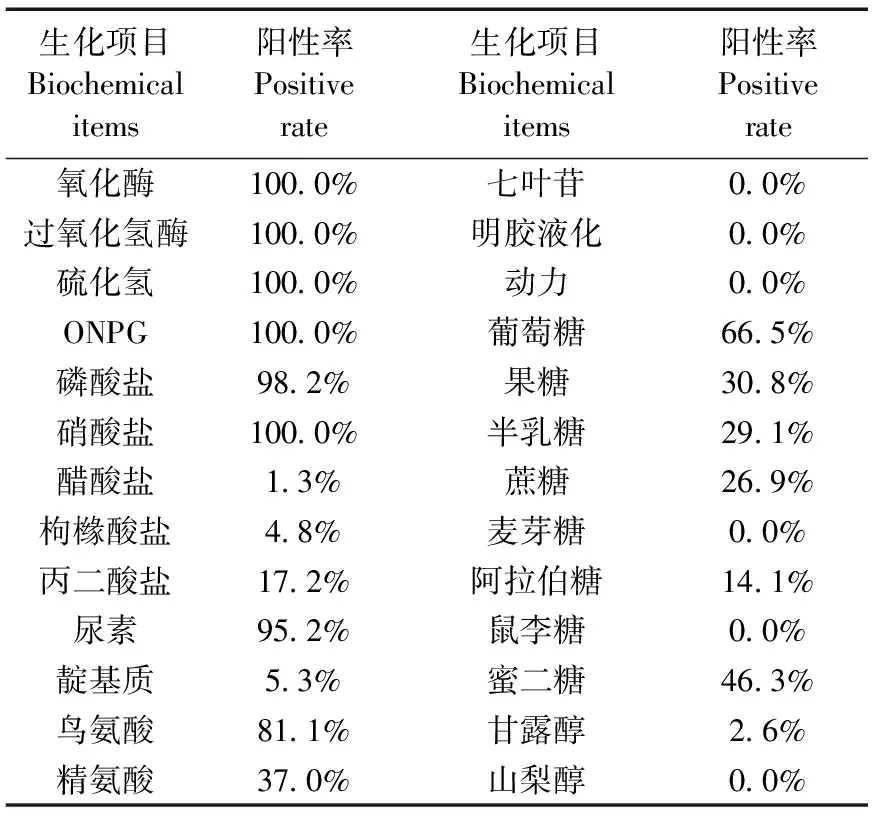
表3 227株嗜肺巴斯德桿菌主要生化反應陽性率
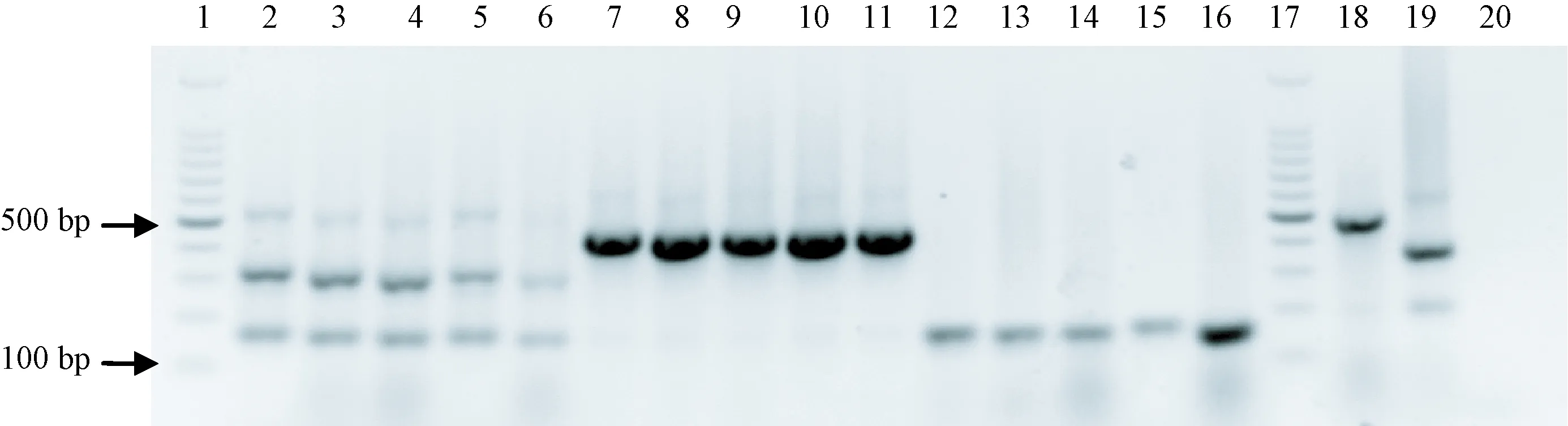
1、17:100bp DNA marker;2~6:Jawetz型,分別為PP、PP、PP、PP、PP;7~11:Heyl型,分別為PP、PP、PP、PP、PP;12~16:其他(非Jawetz和Heyl型),分別為PP、PP、PP、PP、PP;18:ATCC12555;19:ATCC35149;20:空白對照。
2.2 生物型和表型聚類分析
16S-23S rRNA間隔區PCR結果顯示,227株PP分離株中, Heyl型有184株,Jawetz型有24株,不能區分的有19株,見表4、圖1。根據表型特征聚類分析結果,在北京地區實驗動物中,Heyl生物型的污染占絕大多數,分離自16個來源,其以菌苔微黃為特征,并多伴有輕微的a溶血。其中有個分離源同時存在Jawetz型菌株的污染。
PP077和PP277的表型特征與標準菌株ATCC12555(Heyl型)的完全相同,先后分離自兩個不同的單位。結果中未發現與標準菌株ATCC35149(Jawetz型)表型相同的菌株,24株Jawetz型分離株與ATCC35149標準株的相似性僅有65%~74%。

表4 227株嗜肺巴斯德桿菌生物型
經Bionumerics 3.0軟件分析,227株PP的表型特征共有140種,其中184株Heyl型有106種,24株Jawetz型有23種,19株不能確定生物型的菌株表型均不相同,但有8種與Heyl型相符,如圖2。
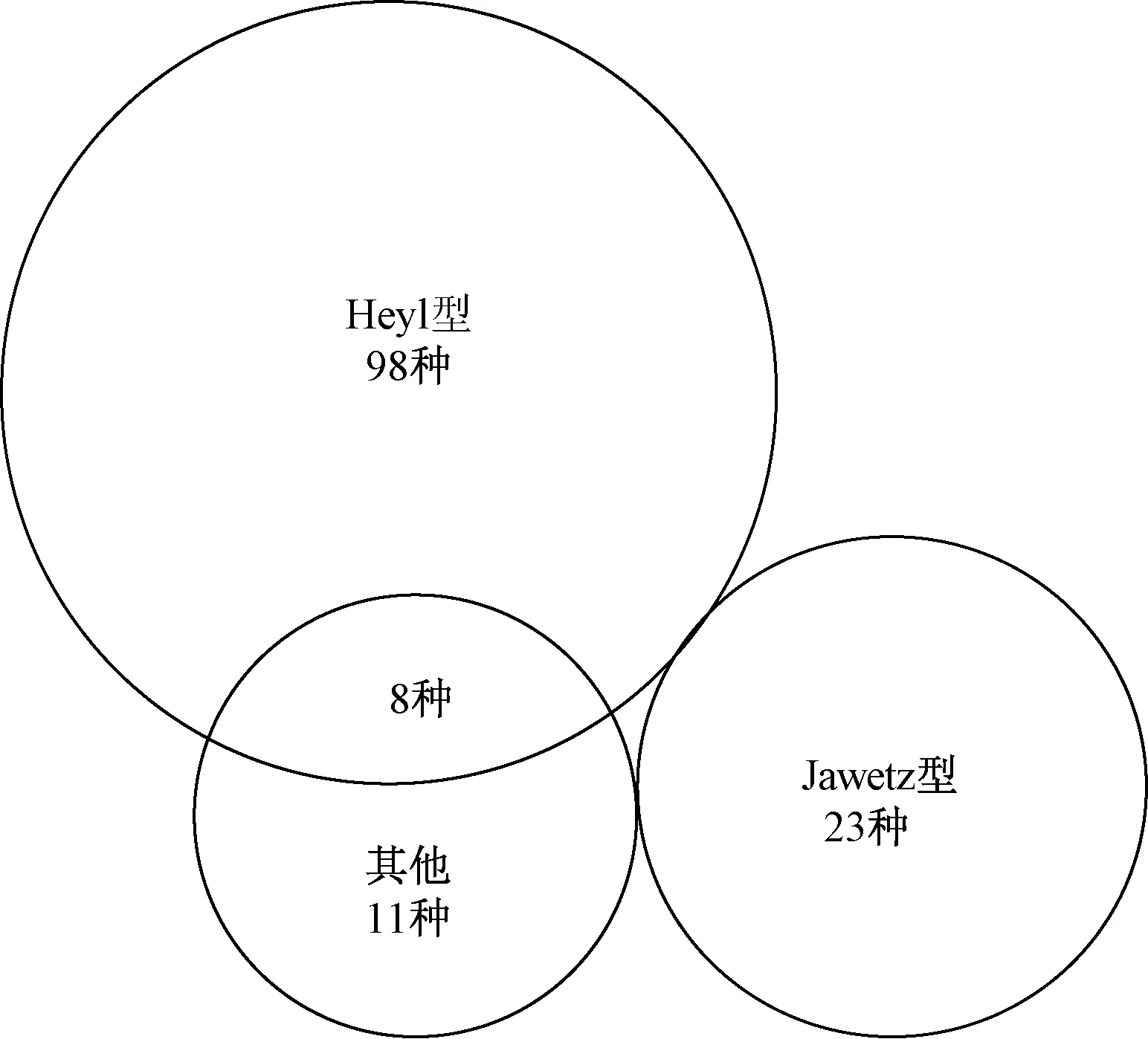
圖2 嗜肺巴斯德桿菌表型特征與生物型的分布
3 討論
本研究中,有4株分離株沒能復蘇成功,未能鑒定,其余菌株均獲得53項表型特征鑒定結果。結合生化反應、表型特征、PCR和16S rDNA測序,最終確定PP的真陽性菌株比例74.2%。對受試菌株表型特征的聚類分析發現北京地區實驗動物中的PP表型豐富多樣,增加了常規分離鑒定的難度。
國家標準中的PP靛基質給出的參考是陰陽性均有可能,本研究發現在北京地區分離到的菌株中,靛基質陽性率僅為5.3%,以Jawetz生物型居多。提示在檢測中,當其他生化項目相符時,靛基質陽性、菌苔為灰白色的菌株應考慮為PP的Jawetz生物型菌株。
由于目前國家標準中對PP的鑒定程序中的生化項目有限,血清凝集反應也會存在假陽性,當遇到菌落形態等表型特征與PP常接近的菌株時,容易造成與PP的混淆,造成假陽性的出現。因此有必要在檢測標準中增加生化鑒定項目,并引入分子生物學鑒定方法對檢測結果實施驗證。
16S rDNA的測序比對結果為Pasteurellaceaegen. sp. Forsyth A3的有33株,占比例較高,根據16S rDNA的聚類結果,其序列與PP標準菌株ATCC35149的相似性為30%左右,與ATCC12555的相似性為97%左右。序列的相似性表明這些菌株很可能是Heyl型嗜肺巴斯德桿菌的野生型菌株。此類菌株應如何確定歸屬有待從微進化角度進一步研究。
參考文獻:
[1] Sasaki H, Kawamoto E, Tanaka Y, et al. Comparative analysis ofPasteurellapneumotropicaisolates from laboratory mice and rats [J]. Antonie van Leeuwenhoek. 2009, 95(4):311-317.
[2] Macy JD Jr, Weir EC, Compton SR, et al. Dual infection withPneumocystiscariniiandPasteurellapneumotropicain B cell-deficient mice: diagnosis and therapy [J]. Comp Med, 2000, 50(1):49-55.
[3] Hart ML, Mosier DA, Chapes SK. Toll-like receptor 4-positive macrophages protect mice fromPasteurellapneumotropica-inducedpneumonia [J]. Infect Immun, 2003, 71(2):663-670.
[4] GB 14922.2-2001. 實驗動物微生物學等級及監測 [S]. 國家質量監督檢驗檢疫總局. 2011.
[5] GB/T 14926.12-2001. 實驗動物嗜肺巴斯德桿菌檢測方法 [S]. 國家質量監督檢驗檢疫總局. 2001.
[6] Weisburg WG, Barns SM, Pelletier DA, et al. 16S ribosomal DNA amplification for phylogenetic study [J]. J Bacteriol, 1991, 173(2):697-703.
[7] Benga L, Benten WP, Engelhardt E, et L. Development of a multiplex PCR assay based on the 16S-23S rRNA internal transcribed spacer for the detection and identification of rodentPasteurellaceae[J]. J Microbiol Methods. 2013, 95(2):256-261.

