人肺動脈平滑肌細胞中微小RNA-210通過MKP-1負性調節低氧下細胞的增殖*
靳有鵬, 龐婷婷, 王 偉, 王玉林
(山東大學附屬省立醫院兒科, 山東 濟南 250021)
慢性低氧性肺動脈高壓是臨床許多心肺疾病發生發展過程中伴隨或最終的病理生理環節,是一種嚴重的甚至危及生命的肺血管性疾病,臨床上表現為肺動脈壓力增高、肺血管阻力增加,右心室阻力負荷過重最終致右心衰竭,組織病理學改變為累及全層的血管炎,管壁的所有成分細胞均受累,最終肺血管及右室重塑。
微小RNA(microRNA,miRNA)是廣泛存在于真核生物中的一類長度為20~24個核苷酸所構成的內源性非編碼調控單鏈小分子RNA,它是由含有莖環結構的miRNA前體經Dicer剪切而成。越來越多的研究證實,miRNA作為重要的轉錄后調節基因,通過抑制靶信使mRNA 的翻譯而起到重要的調控作用,參與細胞的分化、增殖、凋亡以及多種生物組織的發育調節過程[1]。研究表明哺乳動物中50%~60%的mRNA受miRNA調控[2]。
近年來的研究表明,miRNA在低氧下細胞進行生理性及病理性調節過程中發揮著舉足輕重的作用。其中一些miRNA的表達顯著地受低氧調節,因此被命名為“低氧相關的微小RNA(hypoxia-related miRNA)”[3]。MicroRNA-210(miR-210)是一種在低氧下表達顯著上調的miRNA,它參與調節血管生成、細胞凋亡、增殖、分化、DNA修復、線粒體代謝以及腫瘤生長[4-7],其在肺動脈高壓中的作用日益受到重視,有研究發現在慢性低氧所致肺動脈高壓鼠的肺組織中miR-210表達上調[8], 但其在低氧性肺動脈高壓中的作用仍不甚清楚。
絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)細胞內信號轉導途徑廣泛存在。真核細胞中是由4種激酶組成的鏈式反應,其中,每種激酶都通過復雜的反應網絡激活下游底物激酶,調節細胞生長、增殖、分化或凋亡,被廣泛用于細胞信號轉導的研究。它的級聯反應實際上是分3步進行的:首先是MAPKK激酶(MAPKK kinase,MKKK)磷酸化激活MAPK激酶(MAPK kinase,MKK),后者活化后磷酸化激活MAPK,活化的MAPK再去激活一些轉錄因子,調控基因表達。活化的MAPK主要被其磷酸酶去磷酸化而失活,這其中絲裂原活化蛋白激酶磷酸酶1(mitogen-activated protein kinase phosphatase 1,MKP-1)的作用最為重要。研究發現, MKP-1可被低氧誘導[9],近年來,越來越多的研究發現其在肺動脈高壓中起著重要作用。一項研究發現MKP-1缺失的小鼠易發展為重度肺動脈高壓[10],也有研究證實西地那非通過誘導MKP-1在肺動脈平滑肌細胞中發揮細胞保護作用[11]。但關于miR-210通過調節MKP-1而參與肺動脈高壓的相關研究,至今尚未見報道。
本文旨在研究低氧時人肺動脈平滑肌細胞(human pulmonary artery smooth muscle cells, hPASMCs)miR-210和MKP-1的表達情況、它們之間的相互關系以及對肺動脈平滑肌細胞增殖的影響,為治療低氧性肺動脈高壓提供新的思路。
材 料 和 方 法
1 主要試劑
人肺動脈平滑肌細胞購于Lonza;RNA提取試劑Trizol和轉染試劑購自Invitrogen;實時熒光定量PCR試劑盒、引物、miRNA抑制劑及增強劑均購自生命技術公司。
2 細胞培養和分組
將hPASMCs置于含4.9% FBS及多種生長因子的培養基中,當細胞貼壁生長至80%~90%融合時進行傳代或用于實驗分組接種,取4~8代細胞用于實驗。每次實驗前取狀態良好的對數生長期細胞,經含0.02% EDTA/0.25%胰蛋白酶消化液消化,形成細胞懸液后分組接種,細胞于貼壁24 h后,換無血清培養基24 h使細胞生長同步化,再分別處理各實驗組。實驗分組:共分成12組,常氧處理(21% O2、5% CO2)6組和低氧處理(1% O2、5%CO2)6組,見表1。
3 主要方法
3.1實時熒光定量PCR法檢測各組平滑肌細胞中miR-210和MKP-1 mRNA的表達 RNA提取試劑和轉染試劑均購自Invitrogen。用Trizol試劑提取細胞總RNA并測定其濃度,逆轉錄成cDNA,再按說明書進行實時熒光定量PCR。以RNU48作為小RNA含量的內參照。PCR反應條件:95 ℃ 15 min熱啟動,然后94 ℃ 15 s,60 ℃ 30 s、72 ℃ 30 s,共40個循環。最后通過解鏈曲線分析擴增產物的特異性。 miRNA的相對表達量用2-ΔΔCt方法來表示。
3.2用Western blotting法比較各組MKP-1蛋白的表達 提取細胞總蛋白,取20 μg細胞總蛋白進行聚丙烯酰胺凝膠電泳,按濕轉法將電泳產物轉移到PVDF膜,5%脫脂奶粉4 ℃封閉2 h,滴加Ⅰ抗(1∶1 000)4 ℃過夜,TBST洗膜,滴加Ⅱ抗(1∶1 000)室溫孵育2 h,TBST洗膜后顯色,并用β-actin作為內參照。
3.3MTT法檢測肺動脈平滑肌細胞的增殖 培養細胞中加入20 μL MTT溶液,繼續37 ℃孵育4 h后,吸棄培養上清液,加入DMSO 150 μL,振蕩10 min。在ELISA檢測儀上測定各孔的A490值。
4 統計學處理
數據以均數±標準誤 (mean±SEM) 來表示,兩組間比較采用t檢驗,多組間比較采用方差分析,用SPSS 11.0統計軟件處理,以P<0.05為差異有統計學意義。
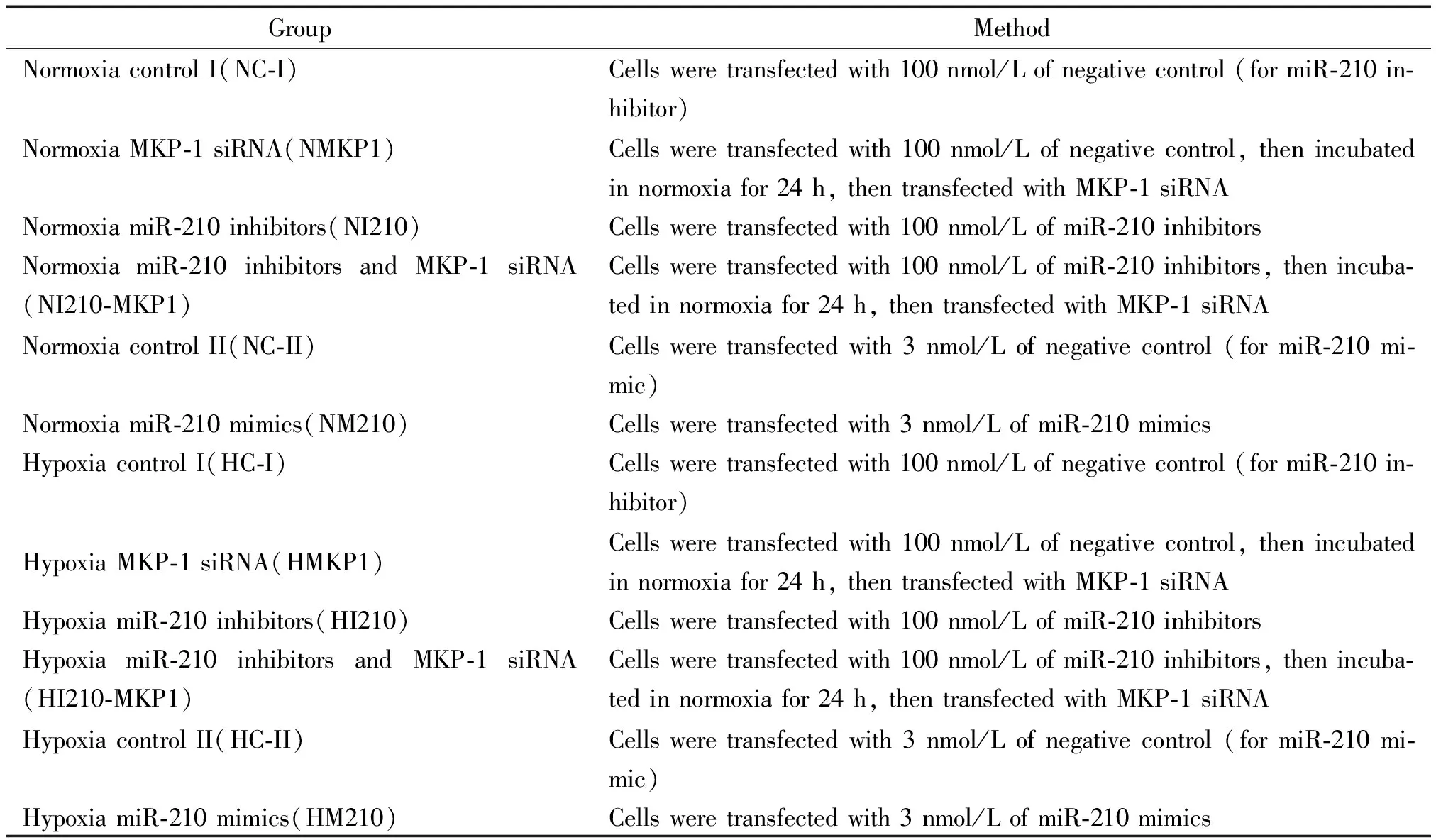
表1 細胞培養和實驗分組
結 果
1 低氧時hPASMCs miR-210的表達
hPASMCs分別放置于21% O2或1% O2的培養箱中48 h后,發現miR-210的表達水平明顯增加,見圖1。
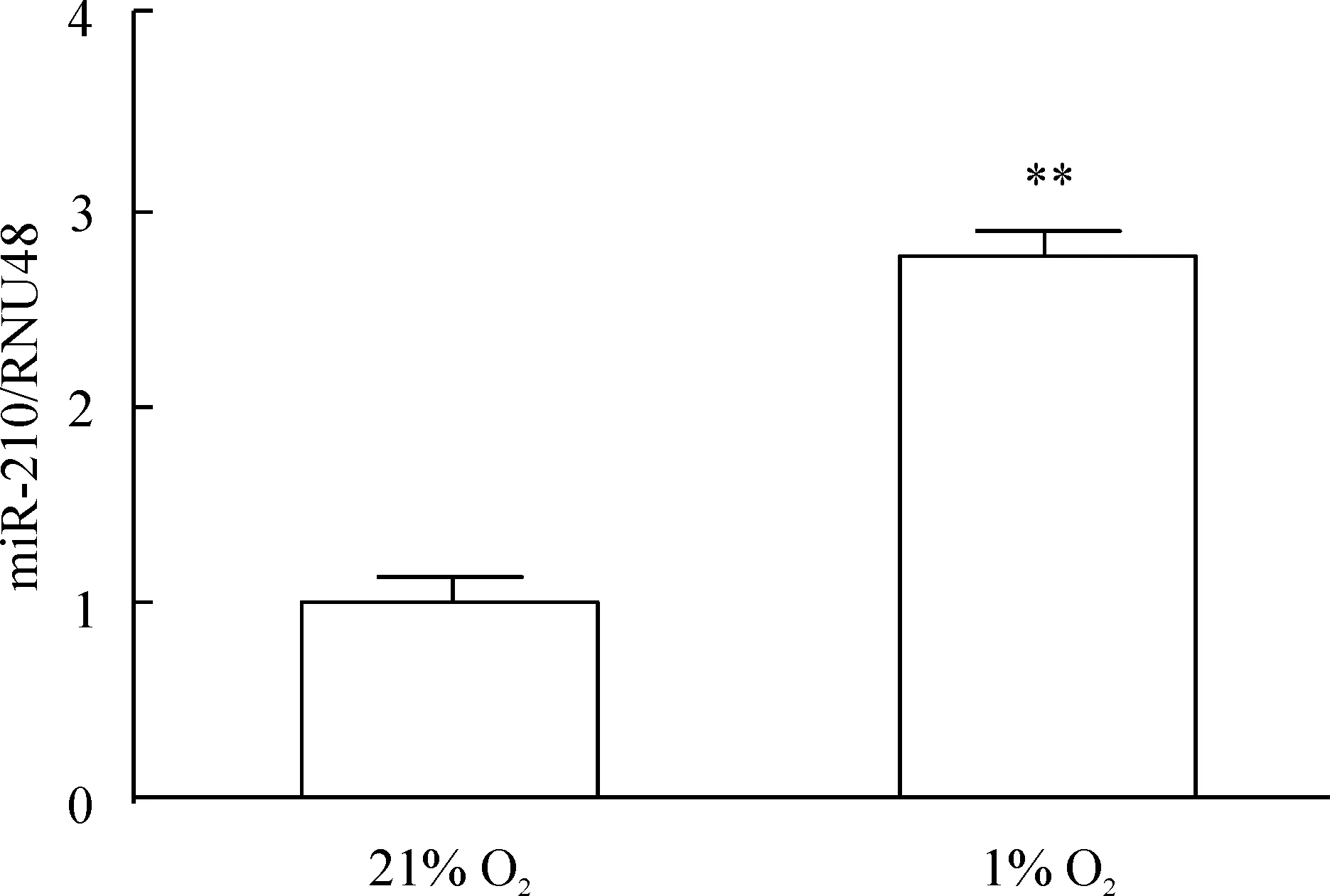
Figure 1. The expression of miR-210 in the hPASMCs determined by quantitative real-time PCR analysis.The hPASMCs were exposed to 21% O2 (normoxia) or 1% O2 (hypoxia) for 48 h. miR-210 mRNA levels were normalized to RNU48 expression.Mean±SEM.n=3. **P<0.01 vs 21% O2.
2 低氧時hPASMCs MKP-1的表達
hPASMCs分別放置于21% O2或1% O2的培養箱中48 h后,發現MKP-1 mRNA和蛋白的表達明顯增加,見圖2。
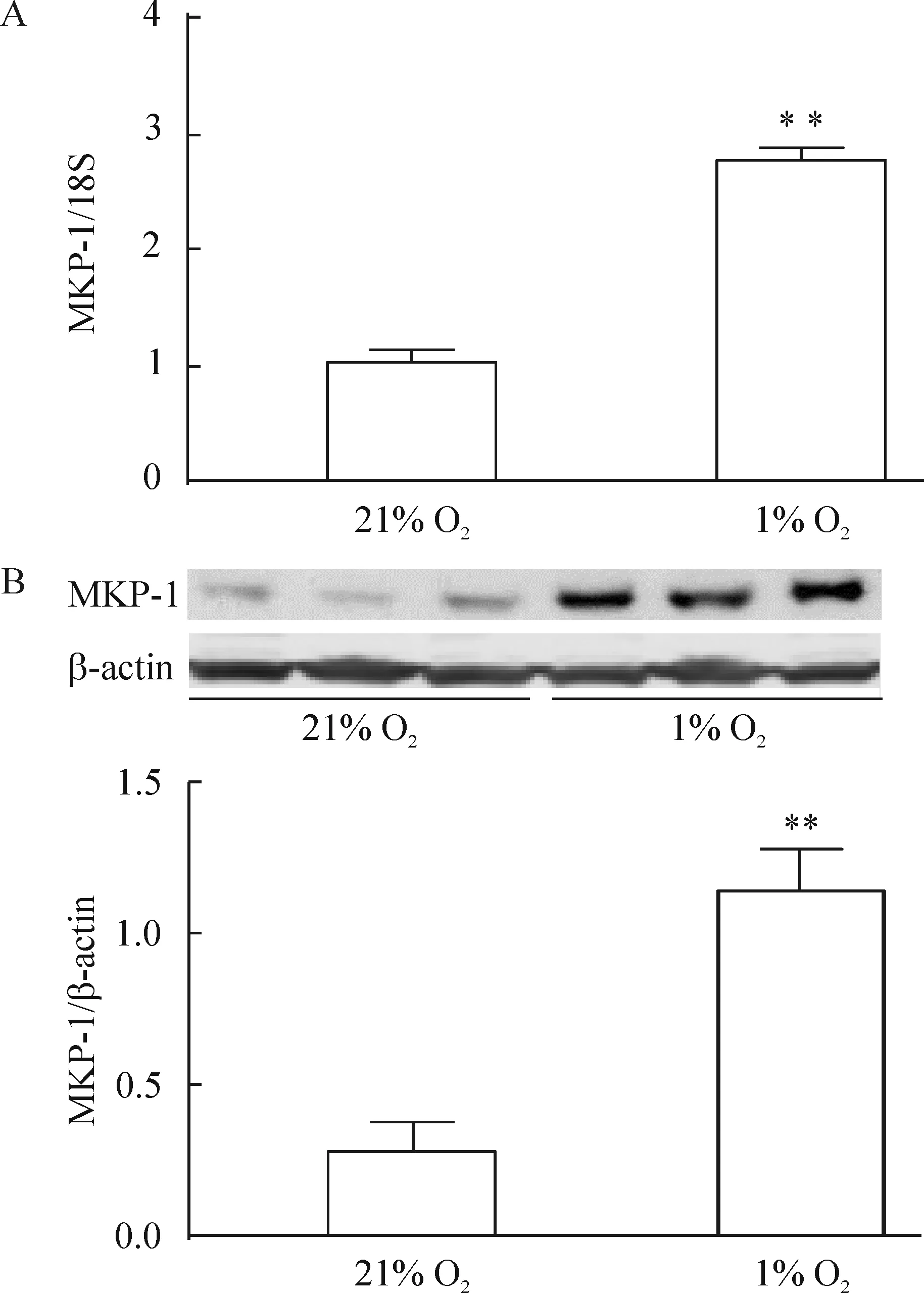
Figure 2. Expression of MKP-1 mRNA (A) and protein (B) in the hPASMCs. The hPASMCs were exposed to 21% O2 (normoxia) or 1% O2 (hypoxia) for 48 h.Mean±SEM.n=3.**P<0.01 vs 21% O2.
3 抑制miR-210表達使MKP-1的表達增加并可抑制低氧誘導的細胞增殖
將miR-210抑制劑轉染入hPASMCs內,再分別放置于21% O2或1% O2的培養箱中48 h后,發現常氧及低氧下,miR-210抑制劑明顯抑制miR-210的表達,增加MKP-1的表達,但只有低氧下抑制miR-210的表達后hPASMCs的增殖受到抑制,常氧下卻沒有這種效應,見圖3。
4 miR-210過表達可抑制低氧誘導的MKP-1表達上調但不影響細胞增殖
將miR-210增強劑轉染入hPASMCs內,再分別放置于21% O2或1% O2的培養箱中48 h后,實驗結果表明,miR-210過表達明顯抑制低氧誘導的MKP-1表達上調,但常氧及低氧均未影響hPASMCs的增殖,見表2、圖4。
5 MKP-1基因沉默后,低氧下miR-210抑制劑對細胞增殖的抑制作用消失
再將miR-210抑制劑轉染入hPASMCs內,再分別放置于1% O2培養箱中48 h后,實驗結果表明MKP-1基因沉默后,低氧下miR-210抑制劑對細胞增殖的抑制作用消失,見圖5。
討 論
2007年首次報道了通過微距陣的方法發現了低氧下miR-210的表達會上調,該作用可被低氧誘導因子 1α(hypoxia-inducible factor 1α,HIF-1α)或低氧誘導因子 2α(hypoxia-inducible factor 2α,HIF-2α)所誘導。本研究發現將hPASMCs置于低氧培養箱中48 h,miR-210的表達升高2.5倍左右,說明hPASMCs中miR-210的表達可被低氧所誘導。有研究發現,在急性缺氧的情況下,低氧誘導的miR-210通過下調鐵硫蛋白1/2[12]或線粒體電子傳遞蛋白[13-14]的表達來保障細胞存活,然而,另一方面這又是引起慢性缺氧性疾病的病理生理基礎。
MKP-1屬于絲裂原活化蛋白激酶家族,是細胞內的一種絲氨酸/蘇氨酸蛋白激酶。MKP-1的表達在多種因素刺激下均會增加,包括低氧、過氧化、糖皮質激素升高、熱休克等。本研究同樣發現低氧下的hPASMCs中MKP-1的表達增加。在多種細胞生理反應(如生長因子信號調節通路、細胞的炎癥、分化及凋亡等)中,MKP-1都通過使絲裂原活化蛋白激酶去磷酸化而提供重要的負反饋調節機制。類似miR-210,在低氧狀態下MKP-1也發揮著很多作用。研究表明MKP-1基因敲除的小鼠易表現為過度的炎癥反應,易患自身免疫性疾病及代謝缺陷病[15-16]。
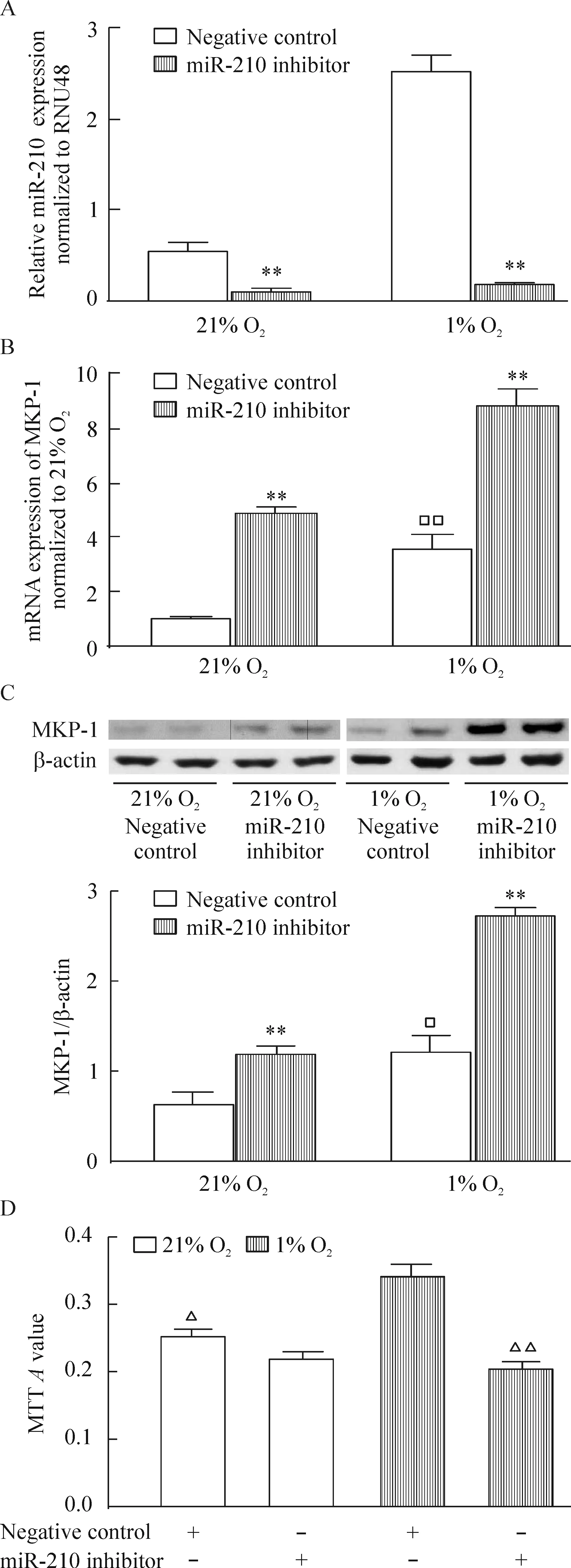
Figure 3. The effects of miR-210 inhibitor on hypoxia-induced MKP-1 expression and proliferation in the hPASMCs. The hPASMCs were exposed to 21% O2 (normoxia) or 1% O2 (hypoxia) for 48 h. A: miR-210 expression; B,C: MKP-1 mRNA and protein expression; D: proliferation of hPASMCs. Mean±SEM.n=3.**P<0.01 vs negative control;□P<0.05,□□P<0.01 vs 21% O2;△P<0.05,△△P<0.01 vs 1% O2+negative control.

表2 miR-210增強劑對miR-210表達的影響
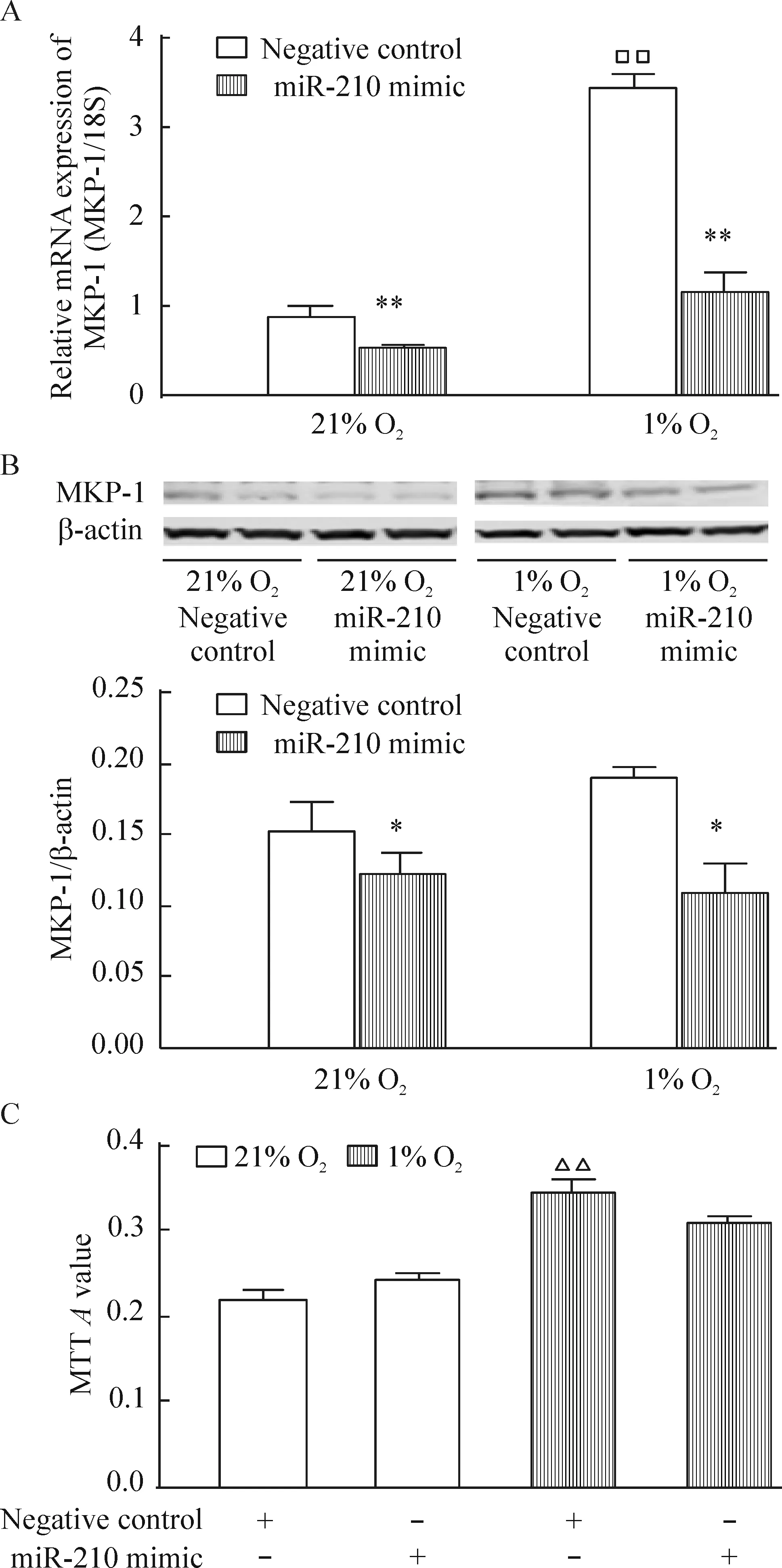
Figure 4. The effects of miR-210 mimic on MKP-1 expression (A,B) and proliferation (C) in the hPASMCs.The hPASMCs were exposed to 21%O2 (normoxia) or 1%O2 (hypoxia)for 48 h. Mean±SEM.n=3.*P<0.05,**P<0.01 vs negative control;□□P<0.01 vs 21% O2; △△P<0.01 vs 21% O2 negative control.
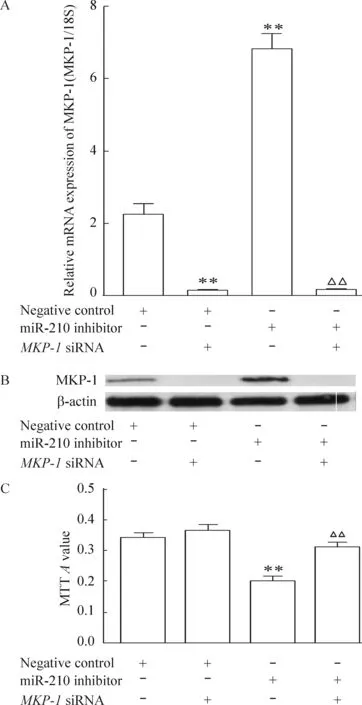
Figure 5. The effects of MKP-1 knockdown (A,B) on miR-210 inhibitor-decreased hPASMC proliferation (C) under hypoxia.Mean±SEM.n=3.**P<0.01 vs negative control; △△P<0.01 vs miR-210 inhibitor.
另有一項研究發現MKP-1缺失的小鼠在低氧下易患更嚴重的肺動脈高壓,提示MKP-1在低氧性肺高壓中發揮著重要作用[10]。
雖然miR-210和MKP-1在低氧性肺動脈高壓的發生發展中均起著舉足輕重的作用,但它們之間的相互關系仍不甚清楚。本研究結果顯示不論是低氧下或常氧下的hPASMCs中,抑制miR-210的表達后,MKP-1轉錄后水平的表達均增加,而增加miR-210的表達后,MKP-1轉錄后水平的表達均下降。由此說明,hPASMCs的MKP-1是miR-210的靶基因。通常MKP-1通過MAPK起作用,且MKP-1的作用取決于其與MKK的相對活性,關于miR-210與MKK的關系尚未見報道,miR-210是否進一步通過調節MKK的活性來調節肺動脈平滑肌細胞的增殖尚不清楚,仍需進一步研究來證實。
本研究還發現在hPASMCs中,抑制miR-210的表達可以減少低氧誘導的細胞凋亡,但miR-210的過表達卻并不影響細胞的增殖情況,由此說明,低氧下miR-210可負性調節hPASMCs的增殖,然而,近年來有另外一項研究報道[17],miR-210在hPASMCs中發揮抗凋亡的作用而并不影響細胞的增殖,這似與本研究結果有所不同,究其原因可能有如下兩方面。一是,這2個實驗所采用的培養細胞的氧濃度不同,本研究采用的氧濃度為1%,而另一研究采用的氧濃度為3%。二是,另有其它研究發現miRNA對靶基因呈非線性、劑量依賴性的選擇性調節作用[18],本研究中miR-210抑制劑的量與另一研究中所采用的劑量也不同,這可能也是原因之一。而且,miR-210抑制劑對細胞增殖的負性調節作用需依靠MKP-1來發揮,具體機制仍需進一步研究。
綜上所述,本研究發現在低氧下的hPASMCs中,MKP-1是miR-210的一個新的靶基因,MKP-1可以介導miR-210抑制劑對hPASMCs增殖的負性調節作用,這有望成為治療低氧性動脈肺高壓的新的靶點。
[參 考 文 獻]
[1] Pushparaj PN, Aarthi JJ, Kumar SD, et al. RNAi and RNAa: the Yin and Yang of RNAome[J]. Bioinformation, 2008, 2(6): 235-237.
[2] Lodish HF, Zhou B, Liu G, et al. Micromanagement of the immune system by microRNAs[J]. Nat Rev Immunol, 2008, 8(2):120-130.
[3] Hale AE, White K, Chan SY. Hypoxamirs in pulmonary hypertension: breathing new life into pulmonary vascular research [J]. Cardiovasc Diagn Ther, 2012, 2(3):200-212.
[4] Huang X, Le QT, Giaccia AJ. MiR-210: micromanager of the hypoxia pathway [J]. Trends Mol Med, 2010, 16(5):230-237.
[5] Kulshreshtha R, Ferracin M, Wojcik S, et al. A microRNA signature of hypoxia [J]. Mol Cell Biol, 2007, 27(5):1859-1867.
[6] Fasanaro P, D’Alessandra Y, Di Stefano V, et al. MicroRNA-210 modulates endothelial cell response to hypoxia and inhibits the receptor tyrosine kinase ligand Ephrin-A3[J]. J Biol Chem, 2008, 283(23):15878-15883.
[7] Won Kim H, Haider HK, Jiang S, et al. Ischemic preconditioning augments survival of stem cells via miR-210 expression by targeting caspase-8-associated protein 2 [J]. J Biol Chem, 2009, 284(48):33161-33168.
[8] Yang S, Banerjee S, de Freitas A, et al. miR-21 regulates chronic hypoxia-induced pulmonary vascular remodeling[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 302(6): L521-L529.
[9] Seta KA, Kim R, Kim HW, et al. Hypoxia-induced regulation of MAPK phosphatase-1 as identified by subtractive suppression hybridization and cDNA microarray analysis [J]. J Biol Chem, 2001, 276(48):44405-44412.
[10] Jin Y, Calvert TJ, Chen B, et al. Mice deficient in Mkp-1 develop more severe pulmonary hypertension and greater lung protein levels of arginase in response to chronic hypoxia[J]. Am J Physiol Heart Circ Physiol, 2010, 298(5): H1518-H1528.
[11] Li B, Yang L, Shen J, et al. The antiproliferative effect of sildenafil on pulmonary artery smooth muscle cells is mediated via upregulation of mitogen-activated protein kinase phosphatase-1 and degradation of extracellular signal-regulated kinase 1/2 phosphorylation [J]. Anesth Analg, 2007, 105(4): 1034-1041.
[12] Chan SY, Zhang YY, Hemann C, et al. MicroRNA-210 controls mitochondrial metabolism during hypoxia by repressing the iron-sulfur cluster assembly proteins ISCU1/2[J]. Cell Metab, 2009, 10(4):273-284.
[13] Muralimanoharan S, Maloyan A, Mele J, et al. MIR-210 modulates mitochondrial respiration in placenta with preeclampsia[J]. Placenta, 2012, 33(10): 816-823.
[14] Puisségur MP, Mazure NM, Bertero T, et al. miR-210 is overexpressed in late stages of lung cancer and mediates mitochondrial alterations associated with modulation of HIF-1 activity[J]. Cell Death Differ, 2011, 18(3): 465-478.
[15] Bennett AM, Tonks NK. Regulation of distinct stages of skeletal muscle differentiation by mitogen-activated protein kinases[J]. Science, 1997, 278(5341): 1288-1290.
[16] Liu Y, Shepherd EG, Nelin LD. MAPK phosphatases: regulating the immune response[J]. Nat Rev Immunol, 2007, 7(3):202-212.
[17] Gou D, Ramchandran R, Peng X, et al. miR-210 has an antiapoptotic effect in pulmonary artery smooth muscle cells during hypoxia[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 303(8):L682-L691.
[18] Shu J, Xia Z, Li L, et al. Dose-dependent differential mRNA target selection and regulation by let-7a-7f and miR-17-92 cluster microRNAs[J]. RNA Biol, 2012, 9(v10):1275-1287.

