牽張刺激對乳大鼠心房肌細胞瞬時外向鉀電流和內向整流鉀電流的影響*
胥亞楠, 楊 龍,△, 楊天和, 鄧春玉, 羅 淋, 覃智芳, 唐 倩, 楊 君
(1貴陽醫學院附屬人民醫院心內科,貴州 貴陽 550002; 2遵義醫學院第三附屬醫院心內科,貴州 遵義 563003; 3廣東省人民醫院醫學研究中心,廣東 廣州 510080)
心房顫動(房顫)常高發于有高血壓、心力衰竭(心衰)等基礎疾病的患者[1]。此類基礎疾病促使心房容量或壓力負荷增加,對心房肌產生牽張刺激,促進心房重構[2]。心房肌細胞離子通道重構是電重構的基礎。對房顫離子通道重構的研究涉及多種離子通道的表達和功能改變。瞬時外向鉀電流(transient outward potassium current,Ito)和內向整流鉀電流(inward rectifier potassium current,IK1)是參與心肌細胞動作電位(action potential, AP)復極相1、3期的主要離子流,其電流大小明顯影響AP 1、3相時程。本研究通過體外牽張模型拉伸培養的心房肌細胞,應用膜片鉗全細胞記錄方法探討牽張刺激對Ito、IK1及動作電位時程(action potential duration, APD)的影響。
材 料 和 方 法
1 主要試劑
高糖DMEM培養基、胎牛血清和0.25%胰蛋白酶(Gibco),Ⅱ型膠原酶(Invitrogen),辣根過氧化酶抗兔抗體(Santa Cruz),封閉專用脫脂奶粉(普利萊公司),4′, 6-二脒基-2-苯基吲哚(4′, 6-diamidino-2-phenylindole, DAPI; Biobox),硅膠膜購于SMI,5-溴脫氧尿嘧啶核苷(5-bromodeoxyuridine, 5-BrdU)、4-氨基吡啶(4-amion pyridine, 4-AP)、兔抗大鼠α-橫紋肌肌動蛋白(a-sarcomeric actin, α-SCA) 抗體和環孢素A(cyclosporine A, CsA)購自于Sigma,其余試劑均為進口分裝或國產分析純。
記錄鉀電流的細胞外液(mmol/L):NaCl 136.0、KCl 5.4、MgCl2·6H2O 1.0、NaH2PO40.33、CaCl2·2H2O 2.0、HEPES 10.0和葡萄糖10.0,pH用NaOH調至7.4。記錄Ito時,在細胞外液中加入0.3 mmol/L CdCl2和0.5 mmol/L BaCl2分別阻斷L-型鈣電流(ICa-L)和IK1。記錄IK1時,在細胞外液中加入0.5 mmol/L 4-AP和1 μmol/L尼卡地平分別阻斷Ito和ICa-L。鉀電極內液(mmol/L):KCl 140、MgCl2·6H2O 1.0、HEPES 10.0、EGTA 5.0、Na2·ATP 5.0,pH用KOH調至7.2。記錄動作電位的電極內液(mmol/L):KCl 140、MgCl2·6H2O 1.0、HEPES 10.0、EGTA 0.05、Na2·ATP 5.0,pH用KOH調至7.2。含鈣臺氏液(mmol/L):NaCl 136、KCl 5.4、NaH2PO40.33、葡萄糖10.0、HEPES 10.0和CaCl2·2H2O 2,pH用NaOH調至7.4[3]。
2 動物與儀器
1 日齡SD乳鼠每組9只,由中山大學醫學部動物中心提供,雌雄不限,許可證號為[SCXK(粵)2011-0029]。倒置顯微鏡(ZEISS AXIO型)。電極拉制儀(Narishige PP830型)。膜片鉗放大器(Axopatch700B)及附件均為Axon產品。
3 主要方法
3.1乳鼠心房肌細胞分離與培養 分離乳鼠心房并剪碎。以含胰酶與Ⅱ型膠原酶的混合消化液消化6 ~ 7 min,取上層細胞懸液于10% FBS-DMEM中終止消化。重復消化、終止過程,直至組織塊完全消化。1 000 r/min離心5 min,棄上清,沉淀加適量完全培養基,制成細胞懸液。采用差速貼壁與BrdU結合,于37 ℃、5% CO2培養箱中純化培養24 h,更換培養液洗去未貼壁細胞與成纖維細胞,換含5%血清培養基進行下一步實驗[4]。
3.2心房肌細胞免疫熒光染色鑒定 細胞爬片培養48 h,4%多聚甲醛室溫固定60 min,PBS洗3遍,每次5 min。5% BSA室溫封閉30 min后,加Ⅰ抗兔抗大鼠α-SCA抗體(1∶50)4 ℃過夜,PBS洗3遍,每次5 min。加Ⅱ抗羊抗兔IgG-FITC (1∶100),37 ℃ 60 min。PBS洗3遍,復染細胞核,加入封片劑封片后,于熒光顯微鏡下觀察并攝片[4]。以乳大鼠心臟成纖維細胞作為陰性對照。
3.3細胞牽張刺激 采用靜態等雙軸牽張裝置對心房肌細胞施加定量力學拉伸。牽張刺激可使細胞肥大、蛋白/DNA比值增大。本課題前期實驗中,給予培養24 h的心房肌細胞增加12%硅膠膜面積牽張刺激24 h,細胞蛋白質/DNA比值增大,證實了牽張刺激的有效性[5]。
3.4細胞干預分組 細胞培養于牽張裝置24 h,更換5% FBS-DMEM培養基。對照組不予牽張刺激;牽張組予以增加12%硅膠膜面積牽張刺激培養24 h。
3.5心房肌細胞Ito和IK1測定 預溫0.125%胰酶消化心房肌細胞,制成單細胞懸液。于直徑35 mm培養皿中調整細胞數使其密度約為1×102,37 ℃、5% CO2培養2~3 h使細胞貼壁。選擇立體感強、大小適中的細胞進行實驗。玻璃微電極充灌電極液后電阻為2~4 MΩ。施加負壓使電極與細胞表面形成1 GΩ以上高阻抗封接。破膜,給予慢電容補償,形成全細胞記錄。設置鉗制電壓為-50 mV,給予指令電位-40 mV~+60 mV,步階電壓10 mV,波寬300 ms,頻率0.2 Hz的刺激,記錄Ito。記錄IK1時,將鉗制電壓設置為-40 mV,指令電壓-120 mV~+30 mV,步階電壓10 mV,波寬500 ms,頻率0.1 Hz。為避免細胞大小所造成的誤差采用電流密度分析,電流密度(pA/pF)=電流強度/電容。電流信號經Ag/AgCl電極引導,由膜片鉗AXON 700B放大器放大通過AD/DA轉換板,并存儲于計算機硬盤中。實驗由pCLAMP 10.0軟件程序刺激發放和信號采集。
3.6心房肌細胞AP測定 AP記錄同膜片鉗全細胞記錄Ito和IK1相似。區別在于采用細胞貼附技術,形成高阻封接后破膜,不予補償。并應用全細胞膜片鉗技術中的電流鉗模式,給予1 nA電流脈沖,波寬5 ms,引發心房肌細胞AP。記錄并分析靜息膜電位(resting membrane potential, RMP)和動作電位幅度(action potential amplitude, APA)和動作電位復極50%、90%時程(APD50、APD90)。
4 統計學處理
采用pCLAMP 10.0軟件進行數據和圖形轉換,運用SigmaPlot軟件繪制離子通道電流密度-電壓曲線。用SPSS 13.0統計軟件分析。數據以均數±標準差(mean±SD)表示,組間比較采用t檢驗。以P<0.05為差異有統計學意義。
結 果
1 乳大鼠心房肌細胞鑒定
由乳鼠心房組織分離、純化培養48 h的細胞,有95%為 α-SCA抗體免疫熒光染色陽性(圖1A),而成纖維細胞為陰性(圖1B),表明前者為心房肌細胞。
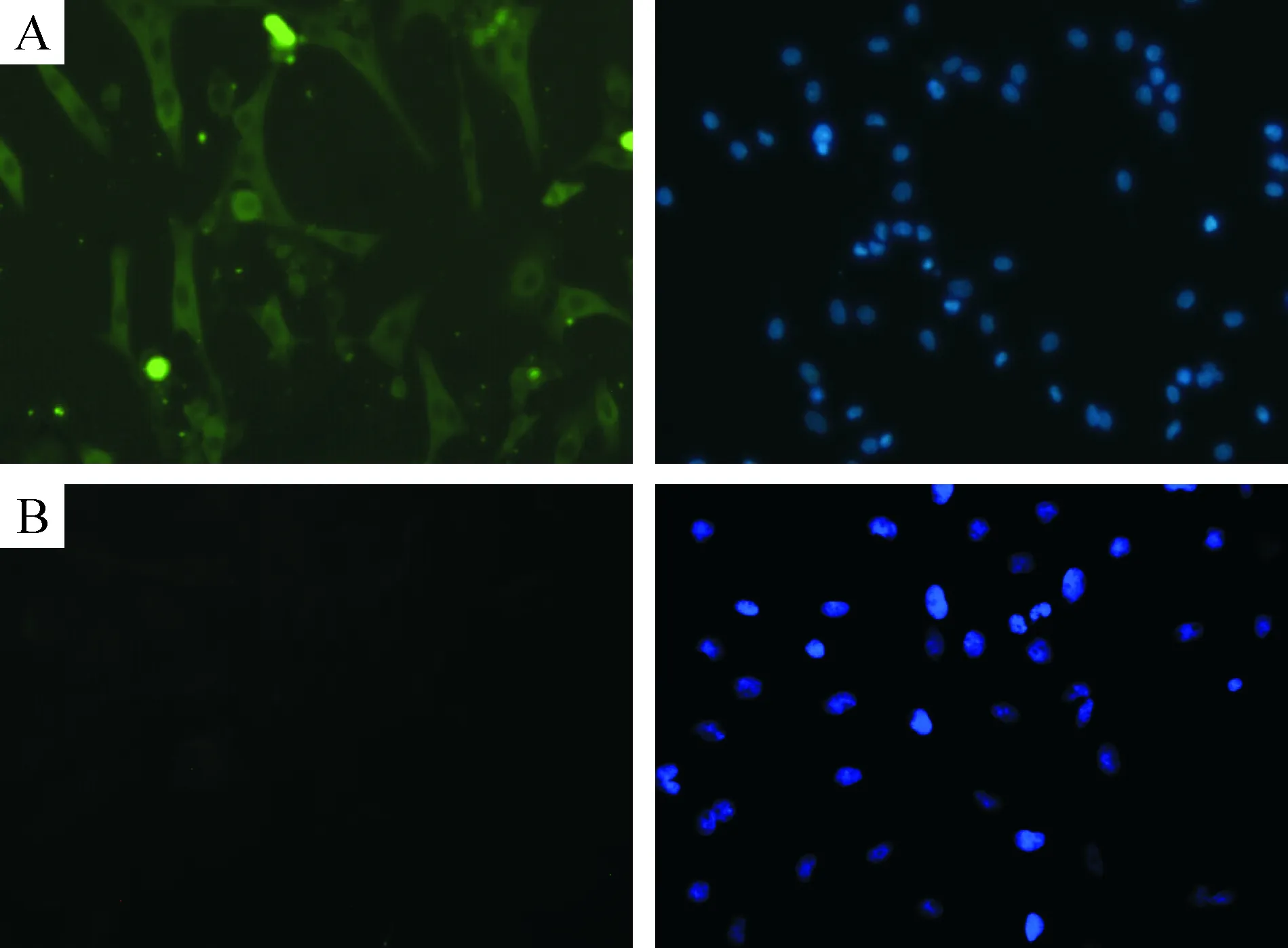
Figure 1. α-SCA antibody immunofluorescence staining of atrial myocytes.A: the left picture is cultured for 48 hours of atrial myocytes of rabbit anti α-SCA antibody immunofluorescence staining, green is positive (×200); the right one is the same vision for nuclear with DAPI (×200); B: the results of cardiac fibroblasts stained under the same condition of atrial myocytes.
2 牽張對乳大鼠心房肌細胞Ito的影響
2組心房肌細胞Ito在-20 mV激活,電流密度隨去極化程度增加而增大,于+60 mV達最大值。與對照組相比,牽張組Ito峰值從+20 mV電壓開始顯著減小,且牽張組Ito的I-V曲線明顯下移,見圖2。在+60 mV鉗制電壓水平,對照組與牽張組電流密度分別為(12.1±2.9)pA/pF 和(1.6±0.4)pA/pF(P<0.01)。
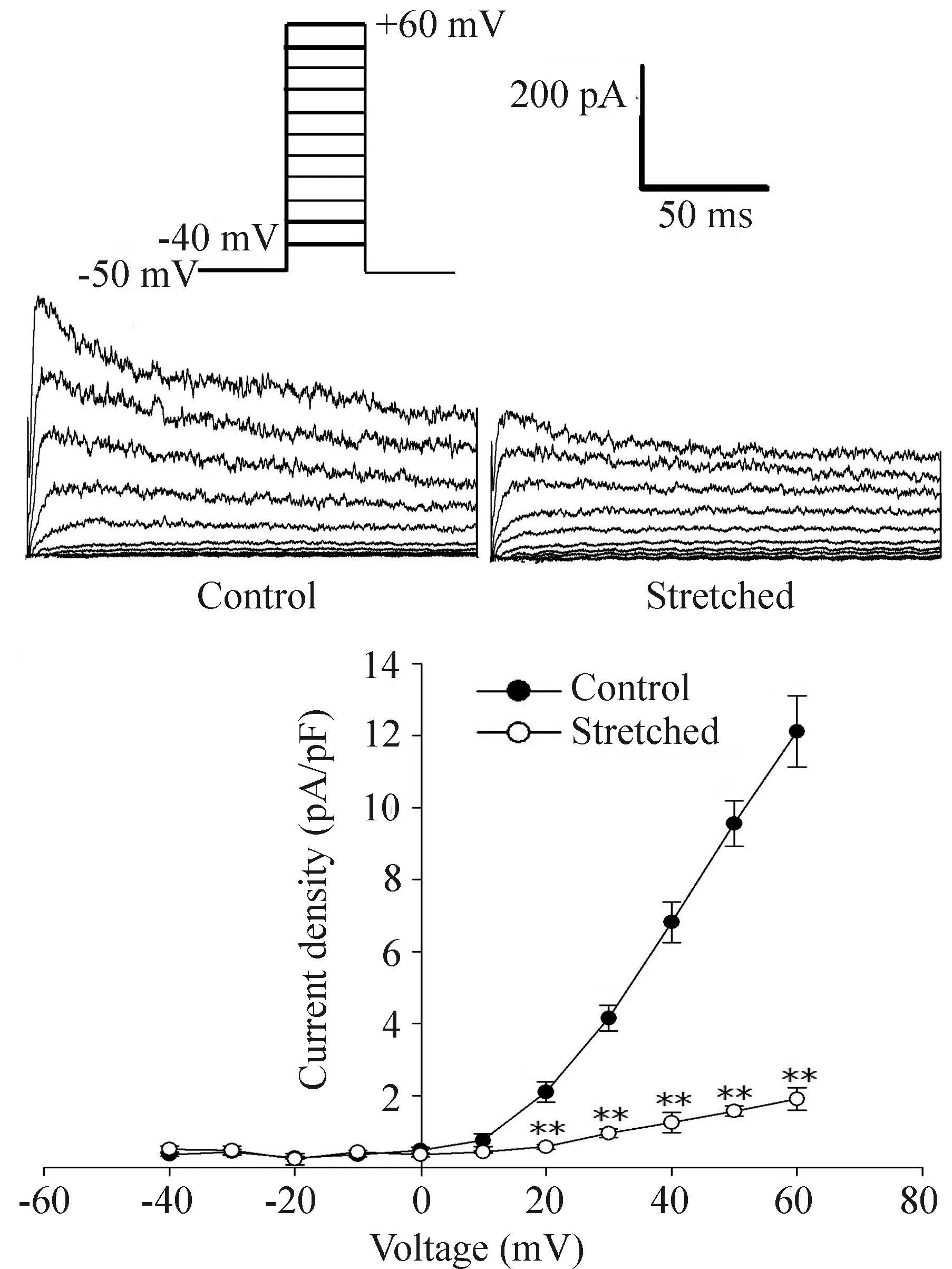
Figure 2. Current density-voltage curve of Ito in neonatal rat atrial myocytes. Mean±SD.n=9. **P<0.01 vs control group.
3 牽張刺激對乳大鼠心房肌細胞IK1的影響
在-90 mV~-120 mV鉗制電壓水平,牽張組較對照組電流密度明顯增大,在-120 mV鉗制電壓水平,IK1幅度達到最大,此電壓下對照組與牽張組平均電流密度分別為(-8.8±0.9)pA/pF和(10.8±0.8)pA/pF(P<0.01)。圖3顯示IK1的內向整流特性。
4 牽張對乳大鼠心房肌細胞AP的影響
與對照組相比,牽張組心房肌細胞RMP無明顯差異,APA降低,APD50和APD90縮短,動作電位形態變窄,見圖4、表1。
討 論
房顫病因繁多,隨著基礎疾病導致心房壓力負荷不斷增大,心房肌受到牽張刺激隨之增大。壓力負荷促使心肌肥大[6],增加基質金屬蛋白酶活性[7],離子通道相應基因的表達也發生變化,心房發生重構[6,8]。
Ito和IK1分別在AP 1期和3期復極中起著重要作用。房顫患者心房肌細胞Ito密度降低[9],IK1密度增大[10],APD縮短,這些改變正是心房重構的電生理特點之一,也可能是促進房顫發生和維持的機制之一[11]。本研究結果顯示,牽張組心房肌細胞Ito電流密度從+20 mV開始顯著減小,且與對照組相比Ito的I-V曲線明顯下移。與王德勝等[9]對房顫患者心房肌細胞研究不同的是,Ito電流密度在+20 mV~+60 mV顯著下降,而在較低電壓下對照組和牽張組相比電流密度無顯著差異。出現上述差異可能因Ito在不同種屬表達的差異性。另外,在-120 mV鉗制電壓水平,牽張刺激促進IK1增大。
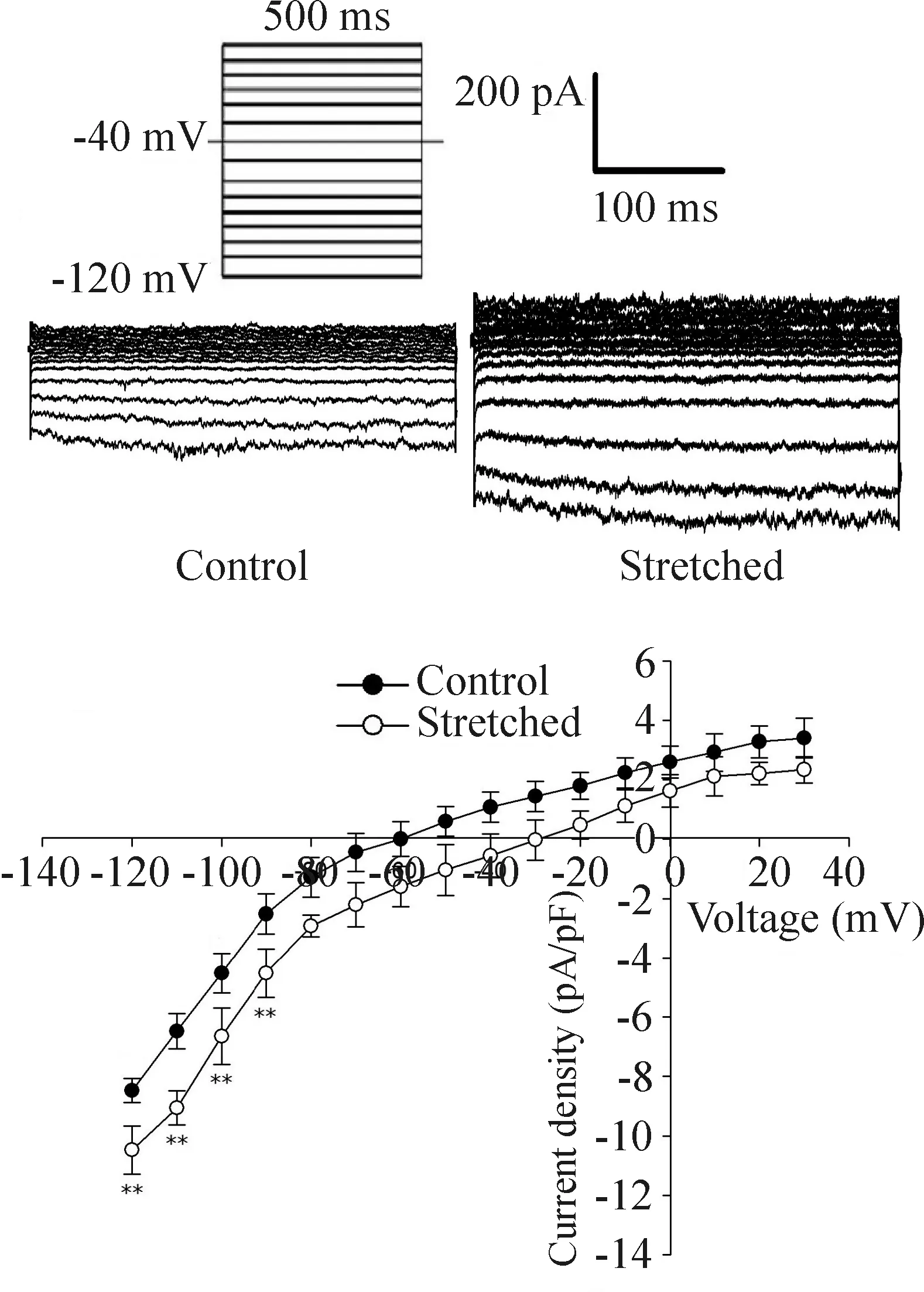
Figure 3. Current density-voltage curve of IK1 in neonatal rat atrial myocytes. Mean±SD.n=9. ** P<0.01 vs control group.
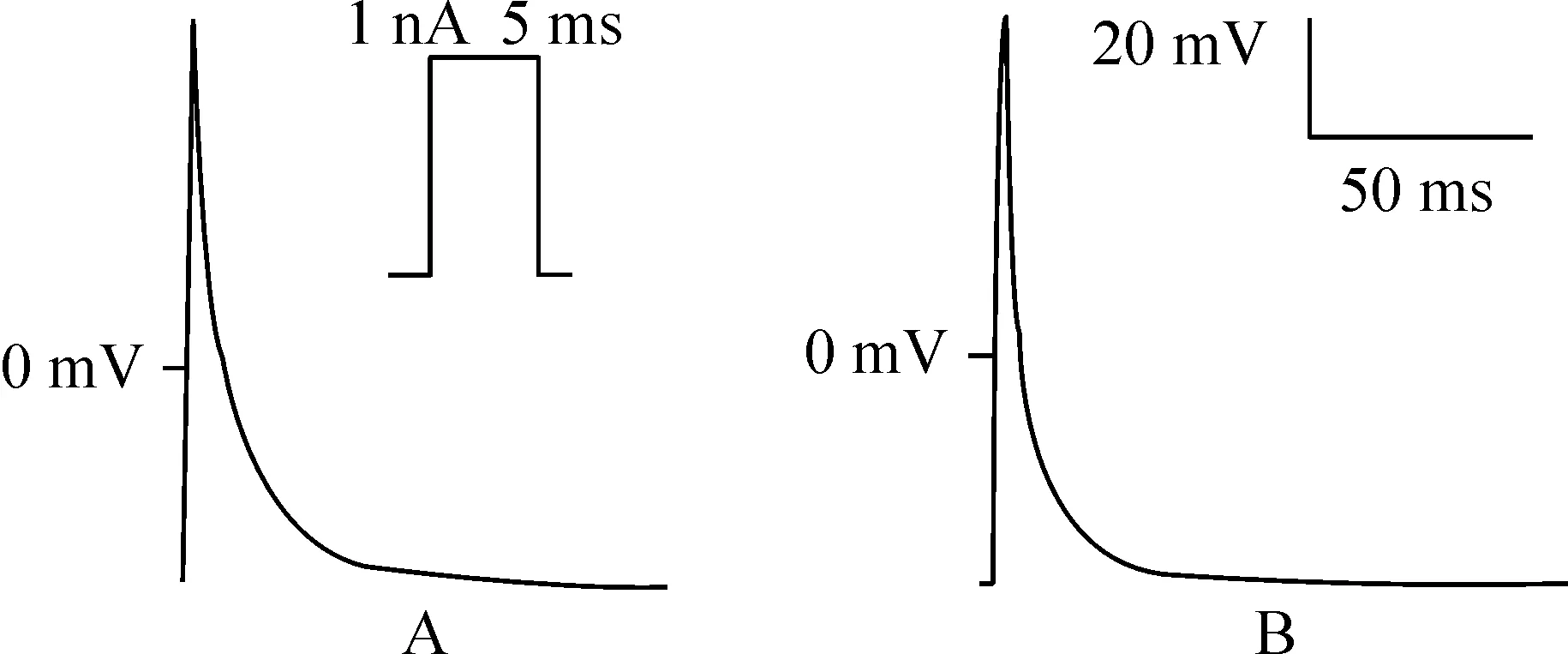
Figure 4. Action potential of neonatal rat atrial myocytes.A: a cell of control group; B: a cell of stretched group.

表1 2組動作電位相關參數比較
AP產生的原因主要是由于細胞膜兩側帶電離子的不均衡分布,以及在不同情況下細胞膜對一些離子的通透性發生改變所致。因此,AP是由多種離子通道共同參與決定。本研究結果顯示牽張組APD50和APD90明顯縮短,APA降低,證實牽張刺激促進心房肌細胞電重構。包括心房肌細胞Ito和IK1在內的多種離子通道電流發生改變,導致細胞膜離子通透性變化,影響跨膜離子流,共同導致APD縮短和APA降低。
本研究通過細胞牽張模型,模擬心房負荷過重對心房產生的機械力學作用,反映心房負荷增加對細胞離子通道的影響,為心房電重構和房顫疾病發生機制提供一定的基礎研究依據。
[參 考 文 獻]
[1] Heeringa J, van der Kuip DA, Hofman A, et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study[J]. Eur Heart J, 2006, 27(8):949-953.
[2] Kim SJ, Choisy SC, Barman P, et al. Atrial remodeling and the substrate for atrial fibrillation in rat hearts with elevated afterload[J]. Circ Arrhythm Electrophysiol, 2011, 4(5):761-769.
[3] 鄧春玉, 唐承靜, 鄺素娟, 等. 燈盞花素對大鼠心室肌細胞瞬間外向和內向整流鉀電流的影響[J]. 中國病理生理雜志, 2008, 24(1):84-88.
[4] 羅 淋, 劉志琴, 楊 龍, 等. 大鼠乳鼠原代心房肌細胞培養的方法及鑒定[J]. 國際心血管病雜志, 2013, 40(2):112-115.
[5] 楊 龍, 何炯紅, 袁正強, 等. 替米沙坦抑制鈣調神經磷酸酶調控牽張刺激誘導乳鼠心房肌細胞Cav1.2 mRNA的表達[J]. 貴州醫藥, 2011, 35(9):771-775.
[6] Saygili E, Rana OR, Saygili E, et al. Losartan prevents stretch-induced electrical remodeling in cultured atrial neonatal myocytes[J]. Am J Physiol Heart Circ Physiol, 2007, 292(6):H2898-H2905.
[7] Saygili E, Rana OR, Meyer C, et al. The angiotensin-calcineurin-NFAT pathway mediates stretch-induced up-regulation of matrix metalloproteinases-2/-9 in atrial myocytes[J]. Basic Res Cardiol, 2009, 104(4):435-448.
[8] De Jong AM, Maass AH, Oberdorf-Maass SU, et al. Cyclical stretch induces structural changes in atrial myocytes[J]. J Cell Mol Med, 2013, 17(6):743-753.
[9] 王德勝, 黃從新, 鄭 文, 等. 心房顫動心房肌細胞短暫外向鉀電流的特點[J]. 中國心臟起搏與心電生理雜志, 2001, 1(52):89-91.
[10] 薛玉梅, 吳書林, 鄧春玉, 等. 心房顫動患者內向整流性鉀電流及Kir2.1 mRNA表達水平的研究[J]. 中國病理生理雜志, 2005, 21(4):707-710.
[11] Wijffels MC, Kirchhof CJ, Dorland R, et al. Atrial fibrillation begets atrial fibrillation: a study in awake chronically instrumented goats[J]. Circulation, 1995, 92(7):1954-1968.

