白藜蘆醇通過PI3K/Akt通路及線粒體途徑抑制軟骨肉瘤*
金海東, 戴 兵, 蔡建武, 陳 輝, 范時洋, 潘 駿
(溫州醫科大學附屬第二醫院創傷骨科,浙江 溫州 325000)
軟骨肉瘤(chondrosarcoma)是常見的原發惡性骨腫瘤,好發于長管狀骨及髂骨,晚期可以發生肺轉移,在骨腫瘤中,其發病率僅次于骨肉瘤。隨著醫療技術迅速發展,近年來惡性骨腫瘤的診斷和治療有了很大的進步,患者治療后的長期生存率也有了明顯提高,但是軟骨肉瘤的治療依然是一個挑戰,特別是對于微小病灶,手術不能切除病灶,或者對放化療不敏感或耐藥時。因此,尋找敏感高效低毒的抗腫瘤藥物是治療軟骨肉瘤的迫切問題。白藜蘆醇(resveratrol,Res)作為一種天然的藥物,屬于非黃酮類多酚化合物,具有多種生物學活性如抗氧化、抗炎、抗血小板聚集、抗動脈粥樣硬化、調控細胞凋亡、雌激素調節、免疫調節及抗腫瘤等活性[1]。研究證明白藜蘆醇對多種腫瘤包括肺癌細胞、胃癌細胞、胰腺癌細胞、肝癌細胞、前列腺癌細胞和白血病細胞等均有一定抗癌性[2-4]。鑒于PI3K/Akt信號通路在腫瘤的發生發展過程中起重要作用,而國內外鮮有文獻報道白藜蘆醇對軟骨肉瘤的影響,本研究以軟骨肉瘤SW1353細胞為研究對象,采用白藜蘆醇處理腫瘤細胞后,觀察其對腫瘤細胞的增殖、凋亡及PI3K/Akt信號通路的影響,探討白藜蘆醇防治軟骨肉瘤的可能機制。
材 料 和 方 法
1 細胞和試劑
軟骨肉瘤SW1353細胞購自中國科學院上海生命科學研究院細胞庫。白藜蘆醇和Hoechst 33258購自Sigma-Aldrich;抗Bcl-2、Bax、Akt和p-Akt的抗體購自Cell Signaling Technology;抗activated caspase-3的抗體購自Bioworld;CCK8試劑購自碧云天生物技術研究所。
2 方法
2.1細胞培養 將SW1353細胞接種于含10% 胎牛血清、青霉素和鏈霉素的DMEM/F12培養基中,置于37 ℃、5% CO2培養箱中常規培養,細胞貼壁生長,每3 d傳代。用含EDTA胰蛋白酶消化,收集對數生長期細胞進行實驗。
2.2倒置顯微鏡觀察細胞形態 將細胞以1×106的密度接種在60 mm的培養板,分加藥組(100 μmol/L)和對照組,藥物處理24 h后在倒置顯微鏡下觀察細胞形態。
2.3CCK8法測定細胞活性和增殖 實驗分空白組、對照組(不加藥)和藥物組(25 μmol/L 組、50 μmol/L組和100 μmol/L 組),各組細胞均在37 ℃共同孵育24 h和48 h,按照試劑盒說明書,每孔加CCK-8溶液10 μL,繼續37 ℃溫育1 h后,酶標儀測定450 nm波長處各孔的吸光度(A),計算細胞活力(%)=(A加藥組-A空白組)/(A對照組-A空白組)×100%。
2.4Hoechst 33258染色觀察細胞凋亡 調整細胞密度為1×108/L接種于6孔板內的任意4個孔,每孔500 μL,置于37 ℃、5% CO2培養箱中培養24 h后,PBS洗滌2遍,每孔加入Hoechst 33258染色液染色20~30 min,PBS洗滌3次,熒光顯微鏡觀察凋亡細胞的形態。
2.5Western blotting檢測 用RIPA細胞裂解液和超聲裂解細胞,4 ℃、12 000×g離心20 min 后收集總蛋白,并計算出上樣體積。變性后SDS聚丙烯酰胺凝膠垂直電泳,電轉膜,5%脫脂奶粉封閉,TBST洗膜,然后加入抗activated caspase-3、Bcl-2、Bax、Akt和p-Akt抗體(1∶1 000)4 ℃孵育過夜,TBST洗膜后加入辣根過氧化酶標記的IgG Ⅱ抗(1∶5 000)室溫孵育2 h,應用超敏ECL化學發光試劑盒曝光,以β-actin蛋白作為內參照。在凝膠成像儀下曝光,用Image Lab軟件分析。
2.6細胞劃痕實驗 6孔板每孔加入約5×105個細胞,次日用槍頭每隔0.5~1 cm垂直劃線,PBS洗細胞3次,去除劃下的細胞,加入無血清培養基。培養箱培養24 h取樣,拍照。
3 統計學處理
采用SPSS 19統計軟件處理。數據以均數±標準差(mean±SD)表示,組間均數比較采用方差分析,以P<0.05為差異有統計學意義。
結 果
1 白藜蘆醇對SW1353細胞形態的影響
100 μmol/L白藜蘆醇處理軟骨肉瘤SW1353后,顯微鏡觀察可見細胞與細胞分離,三角形形態雜亂無規律,而對照組瘤細胞則呈密集規律三角形排列,見圖1。

Figure 1. The effect of resveratrol (Res) on the morphological of SW1353 cells (×100). SW1353 cells were treated with 100 μmol/L Res for 24 h and the morphological changes were observed under microscope. A: control; B: 100 μmol/L Res.
2 白藜蘆醇抑制軟骨肉瘤細胞的活力
隨著作用時間增加,白藜蘆醇對細胞活力的抑制作用增大,反映出對SW1353細胞增殖的抑制作用增強。不同劑量的白藜蘆醇處理細胞后均出現細胞活力的下降,見圖2。25、50和100 μmol/L Res作用24 h,其細胞活性分別為0.5789±0.1379、0.5287±0.0842和0.4944±0.0819(P<0.01)作用48 h后,其活性分別為0.3750±0.1006、0.3947±0.0587和0.3126±0.0571(P<0.01)。24 h與48 h比較差異有統計學意義(P<0.05)。
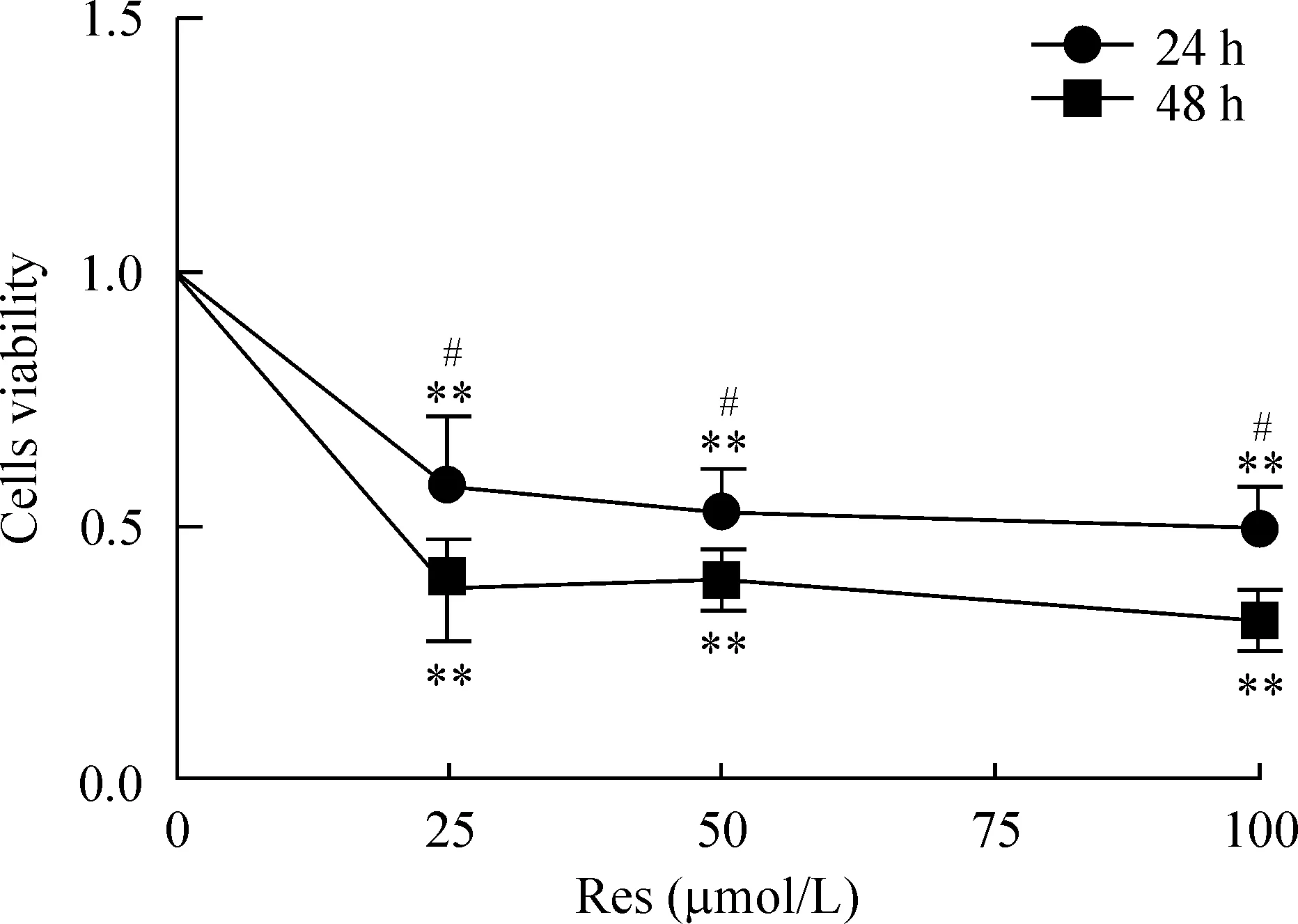
Figure 2. The effect of resveratrol (Res) on the viability of SW1353 cells. Mean±SD. n=6.**P<0.01 vs untreated cells (not shown); #P<0.05 vs 24 h.
3 Hoechst 33258染色觀察細胞凋亡的情況
Hoechst 33258染色后凋亡的細胞出現核皺縮,熒光染料濃聚,呈亮藍色,或呈致密濃染核碎裂,圖3染色可見25、50和100 μmol/L白藜蘆醇組細胞凋亡多于未加藥的對照組。
4 白藜蘆醇作用于線粒體途徑促進細胞凋亡
25、50和100 μmol/L Res作用軟骨肉瘤SW1353細胞24 h、48 h和72 h,Western blotting檢測線粒體途徑的凋亡蛋白表達情況,與對照組相比,加藥組的activated caspase-3和Bax蛋白表達上調,而Bcl-2蛋白表達下調。100 μmol/L Res作用后activated caspase-3和Bax蛋白表達最高, Bcl-2表達最低。而24 h、48 h和72 h組間差異不明顯,但與 0 h相比較,activated caspase-3和Bax蛋白表達增加, Bcl-2蛋白表達下降,見圖4。
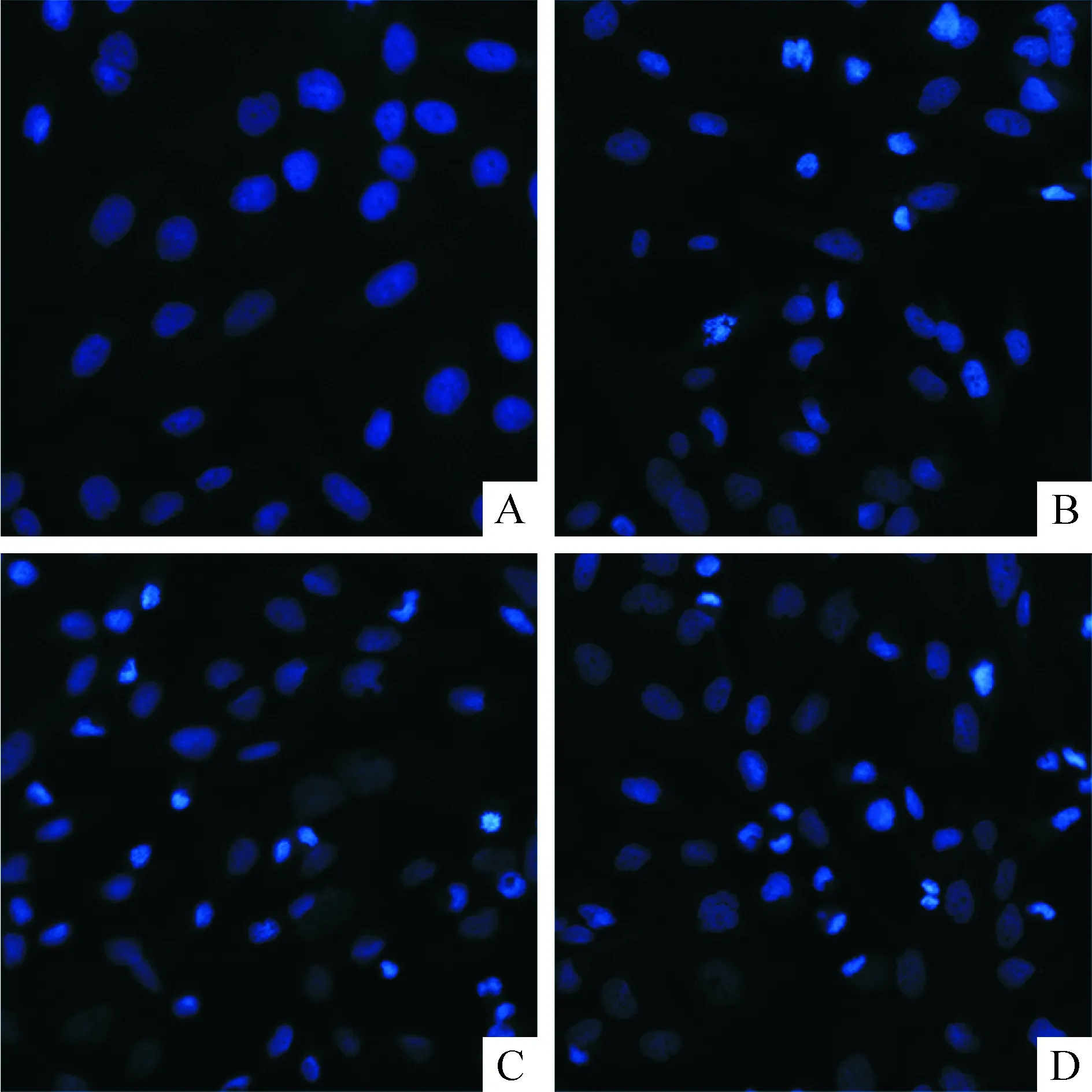
Figure 3. The apoptosis of SW1353 cells determined by Hoechst 33258 staining after resveratrol (Res) treatment (×200). A: control; B~D: 25, 50 and 100 μmol/L Res.
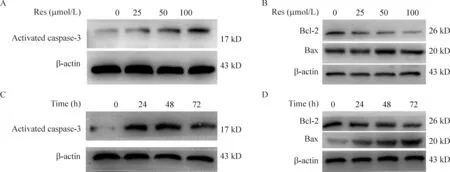
Figure 4. The effect of resveratrol (Res) on related mitochondrial protein expression in SW1353 cells. A,B: the protein levels of activated caspase-3, Bcl-2, Bax in the cells treated with different concentrations of Res; C, D: the protein levels of actived-caspase-3, Bcl-2, Bax in the cells exposed to 50 μmol/L Res in different time points.
5 白藜蘆醇抑制PI3K/Akt信號通路
25、50和100 μmol/L Res作用軟骨肉瘤SW1353細胞24 h、48 h和72 h,Western blotting結果顯示(圖5),p-Akt蛋白隨著時間延長,表達呈減弱趨勢,72 h其表達最弱。不同濃度的藥物處理,p-Akt也出現不同程度的降低(100 μmol/L組最弱),但是總Akt蛋白表達在時間和劑量因素改變下均未見明顯的變化。
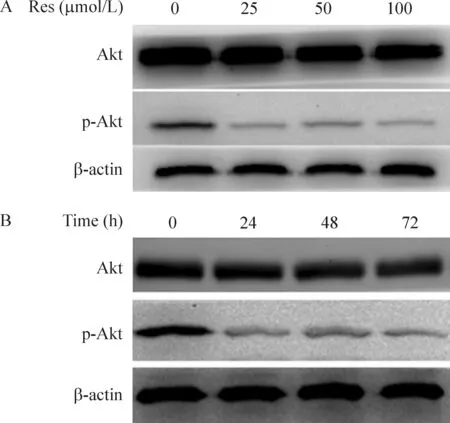
Figure 5. The effect of resveratrol (Res) on PI3K/Akt signaling pathway in SW1353 cells. A: the protein levels of Akt and p-Akt in the cells treated with different concentrations of Res; B: the protein levels of Akt and p-Akt in the cells exposed to 50 μmol/L Res in different time points.
6 白藜蘆醇能抑制軟骨肉瘤SW1353細胞的遷移
0、50和100 μmol/L Res處理肉瘤細胞,圖6可見藥物處理后劃痕區域細胞少見,而對照組可見許多細胞遷移到劃痕區域。0、50和100 μmol/L Res 作用24 h后其相關的劃痕寬度比率分別為0.8390±0.1151、0.9640±0.0816和1.0525±0.0919(P<0.01),而48 h后其劃痕寬度比率分別為0.7890±0.1678、0.9404±0.1153和1.0317±0.1018。
討 論
白藜蘆醇最早是在1940年從毛葉黎蘆根部獲得的[6],現在從葡萄、花生、決明和虎杖中均能提取到白藜蘆醇[7],其中新鮮的葡萄皮中含量最高,約達50~100 mg/g。從白藜蘆醇發現至今,其在腫瘤領域研究較多,研究發現白藜蘆醇能夠誘導包括肺癌細胞、胃癌細胞、骨肉瘤細胞、肝癌細胞和白血病細胞等[2-5]癌細胞凋亡、抑制其增殖和轉移,起到抗腫瘤作用,但是其抗腫瘤的作用機制有不同程度的差異。
國內外很多學者研究證實白藜蘆醇能抑制腫瘤細胞的增殖,如Li等[8]用白藜蘆醇處理肝癌細胞,能抑制高糖環境下腫瘤的增殖;Bhardwaj等[9]將白藜蘆醇處理多發性骨髓瘤細胞,發現能抑制其增殖,下調Bcl-2、上調Bax,激活caspase-3誘導凋亡。由于國內外無文獻報道白藜蘆醇對軟骨肉瘤的影響,因此本研究用不同濃度的白藜蘆醇處理軟骨肉瘤細胞12 h、24 h和48 h,發現能抑制軟骨肉瘤細胞的增殖,同時發現activated caspase-3蛋白(17 kD)的表達增強。Activated caspase-3蛋白是procaspase-3在凋亡發生時裂解的2個小片段(17 和19 kD)。同時還發現凋亡的相關蛋白Bcl-2表達下降,Bax的表達增強。這些結果均與白藜蘆醇對其它腫瘤的抑制效果相似。我們認為白藜蘆醇能夠誘導軟骨肉瘤細胞的凋亡。Bcl-2和Bax是線粒體調節凋亡的重要分子,外界刺激因素使線粒體的通透性改變,引起細胞色素C等小分子的釋放,Bcl-2、Bcl-xL等下調,Bax上調,進而使caspase家族出現級聯反應,導致細胞凋亡[10-11]。上述研究結果表明白藜蘆醇誘導軟骨肉瘤細胞的凋亡是通過線粒體途徑發揮作用的。
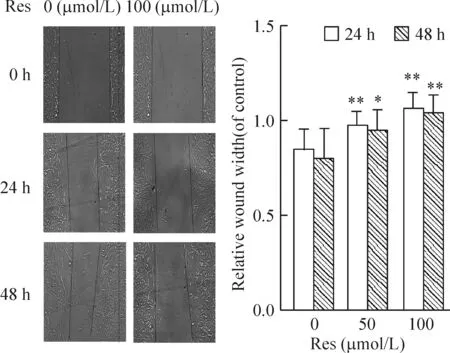
Figure 6. The cell migration determined by wound scratch assay (×100). Mean±SD. n=6.*P<0.05,**P<0.01 vs 0 μmol/L.
在信號通路研究領域,已經證實人類多種腫瘤如乳腺癌、非小細胞肺癌和胃癌等中,PI3K和Akt的過表達和異常激活參與腫瘤的發生發展[12-14],PI3K/Akt信號通路在腫瘤發生發展中扮演著重要角色。PI3K存在于細胞周期延續、細胞分化、生存、侵入及擴散,它的生物活性是通過調節下游靶分子Akt而體現出來的。Akt 的磷酸化水平可以作為衡量PI3K活性的指標,同時反映PI3K信號通路的活性。從本研究的結果(圖5)我們看到不同濃度的白藜蘆醇能夠使Akt的磷酸化顯著降低,而總Akt未見明顯改變,可見白藜蘆醇抑制軟骨肉瘤作用,部分是通過抑制PI3K/Akt信號通路發揮效應。同時Akt信號通路又能影響其下游線粒體途徑中Bcl-2和Bax的表達,表明PI3K/Akt信號通路和線粒體途徑存在相互作用,共同促進軟骨肉瘤細胞凋亡,抑制瘤細胞的增殖和生長。
綜上所述,白藜蘆醇誘導軟骨肉瘤細胞的凋亡,抑制其增殖,部分是通過PI3K/Akt通路及線粒體途徑,但其通路中的上下游分子參與凋亡調控或是否還影響其它通路途徑,尚需進一步研究證實。目前認為白藜蘆醇能激活Sirt1[15],但是其促進凋亡、影響這兩條途徑是否與Sirt1有關聯?尚需更加深入探索。另外我們證實了白藜蘆醇能夠抑制瘤細胞的遷移(圖6),具體機制有待進一步的深入研究。
[參 考 文 獻]
[1] de la Lastra CA, Villegas I. Resveratrol as an antioxidant and pro-oxidant agent: mechanisms and clinical implications[J]. Biochem Soc Trans, 2007, 35(Pt 5): 1156-1160.
[2] Gusman J, Malonne H, Atassi G, et al. A reappraisal of the potential chemopreventive and chemotherapeutic properties of resveratrol[J]. Carcinogenesis, 2001, 22(8):1111-1117.
[3] Cal C, Garban H, Jazirehi A, et al. Resveratrol and cancer: chemoprevention, apoptosis, and chemoimmunosensitizing activities[J]. Curr Med Chem Anti-Cancer Agents, 2003, 3(2):77-93.
[4] Whitlock NC, Baek SJ. The anticancer effects of resveratrol: modulation of transcription factors[J]. Nutrition Cancer, 2012, 64(4):493-502.
[5] 王海燕, 鄒正渝, 段 亮, 等. S100A6 通過 PI3K/Akt 信號通路促進人骨肉瘤細胞 143B 增殖和遷移[J]. 中國病理生理雜志, 2013, 29(11):1928-1933.
[6] Gupta SC, Kannappan R, Reuter S, et al. Chemosensitization of tumors by resveratrol[J]. Ann N Y Acad Sci, 2011, 1215:150-160.
[7] 趙克森. 白藜蘆醇的生物學特性和效應[J]. 中國病理生理雜志, 2012, 28(9): 1709-1711.
[8] Li Y, Zhu W, Li J, et al. Resveratrol suppresses the STAT3 signaling pathway and inhibits proliferation of high glucose-exposed HepG2 cells partly through SIRT1[J]. Oncol Reports, 2013, 30(6):2820-2828.
[9] Bhardwaj A, Sethi G, Vadhan-Raj S, et al. Resveratrol inhibits proliferation, induces apoptosis, and overcomes chemoresistance through down-regulation of STAT3 and nuclear factor-κB-regulated antiapoptotic and cell survival gene products in human multiple myeloma cells[J]. Blood, 2007, 109(6):2293-2302.
[10] D?rrie J, Gerauer H, Wachter Y, et al. Resveratrol induces extensive apoptosis by depolarizing mitochondrial membranes and activating caspase-9 in acute lymphoblastic leukemia cells[J]. Cancer Res, 2001, 61(12):4731-4739.
[11] Pozo-Guisado E, Merino JM, Mulero-Navarro S, et al. Resveratrol-induced apoptosis in MCF-7 human breast cancer cells involves a caspase-independent mechanism with downregulation of Bcl-2 and NF-κB[J]. Int J Cancer, 2005, 115(1):74-84.
[12] Almhanna K, Strosberg J, Malafa M, et al. Targeting Akt protein kinase in gastric cancer[J]. Anticancer Res, 2011, 31(12):4387-4392.
[13] Riggio M, Polo ML, Blaustein M, et al. PI3K/Akt pathway regulates phosphorylation of steroid receptors, hormone independence and tumor differentiation in breast cancer[J]. Carcinogenesis, 2012, 33(3):509-518.
[14] Papadimitrakopoulou V. Development of PI3K/Akt/mTOR pathway inhibitors and their application in personalized therapy for non-small-cell lung cancer[J]. J Thoracic Oncol, 2012, 7(8):1315-1326.
[15] Villalba JM, Francisco J. Sirtuin activators and inhibitors[J]. Biofactors, 2012, 38(5):349-359.

