季節(jié)和地理差異對天然黃檗小檗堿和藥根堿含量的影響
徐麗嬌,邱婧珺,孫銘隆,張玉紅, 夏春梅,周志強,*
(1. 東北林業(yè)大學(xué)森林植物生態(tài)學(xué)教育部重點實驗室, 哈爾濱 150040; 2. 東北林業(yè)大學(xué)林學(xué)院, 哈爾濱 150040)
季節(jié)和地理差異對天然黃檗小檗堿和藥根堿含量的影響
徐麗嬌1,邱婧珺1,孫銘隆1,張玉紅1, 夏春梅2,周志強1,*
(1. 東北林業(yè)大學(xué)森林植物生態(tài)學(xué)教育部重點實驗室, 哈爾濱 150040; 2. 東北林業(yè)大學(xué)林學(xué)院, 哈爾濱 150040)
用高效液相色譜法測定了黃檗根皮、莖皮、多年生枝皮、1年生枝和葉片中小檗堿和藥根堿的含量,研究黃檗不同部位兩種生物堿的季節(jié)和地理差異。結(jié)果表明:不同季節(jié),天然黃檗各部位的小檗堿、 藥根堿含量均表現(xiàn)為:根皮>莖皮>多年生枝皮>1年生枝>葉片。小檗堿含量隨著季節(jié)變化在各部位呈現(xiàn)夏季升高,到秋季下降的趨勢。而藥根堿在不同部位中的含量隨著季節(jié)變化的規(guī)律不同。根皮、莖皮中的藥根堿含量隨著季節(jié)推移逐漸增多,在夏季升高不明顯,而到秋季大量積累。多年生枝皮、1年生枝、葉片中的藥根堿在3個季節(jié)表現(xiàn)則為先降后升。從緯度水平上看,不同地域間黃檗各部位的生物堿差異顯著,在調(diào)查的40°—50°N范圍內(nèi),黃檗兩種生物堿的含量普遍在緯度低的地區(qū)較高, 隨著緯度增大先逐漸降低,到N44°左右達到最低值,到了高緯度地區(qū)略有回升。
黃檗; 小檗堿; 藥根堿; 不同部位; 季節(jié)差異; 緯度差異
黃檗(Phellodendronamurense)又名黃菠蘿,為蕓香科黃檗屬闊葉喬木[1- 3],中國特有種。 黃檗是著名中藥“關(guān)黃柏”的藥源植物,關(guān)黃柏的主要化學(xué)成分為小檗堿(Berberine),藥根堿(Jatrorrhizine) 等[4],具有獨特的抗真菌作用[5- 7]。近年來,隨著天然藥物開發(fā)的日漸興起,天然黃檗資源日漸匱乏。據(jù)統(tǒng)計,2010年黃檗的國內(nèi)年藥材需求量超過2000 t,且未來3a每年有近400 t的需求增長[8]。巨大的市場需求、無序采挖而導(dǎo)致的可用自然資源銳減,已給黃檗的資源保護和持續(xù)利用帶來了沉重壓力,資源保護與利用的矛盾非常突出。1989年出版的《中國珍稀瀕危植物》和1990年出版的《中國植物紅皮書》都把黃檗列入其中[9- 10]。1999年國務(wù)院公布的國家重點保護野生植物名錄,將黃檗列為國家II級重點保護的野生瀕危植物。
黃檗天然種群主要分布于中國東北大興安嶺東南部、小興安嶺、長白山、完達山、千山及華北地區(qū)燕山山脈以北等地,地理位置在北緯52°—39°,海拔300—1200 m[11- 12]。黃檗在中國東北的天然分布區(qū)超過261.64×104hm2[13], 在這樣廣闊的分布區(qū)和豐富多樣的生境條件下,天然黃檗的有效成分很可能由于環(huán)境因子變化而產(chǎn)生明顯差異。同時,由于植物的次生代謝產(chǎn)物在自然狀態(tài)下含量低,如何提高植物次生代謝產(chǎn)物的產(chǎn)量是關(guān)系到天然藥物的開發(fā)能否應(yīng)用于實際生產(chǎn)的關(guān)鍵環(huán)節(jié)。目前, 僅有一些黃檗的研究涉及到林學(xué)基礎(chǔ),其他的少量研究關(guān)于病蟲害以及蝶類的化學(xué)生態(tài)方面,更多的研究工作則集中在黃檗植物化學(xué)(生物堿等)與藥理學(xué)方面,對于不同地理位置分布下黃檗天然種群生物堿含量的差異研究較少。本文以東三省10個采樣點312樣株的數(shù)據(jù)為依據(jù),試圖揭示天然黃檗的小檗堿,藥根堿含量受不同部位、不同季節(jié)和不同緯度的影響以及植物次生代謝物適應(yīng)不同生境的生態(tài)學(xué)意義,同時也為高效、可持續(xù)利用天然黃檗資源提供科學(xué)依據(jù)。
1 材料與方法
1.1 采樣地概況及樣本處理
針對黃檗的分布狀況,選取黃檗集中分布的中國東北三省地區(qū)(黑龍江,吉林,遼寧),按照緯度梯度(緯度梯度基數(shù))選取了10個采樣點。北至北緯49°51′19.7″(黑河),南至40°32′39.11″(鳳城)。經(jīng)度范圍從E123°30′34.00″(法庫)至E130°11′11.0″(穆棱),該區(qū)域?qū)儆诤畮Т箨懶约撅L(fēng)氣候,年均溫0.97—6.28°,降雨量524.34—775.17 mm,涵蓋了黃檗的主要分布區(qū)。采樣時間為2011年5月—2011年10月,采用典型取樣法。每個采樣地選取胸徑為10—40 cm的黃檗,依據(jù)采集的年輪芯數(shù)據(jù),做出了每個采樣地點的胸徑-年齡曲線。篩選年齡為20—30a間的樣樹,分別取每株樣樹根皮,1.3 m處莖皮,多年生枝皮,1、2年生枝,葉片5處器官作為研究樣本。全部樣本在60℃[14]烘至恒重,密封保存。
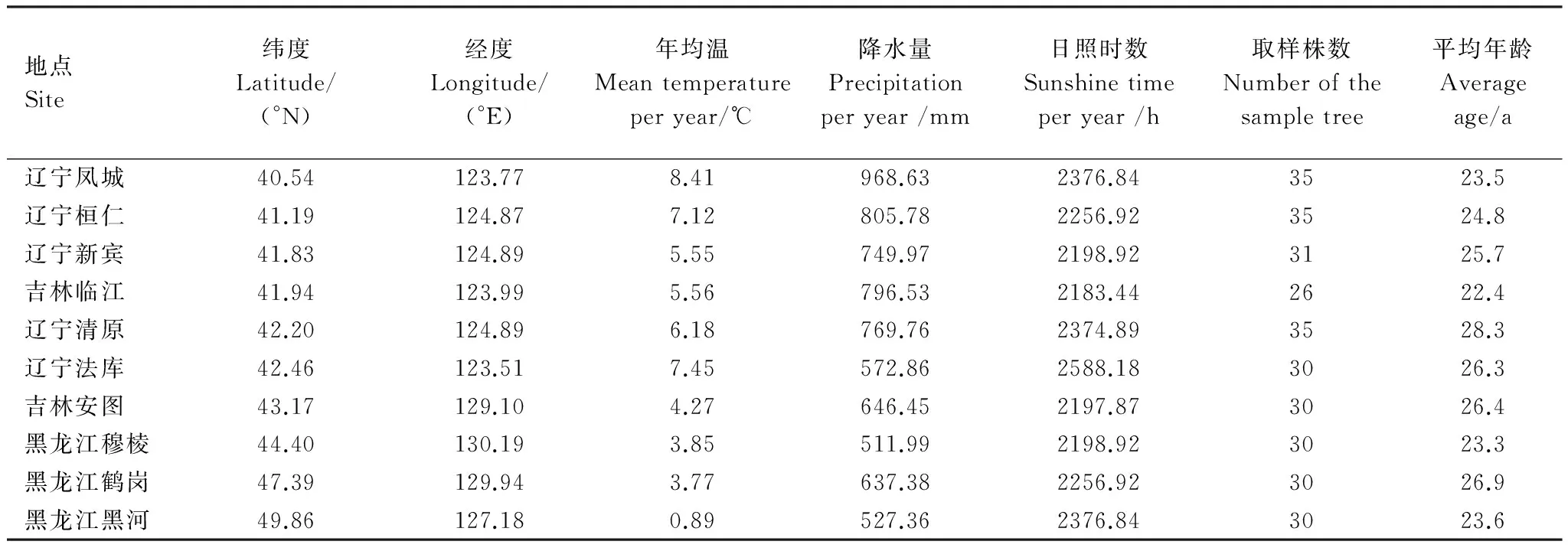
表1 采樣地信息
1.2 實驗儀器與藥品
小檗堿標(biāo)準品購于中國藥品生物制品檢定所。高效液相色譜儀(Waters 2996 自動進樣器、2487 紫外檢測器、KYA HIQ sil C18 柱(250 mm ×4.6 mm,5 μm)。高速離心機(德國Heraeus 22RBiofuge、電子天平(瑞士AB104型)。超聲波儀(江蘇昆山超聲儀器公司,KQ- 100DB)。色譜純乙腈(美國TEDIA 公司),水(超純水),無水乙醇(色譜純),磷酸二氫鉀、十二烷基磺酸鈉(分析純,北京化學(xué)試劑公司)。
1.3 色譜條件
黃檗樣品中生物堿含量參照秦彥杰[15]的方法,略有改動。流動相為乙腈/水溶液1∶1 (1000 mL水溶液中含磷酸二氫鉀3.4 g及十二烷基磺酸鈉1.7 g),流速1.0 mL/min;檢測波長345 nm;進樣量10 μL。圖1為標(biāo)準品和樣品的保留時間。
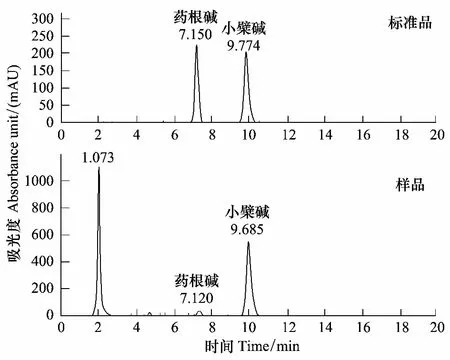
圖1 藥根堿和小檗堿的保留時間Fig.1 The retention time of berberine and jatrorrhizine
1.4 樣品溶液的制備
精密稱取樣品0.100 g,用63%的乙醇定容至5 mL,超聲3 h(溫度40℃,功率100 W),在12000 r/min條件下離心10 min,取上清液1 mL裝入進樣瓶。每個樣重復(fù)3次。
1.5 數(shù)據(jù)的采集和統(tǒng)計方法
采用SPSS 18. 0軟件對不同地點的黃檗樹根皮,莖皮,多年生枝皮,1年生枝和葉片中小檗堿、藥根堿的含量進行One-way方差分析(ANOVA)計算,差異顯著,再分別以各采樣地的地理坐標(biāo)為自變量作及回歸分析,建立方程并進行顯著性檢驗。探討各種參數(shù)對小檗堿、藥根堿含量的影響程度。
2 結(jié)果與分析
對2011年采集的東北3個省份10個地區(qū)312株黃檗不同季節(jié)根皮、莖皮、多年生枝皮、1年生枝、葉片的小檗堿和藥根堿含量進行了分析。
2.1 黃檗不同部位小檗堿含量的季節(jié)差異
如圖2所示,在春、夏、秋3個季節(jié),黃檗各部位小檗堿的含量均為:根皮>莖皮>多年生枝皮>1年生枝>葉片。根皮中的小檗堿含量最多,莖皮和多年生枝的小檗堿含量相近,而1年生枝和葉片中的小檗堿含量普遍較少。
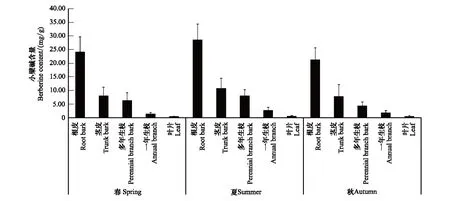
圖2 黃檗不同部位小檗堿含量Fig.2 The berberine content in the different parts of P.amurense
隨著季節(jié)變化,不同采樣地的黃檗各部位小檗堿含量也發(fā)生改變(表2)。根皮中的小檗堿含量在夏季明顯高于春季(P<0.05),到了秋季又降低到了與春季含量相近或略低的水平。莖皮中小檗堿含量的變化規(guī)律與根皮相同,夏季的含量最高,而春、秋兩季含量較低。遼寧鳳城夏季莖皮中小檗堿含量比春季增多了60.42%。3個季節(jié),多年生枝中小檗堿的含量變化明顯,夏季是小檗堿含量最高的季節(jié),春、秋兩季含量差別不大(P>0.05)。
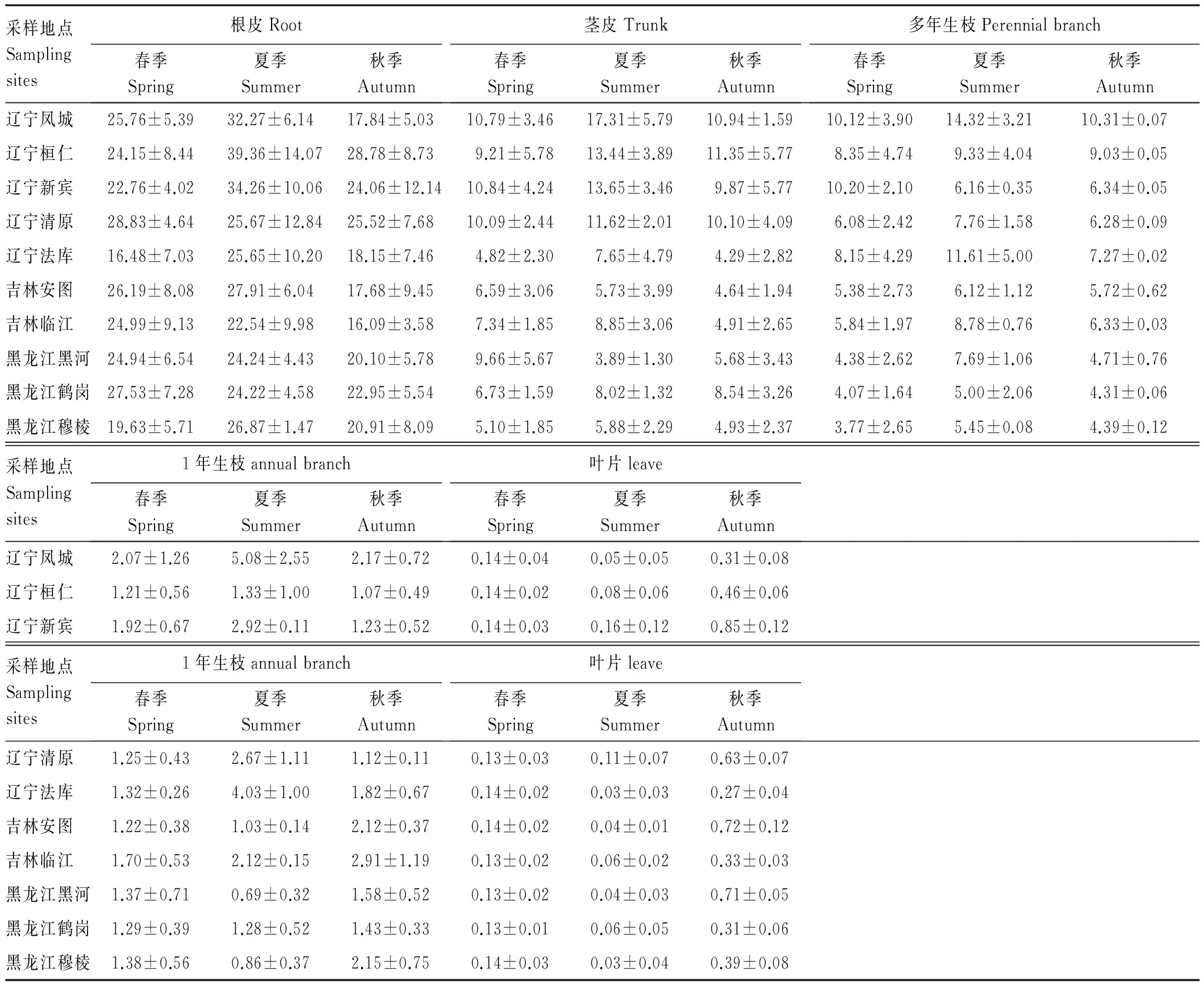
表2 黃檗不同季節(jié)小檗堿含量
2.2 黃檗不同部位藥根堿的差異
藥根堿在黃檗中含量的分布規(guī)律與小檗堿相近。不同季節(jié),天然黃檗藥根堿的含量在各部位排序為:根皮>莖皮>多年生枝皮>1年生枝>葉片(圖3)。
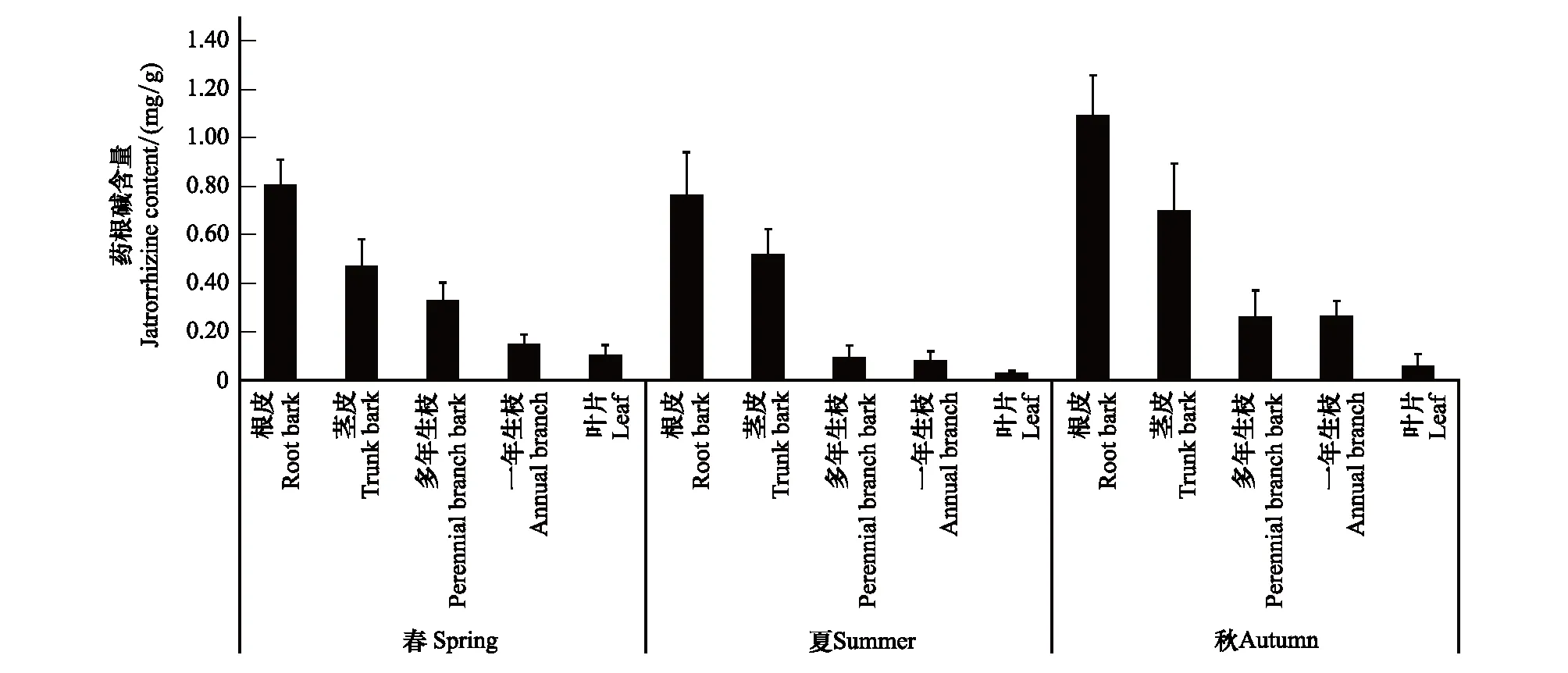
圖3 黃檗不同部位藥根堿含量Fig.3 The jatrorrhizine content in the different parts of P.amurense
對天然黃檗不同部位藥根堿含量的季節(jié)變化進行比較(表3),發(fā)現(xiàn)根皮、莖皮兩處的藥根堿含量隨著季節(jié)的推移逐漸升高。根皮中的藥根堿在夏季升高幅度不大,而在秋季顯著升高(P<0.05)。莖皮中藥根堿含量的變化規(guī)律與根皮相同,而多年生枝皮,1年生枝和葉片中的藥根堿在3個季節(jié)表現(xiàn)為先降后升。以多年生枝皮為例,夏季,藥根堿的含量比春季明顯降低(P<0.05)。春季到夏季,樹木生長旺盛,主要營養(yǎng)用于營養(yǎng)器官的生長,藥根堿緩慢消耗,而到了秋天,樹木的代謝減慢,生物堿逐漸積累在黃檗的不同部位,含量逐漸增加。
2.3 不同地域黃檗兩種生物堿含量差異
2.3.1 不同地域黃檗兩種生物堿含量的方差分析
將春、夏、秋3個季節(jié)10個地點的藥根堿、小檗堿的含量做方差分析(表4)。各地區(qū)間由于緯度變化引起的氣候條件變化,使兩種生物堿在黃檗內(nèi)含量有顯著差異(P<0.05),地域性明顯。
2.3.2 緯度對黃檗中兩種生物堿含量的影響
為了進一步探究緯度與黃檗中小檗堿、藥根堿含量的關(guān)系,用3個省份10個采樣地點黃檗根皮、莖皮、多年生枝皮、1年生枝、葉片中小檗堿、藥根堿含量與緯度分別做回歸方程,得一元二次回歸方程。由于1年生枝與葉片兩處生物堿含量的變化趨勢與緯度沒有明顯的相關(guān)性,所以只選取根皮,莖皮和多年生枝皮3個部位(P<0.05)作分析。
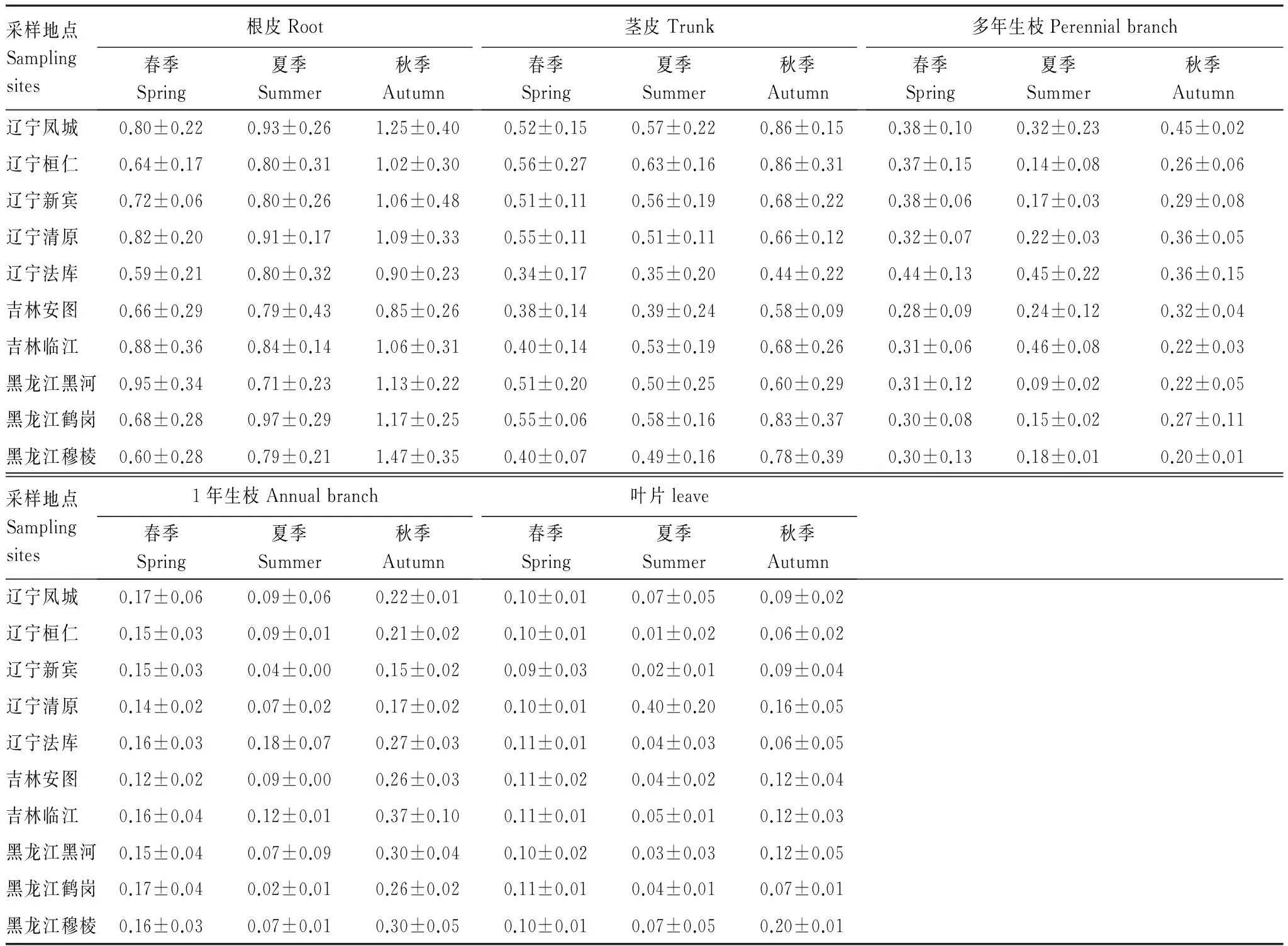
表3 黃檗不同部位藥根堿含量
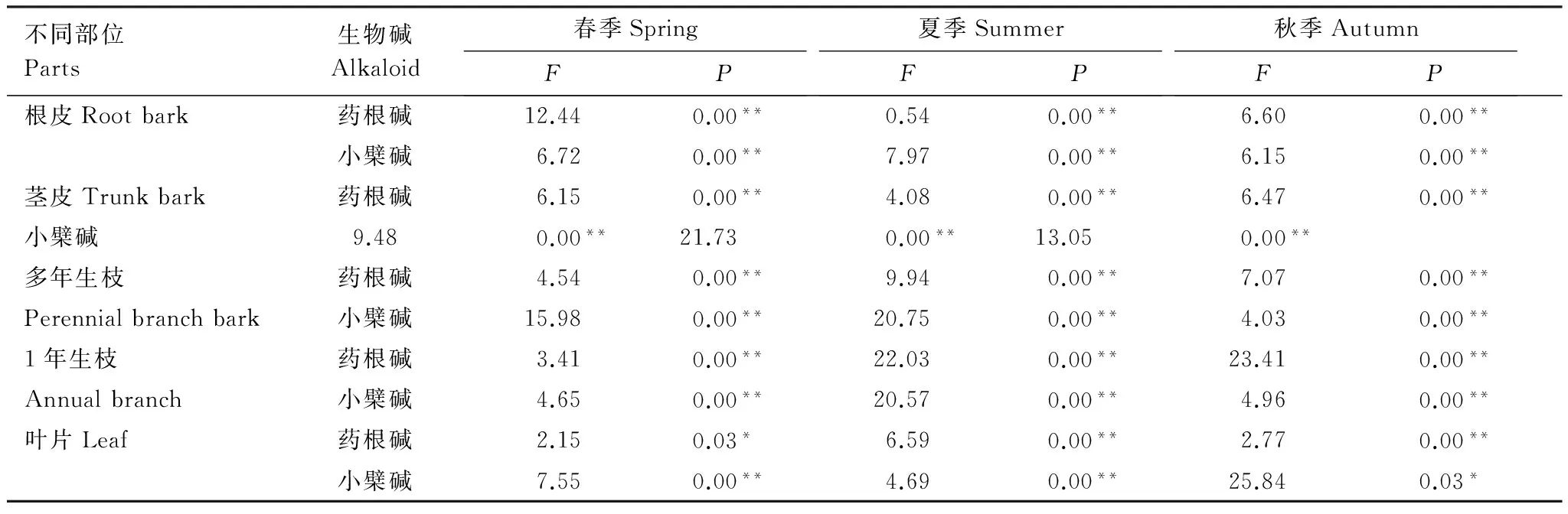
表4 不同地點黃檗各器官生物堿方差分析
*表示P<0.05, ** 表示P<0.01
(1)緯度對黃檗中小檗堿含量的影響
3個季節(jié)中,各地黃檗小檗堿的含量與緯度的回歸方程變化規(guī)律明顯(圖4)。春季,根皮、莖皮、多年生枝中小檗堿含量均隨著緯度升高呈現(xiàn)先降低,后逐漸增多的趨勢。根皮中小檗堿含量最多,隨著緯度變化規(guī)律顯著。在N40°(鳳城)根皮中小檗堿含量最高,隨著N40°—N44°小檗堿含量逐漸降低,最低值為19.62 mg/g,僅為鳳城含量的76.19%。莖皮中小檗堿含量要小于根皮,但是變化幅度很大,在N44°左右莖皮中小檗堿含量為最高值的44.69%,達到最低值后逐漸回升,N50°(黑河)地區(qū)的黃檗莖皮中小檗堿含量為N40°(鳳城)的89.51%,仍小于最大值。多年生枝皮中小檗堿含量則隨著緯度增大逐漸降低,下降幅度為62.72%,只在達到最高緯度時略有上升。
夏季黃檗各部位小檗堿的含量隨緯度的變化趨勢與春季相近,根皮與莖皮中的小檗堿含量隨著緯度的增大先逐漸降低,在N46°左右達到最低值,分別降低了47.74%和66.21%,然后略有升高。多年生枝小檗堿在采樣范圍內(nèi)隨著緯度變化呈現(xiàn)逐漸降低的趨勢,最大值分別為最小值的2.63倍。
秋季,黃檗各部位小檗堿含量均與緯度顯示了較好的相關(guān)規(guī)律。根皮、莖皮、多年生枝皮中小檗堿含量隨緯度升高先呈現(xiàn)下降趨勢,在N46°左右達到最低值,然后又逐漸升高。這3處器官中,根皮的小檗堿在含量最低處比最高處下降了36.50%。而多年生枝的小檗堿含量下降幅度最大,從N40°—N47.4°,降低了68.36%。
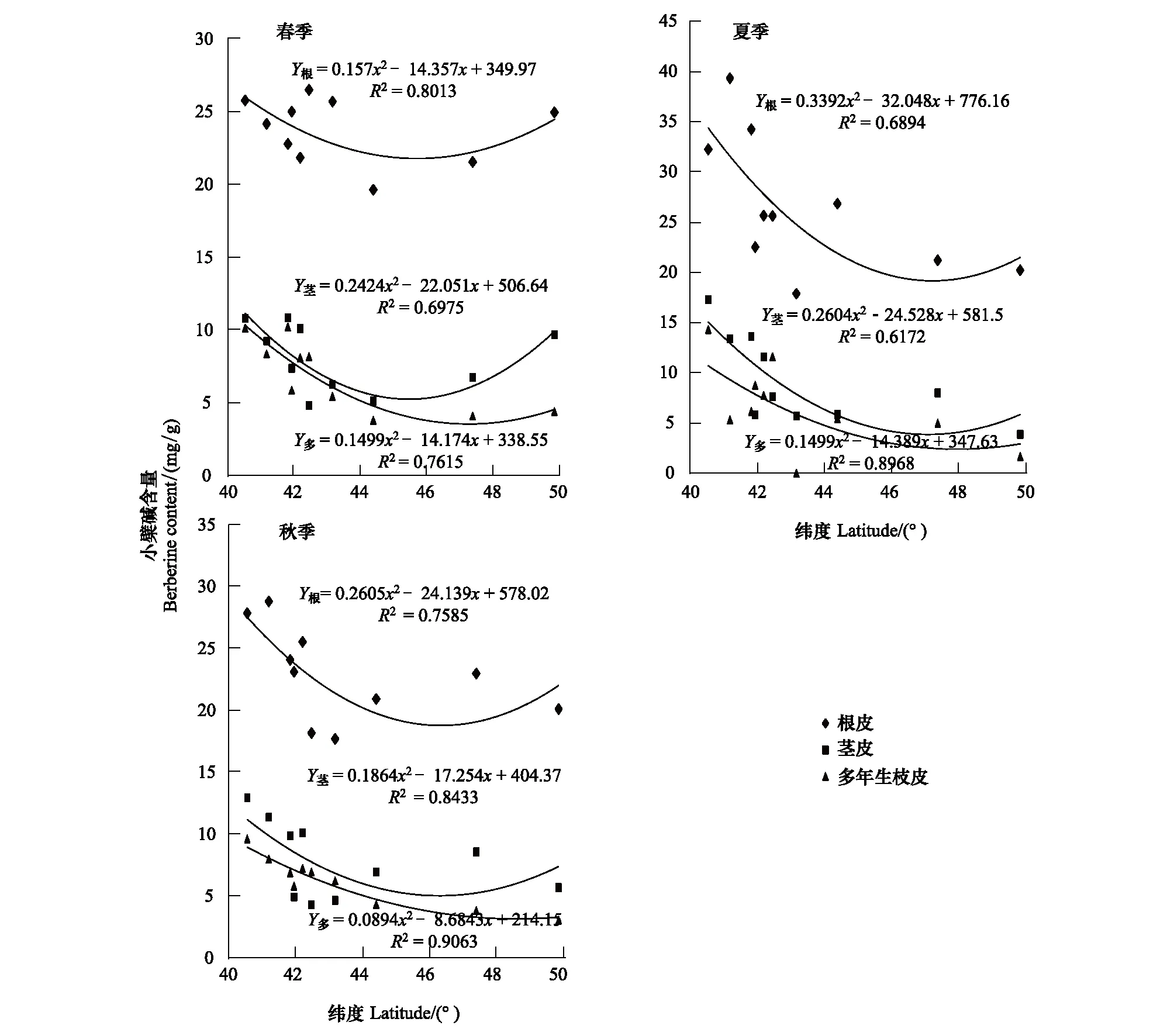
圖4 同季節(jié)小檗堿含量與緯度的回歸曲線Fig.4 Regression curve of berberine content with latitude in different seasons
(2)緯度對黃檗中藥根堿含量的影響
通過回歸方程可知(圖5),在采樣的緯度范圍內(nèi)(N40°32′39.11″—N49°51′19.7″),藥根堿在春天隨著緯度變化的趨勢明顯。根皮中的藥根堿呈現(xiàn)逐漸上升的趨勢,在N49°51′(黑河)達到最高。莖皮,多年生枝皮中藥根堿含量隨著緯度的變化規(guī)律為先降后升,莖皮與多年生枝中藥根堿含量變化小于根皮,但是均在N44°左右達到最低值,然后隨著緯度增高上升,上升幅度較小。
從黃檗各部位藥根堿夏季含量與緯度的回歸曲線看,根皮、莖皮中藥根堿含量與緯度變化呈現(xiàn)了與春季相反的趨勢。在這3處器官中隨著緯度升高,藥根堿含量先增高后小幅度降低,其中莖皮的藥根堿含量變化較小,變化幅度在0.47—0.63 mg/g之間,達到最大值后快速降低到與低緯度地區(qū)相近的水平。而多年生枝中藥根堿在N40°—N50°范圍內(nèi)逐漸降低,在采樣地的最北端降到<0.2 mg/g的水平。
秋季黃檗各部位藥根堿含量隨緯度變化的趨勢與夏季相似,根皮中藥根堿含量隨著緯度增大先降低后升高,且變化幅度大。最低值為最高值的68.11%。多年生枝皮中藥根堿隨著緯度增大則先升高,后逐漸降低。
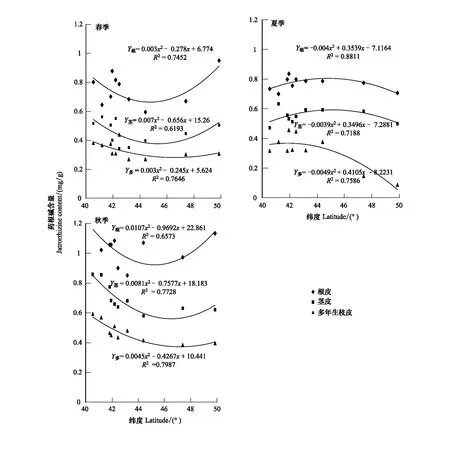
圖5 不同季節(jié)藥根堿含量與緯度的回歸曲線Fig 5 Regression curve of Jatrorrhizine content with latitude in different seasons
3 討論
本研究發(fā)現(xiàn),在春、夏、秋3個季節(jié),黃檗不同部位藥根堿和小檗堿的含量均表現(xiàn)為:根皮>莖皮>多年生枝皮>1年生枝皮>葉片。這和以往的研究得出的結(jié)論相同[16]。根皮中的生物堿含量顯著地高于其他部位,根皮、莖皮、多年生枝皮3個部位生物堿的含量遠遠大于1年生枝和葉片。植物的次生代謝是植物在長期進化中與環(huán)境(生物的和非生物的)相互作用的結(jié)果,其產(chǎn)生和變化比初生代謝與環(huán)境有更強的相關(guān)性和對應(yīng)性[17- 18]。植物的次生代謝產(chǎn)物并非均勻分布于整個植株,不同的發(fā)育時期,次生代謝物在植株中分布變化很大[19]。植物不同部位次生代謝物的差異性表現(xiàn)在兩個方面,即不同部位次生代謝物種類的差異性和不同部位同種次生代謝物含量的差異性。前人的研究結(jié)果也證明了次生代謝產(chǎn)物在植株不同部位存在差異性[20]。
植物同一植株不同部位的次生代謝物含量不同,其一是因為植物次生代謝物的產(chǎn)生是一個復(fù)雜的過程,包括生物合成、轉(zhuǎn)運、貯藏和分解。次生代謝物的積累是上述過程的平衡,具有組織、器官和個體發(fā)育的特異性[21]。這一結(jié)論在青蒿和鼠尾草等植物的研究中已經(jīng)得到證實[22- 23],小檗堿等生物堿是在黃檗等植物的細胞質(zhì)、液泡、內(nèi)質(zhì)網(wǎng)等部位合成[24],根皮與莖皮生長年份較長,有利于小檗堿、藥根堿的積累,而1年生枝和葉片都為當(dāng)年生長的,由于生長期短,生物堿沒有充分的時間積累,可能是造成這種差異的原因。另外,植物不同組織的細胞結(jié)構(gòu)和敏感性以及對外界刺激的反應(yīng)程度不同,不同器官中營養(yǎng)狀況和酶反應(yīng)體系不同,都可以造成次生代謝產(chǎn)物在不同部位含量的差異。有研究表明,黃檗莖部小檗堿含量的確由根部向上遞減,直到1.3 m處附近開始再向上測量變化不大[14]。但是藥根堿和小檗堿在黃檗體內(nèi)具體的轉(zhuǎn)化途徑是怎樣的,還有待于進一步的研究。
此外,季節(jié)的變化也是影響黃檗內(nèi)生物堿分布的因素。在本實驗中發(fā)現(xiàn),各部位中小檗堿的含量則均表現(xiàn)為春季>秋季>夏季。藥根堿在春、夏、秋3個季節(jié)的變化為:根皮,莖皮隨季節(jié)變化逐漸升高,多年生枝皮中藥根堿在夏季有所降低,然后在秋季顯著升高(P<0.05)。其原因可能是春季,樹木枝葉生長活動旺盛,光合作用迅速合成次生代謝所需要的底物,所以生物堿含量較高,而夏季樹木枝葉生長速率降低,營養(yǎng)主要供給為樹木的莖部加粗作用,所以枝葉部位的次生代謝處于低谷,而莖部和根皮的藥根堿有少量的提高,到了秋季,樹體生理活動減弱,呼吸代謝減慢,生長抑制劑等激素增多,次生代謝更多處于代謝不活潑的庫中,沒有發(fā)生轉(zhuǎn)移,卻在各器官中積累下來,從而使秋季次生代謝產(chǎn)物含量較高。這個結(jié)論與前人對杜仲和菘藍的研究結(jié)果一致[25]。而小檗堿含量隨著季節(jié)推移的變化趨勢與藥根堿不同,這種差異主要是由于次生代謝物的形成和貯藏位點都嚴格控制在植物的一定發(fā)育期、特殊的器官、組織和特化的細胞中。有研究表明,小檗堿并不是次生代謝的最終產(chǎn)物,它經(jīng)過進一步的代謝轉(zhuǎn)化為藥根堿,所以總體上看,小檗堿和藥根堿的含量呈現(xiàn)互補的狀態(tài),這可能是造成這種現(xiàn)象的原因。
對于每一個個體,其次生代謝物都隨器官、組織而變化,而年齡、季節(jié)和環(huán)境條件也是影響次生代謝產(chǎn)物含量的因素[26]。因此,不同地理種群材料在次生代謝產(chǎn)物含量上有可能存在較大差異。本實驗將10個采樣地點的黃檗各器官中小檗堿、藥根堿的含量與緯度做回歸分析,大部分器官的生物堿隨著緯度變化先降低,后升高。只有夏季、秋季莖皮和多年生枝皮中的藥根堿與緯度的變化表現(xiàn)為先升高,后降低的趨勢。很多學(xué)者研究發(fā)現(xiàn),同種藥用植物所含次生代謝產(chǎn)物含量的高低除與遺傳因素有密切關(guān)系外,所生存的環(huán)境和氣候條件等生態(tài)因子對其也有很大的影響。隨著緯度的升高,年均溫降低,溫度影響了黃檗體內(nèi)的酶活性,使次生代謝的強弱產(chǎn)生了地區(qū)差異,從而使較高緯度地區(qū)的黃檗生物堿含量有所降低,但是緯度升高,也使高緯度地區(qū)的日照時間延長,有研究表明光照時間同樣對提高植物次生代謝產(chǎn)物的含量有積極的作用[27- 28],所以在本實驗范圍內(nèi)的高緯度地區(qū),小檗堿和藥根堿含量均出現(xiàn)了略有升高的現(xiàn)象。但是對于生物堿隨著緯度變化的具體機制和影響這一結(jié)果的關(guān)鍵生態(tài)因子是什么,仍需要進一步的研究,以期更好的解釋小檗堿、藥根堿在不同季節(jié)隨著緯度變化,在個別器官出現(xiàn)的規(guī)律相反的現(xiàn)象。
與以往對黃檗各尺度生物堿含量的研究相比,本研究有兩個特色:一方面是研究的空間范圍比較大,選取了東北地區(qū)3個省份不同緯度的10個采樣地點,包括了野生黃檗的大部分分布區(qū)。本區(qū)域內(nèi)不同的植被類型和立地條件為研究地域因素對黃檗有效成分的含量差異提供了良好的條件,由此能更好的了解黃檗這一瀕危物種在東北地區(qū)的優(yōu)質(zhì)種源區(qū)域,為以后選種或人工栽培、高效利用黃柏藥材提供依據(jù)。二是選取的實驗材料為黃檗的天然種群,更真實地反映黃檗次生代謝產(chǎn)物本身的性質(zhì)和中藥材關(guān)黃柏的采收情況。并對每棵樹的根皮,莖皮,多年生枝皮,1年生枝以及葉片各部位做了詳細的劃分,更好的研究生物堿在黃檗中的分布情況及季節(jié)性的變化規(guī)律。而以往的研究多數(shù)只對單一產(chǎn)地的黃檗內(nèi)部生物堿含量比較關(guān)注[29- 30]。在現(xiàn)有的研究中,環(huán)境因子影響植物次生代謝產(chǎn)物形成和積累的研究甚少[31]。而且生態(tài)因素對植物體內(nèi)次生代謝的影響和作用非常復(fù)雜,黃檗內(nèi)小檗堿、藥根堿的分布可能受幾種生態(tài)因子的誘導(dǎo)。通過本研究,我們可以初步確定黃檗小檗堿、藥根堿在器官尺度、季節(jié)尺度和地域上的差異,并確定了黃檗中的小檗堿在夏季較多,而藥根堿在秋季積累量較大。所以東北地區(qū)栽培和選取黃檗入藥的優(yōu)質(zhì)種源可以選擇低緯度地區(qū)(鳳城及周邊地區(qū)),在夏秋兩季采摘,并考慮用多年生枝替代莖皮入藥。以此來確定生物堿的最有效采收時期和部位,為合理利用野生黃檗資源提供理論支撐。
[1] Chinese Academy of Sciences Editorial Board. Flora of China. Beijing: Science Press, 2004, 43(2): 100- 100.
[2] Azad M A K, Yokota S, Ishiguri F, Yahara S, Yoshizawa N. Histological studies of shoot regeneration system in hypocotyl-derived callus ofPhellodendronamurenseRupr. Journal of Forest Research, 2005, 10(5): 377- 384.
[3] Wang W, Zu Y G, Fu Y J, Reichling J, Suschke U, Nokemper S, Zhang Y L.Invitroantioxidant, antimicrobial and anti-herpes simplex virus type 1 activity ofPhellodendronamurenseRupr. from China. The American Journal of Chinese Medicine, 2009, 37(1): 195- 203.
[4] Lis A, Boczek E, Góra J. Chemical composition of the essential oils from fruits, leaves and flowers of the Amur cork tree (PhellodendronamurenseRupr.). Flavour and Fragrance Journal, 2004, 19(6): 549- 553.
[5] Ghosh R, Graham H, Rivas P, Tan X J, Crosby K, Bhaskaran S, Schoolfield J, Banu J, Fernandes G, Yeh I T, Kumar A P.Phellodendronamurenseand its major alkaloid compound, berberine ameliorates scopolamine-induced neuronal impairment and memory dysfunction in rats. Anticancer Research, 2010, 30: 857- 866.
[6] Bjorklund J A, Frenzel T, Rueffer M, Kobayashi M, Mocek U, Fox C, Beale J M, Groeger S, Zenk M H, Floss H G. Cryptic stereochemistry of berberine alkaloid biosynthesis. Journal of the American Chemical Society, 1995, 117(5): 1533- 1545.
[7] Grycová L, Dostál J, Marek R. Quaternary protoberberine alkaloids. Phytochemistry, 2007, 68(2): 150- 175.
[8] Ding, L W. Trend reviews ofPhellodendronamurense. Special Economic Animal and Plant, 2011, 14(4): 16- 18.
[9] Fu L G. China Rare and Endangered Plants List. Shanghai: Shanghai Education Press, 1989: 342- 345.
[10] Fu L G. China Species Red List-Rare and Endangered Plants. Beijing: Science Press, 1991: 572- 573.
[11] Ma F, Zhang J. Investigation of Chinese Key Protected Wild Plant Resources. Beijing: China Forestry Publishing House, 2009: 156- 157.
[12] Yang J L, Zhao B, Kim Y B, Zhou C G, Li C Y, Chen Y L, Zhang H Z, Li C H.Agrobacteriumtumefaciens-mediated transformation ofPhellodendronamurenseRupr. using mature-seed explants. Molecular Biology Reports, 2013, 40(1): 281- 288.
[13] Azad M A K, Yokota S, Ishiguri F, Yoshizawa N. Plant regeneration from mesophyll protoplasts of a medicinal plant,PhellodendronamurenseRupr. In Vitro Cellular & Developmental Biology-Plant, 2006, 42(6): 502- 507.
[14] Wang Y, Zhang Y H, Yan X F, Yu T. Distribution of berberine content in the stem of corktree saplings. Plant Physiology Communications, 2005, 41(1): 87- 89.
[15] Qin Y J, Zhang Y H, Wang Y, Yan X F. Determination of alkaloids content inPhellodendronamurenseRupr. by HPLC. Chemistry and Industry of Forest Products, 2004, 24(s1): 115- 118.
[16] Zhang K J, Dong E J, Ma B L. Studies on the distribution differences of the secondary metabolites inEucommiaulmodies. Scientia Silvae Sinicae, 2002, 38(6): 12- 16.
[17] Wink M. Functions of Plant Secondary Metabolites and Their Exploitation in Biotechnology, Vol 3: Annual Plant Reviews. BocaRaton: CRC Press, 1999.
[18] Shelton A L. Variable chemical defences in plants and their effects on herbivore behaviour. Evolutionary Ecology Research, 2000, 2(2): 231- 249.
[19] Yan X F. Ecology of plant secondary metabolism. Acta Phytoecologica Sinica, 2001, 25(5): 639- 640.
[20] Ni X B, Su J. Active constituents of above-gronud portion and root ofSalviamiltior-rhiza. Chinese Pharmaceutical Journal, 1995, 30(6): 336- 338.
[21] Win K M. Evolution of secondary metabolites from an ecological and molecular phylogenetic perspective. Phytochemistry, 2003, 64(1): 3- 19.
[22] Goel D, Singh V, Ali M, Mallavarupu G R, Kumar S. Essential oils of petal, leaf and stem of the antimalarial plantArtemisiaannual. Journal of Natural Medicines, 2007, 61(2): 187- 191.
[23] Ferreira J F S, Simon J E, Janick J. Developmental studies ofArtemisiaannualflowering and artemisinin production under green house and field condition. Planta Medica, 1995, 61(2): 167- 170.
[24] Tang Z H, Yu J H, Yang F J, Zu Y G. Metabolic biology of plant alkaloids. Chinese Bulletin of Botany, 2003, 20(6): 696- 702.
[25] Zhang K J, Ma X H, Ma M, Wang L, Zhang T. Study on dynamic accumulation of metabolites during the growth of Eucommia ulmoides oliv. Scientia Silvae Sinicae, 1999, 35(2): 15- 20.
[26] Qin Y J. Study on the Distribution of Principal Medicinal Compositions in Amur Corktree [D]. Haerbin: Northeast Forestry University, 2005.
[27] Wang Z Y, Cui H H, Wang Z Q, Li R M, Kang Y H. Effects of light intensity on resveratrol and polydatin production in Rumex gmelini root. Chinese Journal of Applied Ecology, 2006, 17(5): 851- 854.
[28] Zhu R B, Wu Q S, Wan Z H, Ding Y P. Influence of altitudes on effective compositions of American Ginseng in Mountains of West Anhui. Agricultural Meteorology, 2001, 22(1): 19- 22.
[29] Li X, Yan X F, Yu T. Effects of color films shading onPhellodendronamurenseseedlings biomass and primary nitrogen assimilation enzyme activities. Chinese Journal of Applied Ecology, 2006, 17(11): 2020- 2023.
[30] Li X, Yan X F. Effects of color films on three kinds of alkaloids ofPhellodendromamurenseseedlings. Acta Ecologica Sinica, 2009, 29(3): 1292- 1299.
[31] Dong E J, Zhang K J, Liang Z S. Plant Secondary Metabolism and Its Regulation. Yangling: Northwest A&F University Press, 2009: 93- 94.
參考文獻:
[1] 中國科學(xué)院編委會. 中國植物志. 北京: 科學(xué)出版社, 2004, 43(2): 100- 100.
[8] 丁立威. 關(guān)黃柏走勢點評. 特種經(jīng)濟動植物, 2011, 14(4): 16- 18.
[9] 傅立國. 中國珍稀瀕危植物. 上海: 上海教育出版社, 1989: 342- 345.
[10] 傅立國. 中國植物紅皮書- 稀有瀕危植物. 北京: 科學(xué)出版社, 1991: 572- 573.
[11] 馬福, 張建. 中國重點保護野生植物資源調(diào)查. 北京: 中國林業(yè)出版社, 2009: 156- 157.
[14] 王洋, 張玉紅, 閻秀峰, 于濤. 黃檗幼樹莖干中小檗堿含量的分布. 植物生理學(xué)通訊, 2005, 41(1): 87- 89.
[15] 秦彥杰, 張玉紅, 王洋, 閻秀峰. 黃檗中生物堿含量的高效液相色譜分析. 林產(chǎn)化學(xué)與工業(yè), 2004, 24(s1): 115- 118.
[16] 張康健, 董娥娟, 馬柏林等. 杜仲次生代謝物部位差異性的研究. 林業(yè)科學(xué), 2002, 38(6): 12- 16.
[19] 閆秀峰. 植物次生代謝生態(tài)學(xué). 植物生態(tài)學(xué)報, 2001, 25(5): 639- 640.
[20] 倪學(xué)斌, 蘇靜. 丹參地上部分有效成分的初步分析. 中國藥學(xué)雜志, 1995, 30(6): 336- 338.
[24] 唐中華, 于景華, 楊逢建, 祖元剛. 植物生物堿代謝生物學(xué)研究進展. 植物學(xué)通報, 2003, 20(6): 696- 702.
[25] 張康健, 馬希漢, 馬梅, 王藍, 張?zhí)? 杜仲次生代謝物生長積累動態(tài)的研究. 林業(yè)科學(xué). 1999, 35(2): 15- 20.
[26] 秦彥杰. 黃檗主要藥用成分的分布規(guī)律研究 [D]. 哈爾濱: 東北林業(yè)大學(xué), 2005.
[27] 王振月, 崔紅花, 王宗權(quán), 李瑞明, 康毅華. 光強對毛脈酸模根中白藜蘆醇和白藜蘆醇苷的影響. 應(yīng)用生態(tài)學(xué)報, 2006, 17(5): 851- 854.
[28] 朱仁斌, 吳慶生, 宛志滬, 丁亞平. 皖西山區(qū)海拔高度對西洋參有效成分的影響. 中國農(nóng)業(yè)氣象, 2001, 22(1): 19- 22.
[29] 李霞, 閻秀峰, 于濤. 濾光膜對黃檗幼苗生物量及初級氮同化酶活性的影響. 應(yīng)用生態(tài)學(xué)報, 2006, 17(11): 2020- 2023.
[30] 李霞, 閻秀峰. 濾光膜對黃檗(Phellodendronamuranse)幼苗三種生物堿含量的影響. 生態(tài)學(xué)報, 2009, 29(3): 1292- 1299.
[31] 董娥娟, 張康健, 梁宗鎖. 植物次生代謝與調(diào)控. 楊凌: 西北農(nóng)林科技大學(xué)出版社, 2009: 93- 94.
The seasonal and geographical variance analysis of the berberine and jatrorrhizine contents in natural populations ofPhellodendronamurense
XU Lijiao1, QIU Jingjun1, SUN Minglong1, ZHANG Yuhong1, XIA Chunmei2, ZHOU Zhiqiang1,*
1KeyLaboratoryofForestEcologyofMinistryofEducation,NortheastForestryUniversity,Harbin150040,China2CollegeofForestry,NortheastForestryUniversity,Harbin150040,China
PhellodendronamurenseRupr. (Rutaceae) is a deciduous tree commonly called the Amur cork tree. The bark ofP.amurensehas been widely used in China, Japan, and Korea for hundreds of years for its anti-inflammatory and anti-tumor activities. It is regarded as a rich source of pharmaceutically important isoquinoline alkaloids, including berberine and jatrorrhizine. Berberine currently is recommended in China for the treatment of gastroenteritis, dysentery, tuberculosis, scarlet fever, acute tonsillitis, and respiratory tract infections. The substantial increase in its exploitation has caused serious damage to wild populations. At present, large areas of wildP.amurensetrees are rare, and the species is severely endangered in China. Its extensive medicinal use has raised interest in its cultivation. The quantities of secondary metabolites in plants, including theP.amurensespecies, vary across habitats, geographical locations, seasons, and parts of the plant. The generation and variation of secondary metabolites has a stronger correlation and dependence on the environment than primary metabolites. The synthesis and accumulation of secondary metabolites are not only significantly affected by genetics, but also by environmental factors such as light, temperature, and moisture. Therefore, secondary metabolite levels within a species may differ among geographic populations. However, few studies have assessed variation in alkaloid content inP.amurense. This study attempted to explore alkaloid content variance ofP.amurenseamong various habitats in Northeastern China. The berberine and jatrorrhizine contents in different parts (root bark, trunk bark, perennial branch bark, annual branch and leaf) were measured; and the seasonal and geographical variances of the two kinds of alkaloids in organs were analysed by high performance liquid chromatography(HPLC). The results showed that the seasonal content sequence of berberine and jatrorrhizine in different parts were the same root bark > trunk bark > perennial branch bark > annual branch > leaf. The contents of berberine in various parts increased from spring to summer but fell in aunumn. The contents of jatrorrhizine in different parts did not directly line up with the seasonal variation:jatrorrhizine in root bark and trunk bark gradually increased with the season passing, but the enhanced value was not obvious in summer ; by autumn however, it accumulated massively. For the perennial branch barks, annual branches and leaves, the jatrorrhizine dropped from spring to summer, and increased in autumn. Along the latitude scale, the two kinds of alkaloids had the significant geographical variance. Normally, the content of alkaloids decreased gradually with the latitude enhancing, and reached the lowest value at N44°, and then reversed slightly. In the northeast China, the low latitude areas (such as Fengcheng and surrounding areas) could be confirmed for breeding and qualified medicine provenance ofP.amurense, the raw material collection should be progressed in the summer or autumn better, and consider replaced trunk bark with perennial branch bark. The above results would help us to know the distribution regulation of the two kinds of alkaloids on multiple scales and provide the theoretical support for optimal cultivation and efficient, sustainable utilization of the natural resources found inP.amurense.
P.amurense; berberine; jatrorrhizine; different parts; seasonal variance; geographical variance
林業(yè)公益性行業(yè)科研專項(201104066)
2013- 02- 06; 網(wǎng)絡(luò)出版日期:2014- 03- 13
10.5846/stxb201302060255
*通訊作者Corresponding author.E-mail: uwezhou@126.com
徐麗嬌,邱婧珺,孫銘隆,張玉紅, 夏春梅,周志強.季節(jié)和地理差異對天然黃檗小檗堿和藥根堿含量的影響.生態(tài)學(xué)報,2014,34(21):6355- 6365.
Xu L J, Qiu J J, Sun M L, Zhang Y H, Xia C M, Zhou Z Q.The seasonal and geographical variance analysis of the berberine and jatrorrhizine contents in natural populations ofPhellodendronamurense.Acta Ecologica Sinica,2014,34(21):6355- 6365.

