苦參堿體外促進腫瘤細胞凋亡的實驗研究
李國慧,張劍霄,黃慧,王會茹,王倩,徐茜茹,劉新光
論著·基礎
苦參堿體外促進腫瘤細胞凋亡的實驗研究
李國慧,張劍霄,黃慧,王會茹,王倩,徐茜茹,劉新光
目的探討苦參堿體外促進腫瘤細胞凋亡及其作用機制。方法將濃度為0.2 mg/ml、0.4 mg/ml、0.6 mg/ml的苦參堿作用于卵巢癌細胞株A21-2和骨肉瘤細胞株MG63,利用倒置相差顯微鏡觀察不同濃度苦參堿作用后細胞的形態變化;流式細胞術(FCM)檢測細胞凋亡周期、Caspase-3蛋白的表達。結果倒置相差顯微鏡觀察表明,苦參堿能抑制MG63細胞和A21-2細胞的增殖;FCM分析發現,苦參堿與細胞作用72h后,G0/G1期前出現凋亡峰,與對照組比較,觀察組不同濃度下凋亡率升高(P<0.01),且隨濃度升高,凋亡率亦增高,差異有統計學意義(P<0.05),FCM分析顯示,與對照組比較,觀察組不同濃度下Caspase-3蛋白表達升高(P<0.01),且隨濃度升高,Caspase-3蛋白表達亦升高,差異有統計學意義(P<0.05)。結論苦參堿能明顯抑制A21-2細胞和MG63細胞的增殖,誘導細胞凋亡,其機制可能與促進Caspase-3蛋白的表達有關。
苦參堿;A21-2;MG63;細胞凋亡;Caspase-3蛋白
世界衛生組織曾預測惡性腫瘤將成為21世紀人類的第一殺手[1],惡性腫瘤已成為我國居民的首要死因。女性生殖系統常見腫瘤之一——卵巢癌,是婦科惡性腫瘤中病死率最高的腫瘤,近年來雖然卵巢惡性腫瘤在基礎研究、臨床診治方面均取得很大的進展,但遺憾的是其5年生存率仍提高不明顯,仍在30%左右。骨肉瘤是常見的骨原發性惡性腫瘤,以其惡性程度高、發生轉移早等特點成為骨科領域的一大難題。在對卵巢癌和骨肉瘤的臨床治療過程中,常采用手術后輔以放化療等治療手段以期提高患者的生存期,但是由于放化療不良反應較大,很多患者無法完成全部放化療過程,因此研發高效低毒的抗腫瘤藥物成為目前醫學研究的熱點。隨著研究的不斷深入,中藥的抗腫瘤作用越來越為人們所認知,以其高效低毒的優勢在治療惡性腫瘤的過程中發揮著不可替代的作用。苦參堿作為藥用植物,據文字記載在我國已有2000年的歷史,具有抗炎、殺菌、清熱、解毒等功效;同時還具有抗病毒、抗過敏等多種作用。本實驗將苦參堿體外作用于卵巢癌細胞株A21-2及骨肉瘤細胞株MG63,通過倒置相差顯微鏡、流式細胞術等檢測手段,觀察苦參堿作用后腫瘤細胞形態學變化,檢測苦參堿對腫瘤細胞的促凋亡作用及Caspase-3蛋白的表達情況, 以期從凋亡角度研究苦參堿的抗腫瘤作用,進一步豐富苦參堿抗腫瘤作用的基礎研究,為苦參堿早日應用于臨床提供相應的實驗依據。
1 材料與方法
1.1 材料 (1)A21-2細胞株和MG63細胞株由河北醫科大學第三附屬醫院實驗中心提供,A21-2細胞株培養于含10%胎牛血清(fetal bovine serum,FBS)的RPMI1640培養基中,MG63細胞株培養于含10% FBS、100 U/ml青霉素、100 U/ml鏈霉素的DMEM培養基中。(2)藥品及試劑:二甲基亞楓(DMSO)、乙二胺四乙酸(EDTA)購自北京化工廠;FBS購自杭州四季青公司,胰酶(trypsin)為石家莊拜昂生物技術有限公司產品, RPMI1640培養基及DMEM培養基為GIBCO公司產品;苦參堿為山西泰盛藥業集團產品,鼠抗人Caspase-3單克隆抗體,異硫氰酸熒光素(FITC)標記的羊抗鼠二抗購自Santa Cruz生物技術公司。(3)主要儀器:超凈工作臺(蘇凈集團安泰公司,中國蘇州);Epic XL IV型流式細胞儀(Beckman-Coulter公司,美國);CO2培養箱(Heraeus BB6220,德國);W2-2型微量振蕩器(北京朝陽區電子電子儀器一廠,中國);倒置相差顯微鏡(Olympus,CK-40 32PH,日本);臺式高速離心機(EPPENDORF 5415D 德國);UV-2550型分光光度計(島津公司,日本)。
1.2 細胞復蘇及培養 將保存有A21-2細胞株和MG63細胞株的冷凍管自液氮罐中取出,迅速放入39~40℃溫水中不停晃動1 min以上,完全溶解后直接離心,棄上清以去掉凍存液,D-Hanks液洗滌1次后,分別在A21-2細胞株和MG63細胞株中加入RPMI1640培養基和DMEM培養基1 ml使其成為懸浮細胞,將細胞接種于培養瓶中,加入新鮮培養基,放入37℃,5%CO2培養箱中培養。待細胞生長至對數生長期時收集細胞用于實驗。
1.3 檢測項目
1.3.1 細胞形態變化: 在放有蓋玻片的培養皿中培養A21-2細胞、MG63細胞,待細胞生長至對數生長期時,將腫瘤細胞分為4組,每組10例,分別加入終濃度為0.2 mg/ml、0.4 mg/ml、0.6 mg/ml的含苦參堿培養基作為觀察組,對照組中加入不含藥物的新鮮培養基,應用倒置相差顯微鏡定時觀察并照相。
1.3.2 細胞凋亡檢測: 收集經不同濃度苦參堿作用72 h的A21-2細胞、MG63細胞及其各自對照組細胞,經PBS漂洗數次。用體積分數為70%、預冷的乙醇4℃固定過夜, 檢測前加入生理鹽水10 ml,1 000 r/min離心3 min去除固定液。加入0.5%胃蛋白酶消化細胞使其成為單細胞混懸液,加入碘化丙錠(PI,50 mg/L Trinton X-100 1.0%)1 ml室溫避光染色30 min,應用流式細胞儀進行細胞凋亡和細胞周期分布檢測,應用軟件進行分析。
1.3.3 Caspase-3蛋白表達: 收集經0.2 mg/ml、0.4 mg/ml、0.6 mg/ml苦參堿作用72 h的A21-2細胞、MG63細胞及其各自對照組細胞,按要求進行熒光標記,應用流式細胞儀檢測被測細胞熒光強度,蛋白表達情況以熒光指數(FI)表示。
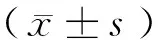
2 結 果
2.1 腫瘤細胞變化 倒置相差顯微鏡下可見對照組細胞貼壁狀態良好(圖1、2見封3)。觀察組細胞胞體變圓,附壁能力明顯減弱,部分細胞脫落,懸浮于培養基中成為懸浮細胞,經0.2、0.4、0.6 mg/ml的苦參堿處理A21-2和MG63細胞72 h后,細胞生長緩慢甚至停止,G0/G1期細胞明顯增多,貼壁細胞數量明顯減少,并伴有大量細胞死亡(圖3、4見封3)。A21-2和MG63細胞的凋亡率隨著藥物濃度的增加逐漸上升,與對照組比較,觀察組細胞的凋亡率顯著升高(P<0.01)。見表1。
2.2 Caspase-3蛋白表達 FCM分析發現,0.2、0.4、0.6 mg/ml的苦參堿處理A21-23和MG6細胞72 h后,Caspase-3蛋白表達升高。與對照組比較,隨著苦參堿濃度增加,腫瘤細胞Caspase-3蛋白表達也明顯升高(P<0.01)。見表2。
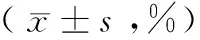
表1 A21-2和MG63細胞經不同濃度苦參堿作用后各細胞周期百分率及凋亡率變化
注:與對照組比較,*P<0.01;與0.2 mg/ml比較,#P<0.05;與0.4 mg/ml比較,△P<0.05
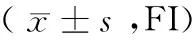
表2 A21-2和MG63細胞經苦參堿作用后對Caspase-3蛋白表達的影響
注:與對照組比較,*P<0.01;與0.2 mg/ml比較,#P<0.05;與0.4 mg/ml比較,△P<0.05
3 討 論
惡性腫瘤目前在世界范圍內是常見病、多發病,是嚴重危害人類健康的一大殺手。雖然手術治療是惡性腫瘤治療的首選,但術后的復發和轉移仍是威脅患者生存的重要原因之一,此時內科治療就成為了治療腫瘤的重要手段。雖然化療和其他輔助治療隨著研究的不斷深入取得了一些喜人的成果,但仍未明顯提高目前的治療水平,因此尋找療效高、不良反應小的抗腫瘤藥物已成為當前重要的研究內容。
作為我國傳統中藥,苦參堿在臨床中應用較為廣泛,如抗炎、抗病毒、保肝及調節機體免疫力等功效[2~5]。近年來關于苦參堿的抗腫瘤作用也為研究者所關注,結果顯示,苦參堿具有廣譜抗腫瘤作用,且在抗腫瘤同時能夠提高機體免疫力,對正常細胞不產生破壞作用[6,7]。
細胞凋亡是一種細胞死亡方式,是細胞的一種基本生物學現象,在機體生長發育過程中,有機體通過細胞凋亡清除無用細胞及病變細胞,發揮著調控機體發育、維持內環境穩定的重要功能。有研究表明腫瘤的發生、發展及惡化不僅與細胞的增殖分化異常有關,還與其凋亡障礙有關[8,9]。在本實驗中,將苦參堿作用于卵巢癌細胞株A21-2和骨肉瘤細胞株MG63,用倒置相差顯微鏡觀察藥物作用后細胞的形態變化,發現A21-2細胞和MG63細胞生長均受到明顯抑制,培養液中出現大量死亡細胞。流式細胞術顯示,A21-2細胞和MG63細胞在細胞周期G0/G1期所占比例逐步增加,G2/M期比例逐步下降,同時在觀察組細胞G1期發現凋亡峰。通過以上實驗我們發現,苦參堿能明顯抑制卵巢癌A21-2細胞和骨肉瘤MG63細胞的增殖,干擾細胞周期進程,誘導腫瘤細胞發生凋亡。
盡管凋亡機制目前尚未完全清楚,但在凋亡過程中Caspase即半胱天冬蛋白酶在凋亡過程中的作用是勿庸置疑的,細胞凋亡的過程實際上是Caspase不可逆有限水解底物的級聯放大反應過程,其中Caspase-3是細胞凋亡的啟動者和執行者,是細胞凋亡中的關鍵蛋白[10~12]。在無異常情況下,Caspase-3以酶原的形式存在于細胞中,機體一旦啟動凋亡程序,則Caspase-3被活化,進而促進凋亡的發生。在本實驗中通過流式細胞術發現,0.2、0.4、0.6 mg/ml的苦參堿處理A21-2和MG6細胞72h后,隨著藥物濃度增加,Caspase-3蛋白的表達也逐漸增加。
通過本實驗可發現腫瘤細胞A21-2和MG63經苦參堿作用后,細胞生長受到明顯抑制,細胞周期發生阻滯,多數細胞分裂被阻滯于DNA合成前期即G1,阻止了腫瘤細胞向S期轉化,從而減少細胞DNA的合成和有絲分裂,同時促進了腫瘤細胞的分化,使細胞出現明顯的凋亡形態,并伴有細胞凋亡效應期中心分子Caspase-3蛋白表達升高,表明苦參堿誘導腫瘤細胞凋亡且促凋亡機制可能與促進Caspase-3蛋白表達有關。
1 謝文琴,金少華,賈尚春,等. 安徽省1996—2005年惡性腫瘤病死率分析[J]. 安徽預防醫學雜志,2007,13(2):96-98.
2 張麗華,陳邦恩,潘明佳.苦參堿藥理作用研究進展[J].中草藥,2009, 40(6):1000.
3 Zhang F, Wang X, Tong L, et al. Matrine attenuates endotoxininduced acute liver injury after hepatic ischemia/reperfusion in rats[J]. Surg Today,2011,41(8):1075-1084.
4 周粼, 張家驊, 甘平.苦參堿預處理對預防大鼠肝臟缺血再灌注損傷的作用觀察[J].中國現代普通外科進展,2009,12(7):557-560.
5 王君明,崔瑛.山豆根化學成分藥理作用及毒性研究進展[J]. 中國實驗方劑學雜志,2011,17(4):229.
6 Zhang JQ, Li YM, Liu T, et al. Antitumor effect of matrine in human hepatoma G2 cells by inducing apoptosis and autophagy[J].World J Gastmenterol, 2010,16(34):4281-4290.
7 Qin XG, Hua Z, Shuang W, et al. Effects of matrine on hepG2 cell proliferation and expression of tumor relevant proteins in vitro[J]. Pharmaceutical Biology, 2010,48(3):275-281.
8 Ostuki T, Kanno T, Fujita Y, et al. Adenosine receptor-mediated p53-dependent apoptosis in lu-65 human lung cancer cells[J]. Cell Phsiol Biochem, 2012, 30(1):210.
9 劉粉霞,徐玉芳,孫寧.氧化苦參堿誘導人胃癌細胞凋亡的實驗研究[J].中國醫藥導報, 2011,8(31):27-28,32.
10 Cho BB,Toledo-Pereyra LH.Caspase-independent programmed cell death following ischemic stroke[J].J Invest Surg, 2008,21(3):141-147.
11 Fuchs Y, Steller H. Programmed cell death in animal development and disease[J]. Cell,2011,147(4):742-758.
12 Huang Q, Li F, Liu X, et al. Caspase3-mediated stimulation of tumor cell repopulation during cancer radiotherapy[J]. Nat Med, 2011, 17(7):860-866.
Experimentalstudyofmatrineoninductionoftumorcellsapoptosisinvitro
LIGuohui,ZHANGJianxiao,HUANGHui,WANGHuiru,WANGQian,XUQianru,LIUXinguang.
DepartmentfoLaboratory,Children'sHospitalofHebeiProvince,Shijia-zhuang050031,China
ZHANGJianxiao.E-mail:liguohui0611@126.com
ObjectiveTo investigate the effect of matrine on induction of tumor cells apoptosis and its molecular mechanisms.MethodsA21-2 and MG63 cells were treated with matrine at different concentration:0.2 mg/ml,0.4 mg/ml,0.6 mg/ml. Using light microscope to observe the change of morphology; flow cytometry (FMC)method was used to detect the apoptosis cycles of cells and expression of Caspase-3 protein.ResultsAfter matrine treatment, inverted microscope observation showed that the growth of cells was inhibited significantly. Flow cytometry method showed that there was a sub-G0/G1apo-ptosis peak in the graph of drug-treated groups after 72h. Compared with control group, the apoptosis rate increased in observation group(P<0.01),and the more the concentration was ,the higher the apoptosis rate was(P<0.01).FCM analysis showed Caspase-3 increased in observation group than control group(P<0.01),and alone with the increase of the concentration,the expression of Caspase-3 increased(P<0.05).ConclusionMatrine can inhibit proliferation of A21-2 and MG63 cells. It's molecular mechanism might be related to modulating the expression of Caspase-3 protein.
Matrine; A21-2 cells;MG63 cells; Cell apoptosis; Caspase-3
河北省衛生廳重點科技研究計劃(No.20120016)
050031 石家莊,河北省兒童醫院檢驗科
張劍霄,E-mail:liguohui0611@126.com
10.3969/j.issn.1671-6450.2014.06.023
2013-10-09)

