利用纖維素原料生產檸檬酸菌株的篩選
葉生梅,丁葉強,張國慶
(1.安徽工程大學生物與化學工程學院,安徽蕪湖 241000;2.安徽省農科院農業工程研究所,安徽合肥 230041)
當今利用微生物(黑曲霉)發酵生產檸檬酸的主要原料是含淀粉量高的糧食(如薯類、谷類、糖蜜等)。我國科研工作者通過精心選育得到了利用淀粉質原料生產檸檬酸的高產菌種。世界人口的增長和糧食的匱乏制約乙醇、檸檬酸等以糧食為原料的工業的發展。我國有豐富的秸稈資源,近年來,隨著我國農村生活能源結構的變化,秸稈逐漸由傳統的做飯、取暖的原料變成了無用的負擔物。秸稈的就地焚燒產生的煙霧已成為影響空氣質量和公共安全的公害。如何以秸稈等纖維素為原料,用微生物發酵生產燃料(如乙醇、沼氣等)及有機化工產品(如檸檬酸等)成為秸稈綜合利用的重要課題。可再生性的秸稈資源的高值化利用,對解決我國的秸稈焚燒、“三農”問題、能源問題和農業可持續發展具有現實意義。
纖維素燃料乙醇的生物轉化是近來的研究熱點,而纖維素原料發酵生產有機酸(如檸檬酸)的研究較少[1-4]。本文通過對一株黑曲霉S的纖維素酶發酵特性和產酸馴化篩選研究,以期獲得具有利用纖維素原料產酸的菌種。
1 材料與方法
1.1 材料與儀器
檸檬酸、蔗糖、草酸、NH4NO3、(NH4)2SO4、KH2PO4、MgSO47H2O、HCl、CaCl2、NaOH等 均為國藥集團化學試劑有限公司產品,分析純;CMC-Na(CP)、山芋淀粉、麩皮 市售;稻草、玉米秸稈、稻殼 采自蕪湖市東郊農村;黑曲霉S(Aspergillus niger S)從土壤中分離,本校微生物實驗室保藏;斜面培養基 PDA;初篩培養基 PDA培養基中添加0.02%溴甲酚綠指示劑;馴化篩選培養基 高檸檬酸-高滲察氏平板;酸性薯干粉水解平板[6];種子培養基(%) 葡萄糖3,麩皮2,(NH4)2SO40.2,KH2PO40.2,MgSO47H2O 0.05;以預處理稻草等纖維素為基質的發酵培養基(%) 預處理纖維素原料3,麩皮2,葡萄糖2,(NH4)2SO40.2,KH2PO40.2,MgSO4·7H2O 0.05;產檸檬酸發酵培養基500mL蒸餾水于水浴鍋中加熱至50℃,加入60g山芋淀粉,攪拌均勻后加淀粉酶(6U/g原料)50℃保溫10min,1℃/min升溫至95℃,保溫20min,然后迅速升至沸騰并維持20min,約5min內降溫至60℃,加營養鹽(KH2PO41g,NH4NO31g,MgSO4·7H2O 0.12g,MnSO40.01g)加水保持原體積。
HH-6型電熱恒溫水浴鍋 金壇市杰瑞爾電器有限公司;QHZ-123B型全溫振蕩培養箱 太倉市華美生化儀器廠;SW-CJ-2FD型雙人單面超凈工作臺 蘇州凈化設備有限公司;722型分光光度計、PHSJ-5型實驗室pH計 上海精密科學儀器有限公司;DSX-280B型高壓蒸汽滅菌鍋 上海申安醫療器械廠;PYX-DHS型隔水式電熱恒溫培養箱 上海躍進醫療器械廠。
1.2 實驗方法
1.2.1 稻草秸稈、玉米秸稈、稻殼的預處理采用文獻[4]中的方法 秸稈切成1~2cm的小段與3%氫氧化鈉溶液(固液比w/v為1∶5)混勻,置于高壓蒸汽滅菌鍋中0.15MPa保溫5min,立即放氣。預處理后用水洗至pH7.5,50℃烘干后粉碎備用。
1.2.2 黑曲霉孢子懸液的制備 用無菌生理鹽水將活化的斜面菌種孢子刮下,轉入帶玻璃珠的三角瓶并振蕩,再用滅菌脫脂棉過濾到另一滅菌三角瓶得單孢子懸液,調整孢子數105~106個/mL。
1.2.3 黑曲霉S的產酸馴化篩選[6]黑曲霉S的孢子懸液稀釋后涂布于高檸檬酸-高滲察氏平皿35℃培養5d,選擇生長快和孢子頭大的轉接于酸性薯干粉水解液平板35℃培養7d,挑選酸性薯干粉水解液平板上不長孢子的菌落轉接于含0.02%溴甲酚綠的PDA選擇性平皿,35℃培養5d,選取10個黃色變色圈與菌落直徑比較大的菌落,保持于PDA斜面。
1.2.4 種子培養及發酵 接種1mL/瓶黑曲霉孢子懸液于種子培養基,30℃,150r/min培養24h。以10%的接種量接種種子液于纖維素基質發酵,發酵條件30℃,200r/min培養24h后以35℃,250r/min培養。每個發酵三重復。
以糖化山芋淀粉為基質的檸檬酸發酵:直接用黑曲霉孢子懸液接種,1mL/瓶,35℃,200r/min,培養4d。每個發酵三重復。
1.2.5 分析測試方法 酸度的測定—NaOH滴定法[7]:發酵液經濾紙過濾后,用0.1429mol/L的NaOH溶液滴定,0.5%酚酞做指示劑,每毫升發酵液消耗NaOH的毫升數即為發酵液中檸檬酸的百分比含量(g/100mL)。
還原糖的測定:DNS法[8]。
pH的測定:酸度計或精密pH試紙。
孢子計數:血球計數板直接計數法[5]。
纖維素酶活力測定[8]:CMC酶活力測定:25mL具塞試管中加入1.5mL以0.2mol/L pH5.0 HAc NaAc緩沖液配制的1%CMC-Na溶液,置于50℃水浴中預熱5min。加1.0mL適當稀釋的酶液,搖勻,50℃準確反應30min,之后加入DNS試劑1.5mL,放入沸水浴顯色5min,取出后立即置于冰水中冷卻至室溫,定容至25mL,搖勻。以相同條件下沸水浴滅活5min的酶液為空白,在波長540nm條件下測定吸光度值。按DNS法測定還原糖含量。酶活單位的定義:上述反應條件下,每分鐘催化纖維素水解生成1μg葡萄糖的酶量為1個酶活力單位,用U/mL表示。
濾紙酶活力測定:取檸檬酸緩沖液(pH5.0)1.5mL,加入新華定量濾紙1條(1cm×6cm、(50±1)mg),再加入粗酶液1.0mL,50℃恒溫水浴保持1h,加入DNS試劑1.5mL,于沸水浴中放置5min,冷卻,定容至25mL,以相同條件下沸水浴滅活5min的酶液為空白,于540nm處測定其吸光度值,按DNS法測定還原糖含量。在上述條件下,每分鐘催化水解底物生成1μg葡萄糖的酶量定義為1個酶活單位,用U/mL表示。
發酵后固形物質量的測定:濾渣用100mL蒸餾水洗滌后置80℃烘干至恒重,稱重(g)。
固形物的變化量(g)=發酵后固形物的質量(g)-發酵前預處理稻草的質量(g)。
黑曲霉利用預處理稻草發酵產酸率(%)=M總酸(g)/原料(g)×100。
紙層析法鑒定酸成分以1%草酸、1%檸檬酸為標準品,發酵上清液為待測樣品,展開劑為正丁醇∶冰醋酸∶水=12∶3∶5(v/v/v),室溫上行展層9h,70~80℃烘干4h,冷卻后噴上溴酚藍顯色劑。計算Rf值。Rf=d1/d2式中,d1為各顯色點中心到點樣點的距離(cm);d2為點樣點到溶劑前沿的距離(cm)。
2 結果與分析
2.1 菌株S的形態觀察
菌落形態:在PDA平板上氣生菌絲短,呈絨毛狀,圓形,幼時略顯黃色,孢子成熟后菌絲白色,菌落背面無色,有褶皺,孢子黑色(見圖1左,放大倍數16×10)。菌株顯微形態:普通光學顯微鏡下觀察菌絲有隔.(見圖1右,放大倍數16×40),孢子梗頂部膨大呈球形,球形表面著生小梗呈輻射狀排列,分生孢子串生于小梗頂部,分生孢子黑色(見圖1中,放大倍數16×40)。
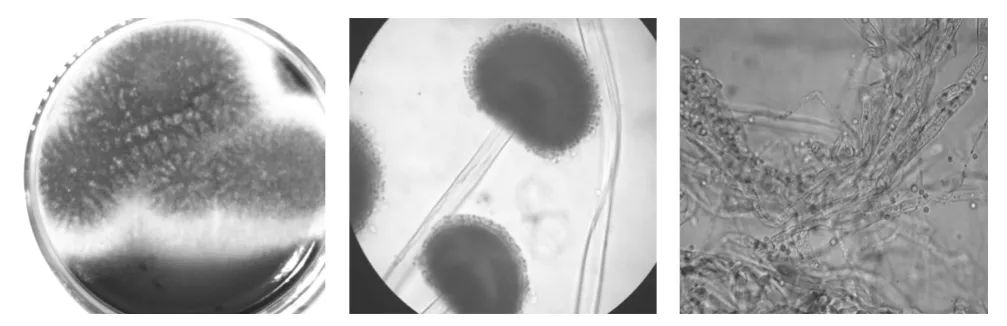
圖1 菌株S的菌落特征及顯微形態Fig.1 Characteristics of colony and microscopic form on the strain S
2.2 菌株纖維素原料發酵實驗
2.2.1 菌株利用CMC-Na發酵特性 以10%的接種量接種種子液于CMC-Na基質發酵,分別在不同時間取樣測定CMC酶活力、pH,測定結果如表1所示。

表1 菌株S利用CMC-Na發酵特性Table 1 Characteristics of fermentation with CMC-Na on the strain S
由表1可看出,發酵12h時CMC酶活力達到201.1U/mL,隨著發酵時間的延長,菌株產酸使發酵液pH下降很快,纖維素酶活力也下降很快。發酵46h纖維素酶未檢出,酸度達到0.9%。從發酵結果看該菌株具有纖維素酶系基因,有利用CMC-Na為原料產酸的能力。
2.2.2 以不同纖維素原料為基質發酵產纖維素酶、產酸特性 鑒于該菌株具有較高的CMCase酶活力且產酸,以CMC-Na為對照,進一步考察以預處理的稻草、玉米秸稈、稻殼為碳源該菌株的纖維素酶活力、產酸性能。分別在12、24h取樣測定CMCase酶、濾紙酶(FPase酶)活力。發酵48h后,各發酵瓶中菌絲結成小球,發酵液透明易過濾,測定濾液的酸度、pH,測定結果如表2所示。
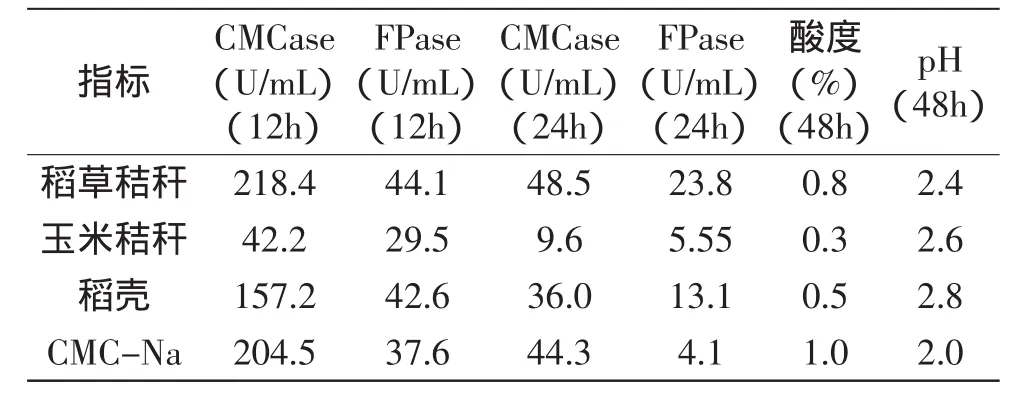
表2 以纖維素原料為基質發酵產纖維素酶、產酸比較Table 2 The compare of producing cellulase and acid with cellulose raw material on the strain S
由表2可見,菌株以三種秸稈類纖維素原料發酵具有以CMC-Na同樣的特點,即在發酵12h酶活力高,隨著發酵的進行CMCase酶、濾紙酶(FPase酶)酶活力下降,到24h時CMCase酶活降到約為12h時的四分之一,24h時以稻草為基質的濾紙酶(FPase酶)活力降為12h時的二分之一,另外幾種原料的下降更快。從三種預處理原料看,以預處理稻草為碳源,發酵12h、24h的CMC酶活力、濾紙酶活力均最高;發酵48h時測定酸度,以稻草為基質的發酵產酸也最高,而玉米秸稈和稻殼為原料的發酵纖維素酶活及產酸都不及稻草,可能與原料的組成有關,預處理稻草為其產纖維素酶、產酸的適宜碳源。
2.3 黑曲霉S產酸的馴化篩選
通過馴化篩選,選取10個黃色變色圈與菌落直徑比較大的菌落,保存于PDA斜面,并用檸檬酸發酵培養基復篩,培養4d測定酸度,篩選結果如表3所示,菌株S6產酸水平略高,其余菌株產酸水平相當,選取菌株S6作為后續實驗用菌種。
2.4 黑曲霉S6產酸發酵產物鑒定及菌株產酸穩定性檢驗
用黑曲霉S6孢子懸液接種于產酸培養基培養4d。過濾,取濾液測定酸度、紙上層析法鑒定產酸成分,根據進行比較。從層析結果看,發酵液樣品的黃色斑點與檸檬酸標準品的Rf基本一致,檸檬酸標樣(Rf=0.52)與發酵上清液樣品(Rf=0.49)且發酵液的草酸斑點幾乎看不出,表明該菌株產酸發酵產物較純,主要為檸檬酸。將菌株連續傳代發酵5批,發酵產酸結果如表4所示,從表4可見,菌株S6產酸性能穩定。

表3 菌株S產酸復篩結果Table 3 The rescreening results of acid-producing of the strain S

表4 菌株S6產酸穩定性檢驗Table 4 The stability of acid-producing on the strain S6
2.5 黑曲霉S6以預處理稻草為基質產檸檬酸實驗
以10%的接種量接種種子液于發酵培養基,每隔12h取樣,發酵液過濾,濾液測定pH、酸度、還原糖;濾渣用100mL蒸餾水洗滌后置80℃烘干,測定發酵過程中固形物(草料+生物量)的變化、纖維素和半纖維素含量的變化。
發酵液的性狀:培養24h時,觀察到發酵液中的菌球較少,到36h時發酵液中的菌絲球細小而密,發酵液顏色變淺,氣味香甜。發酵48、60h時發酵瓶中的性狀如36h時。但到72h后菌絲球似有溶解,發酵液過濾速度變慢。
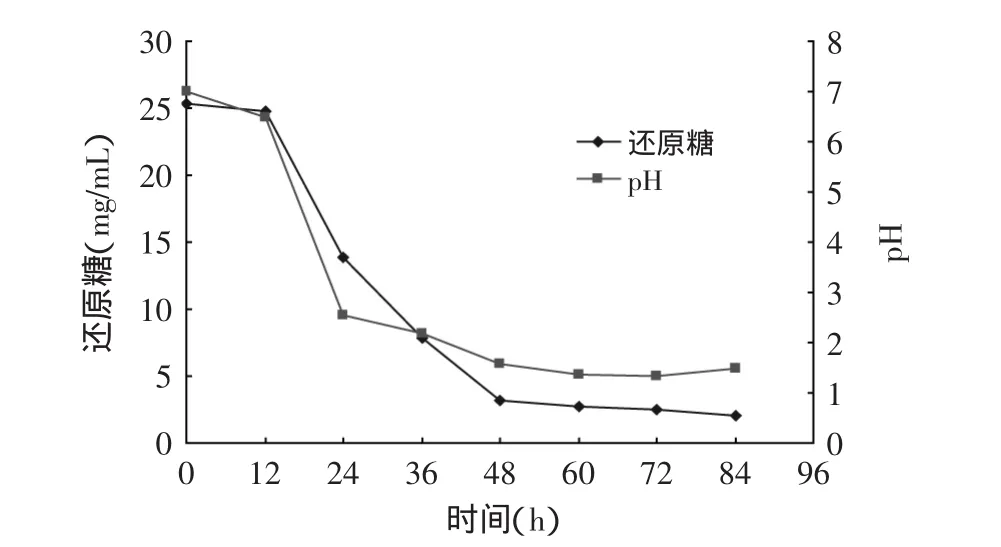
圖2 發酵過程還原糖、pH的變化Fig.2 The fermentation process of changes profile of reduced suger utilization and pH
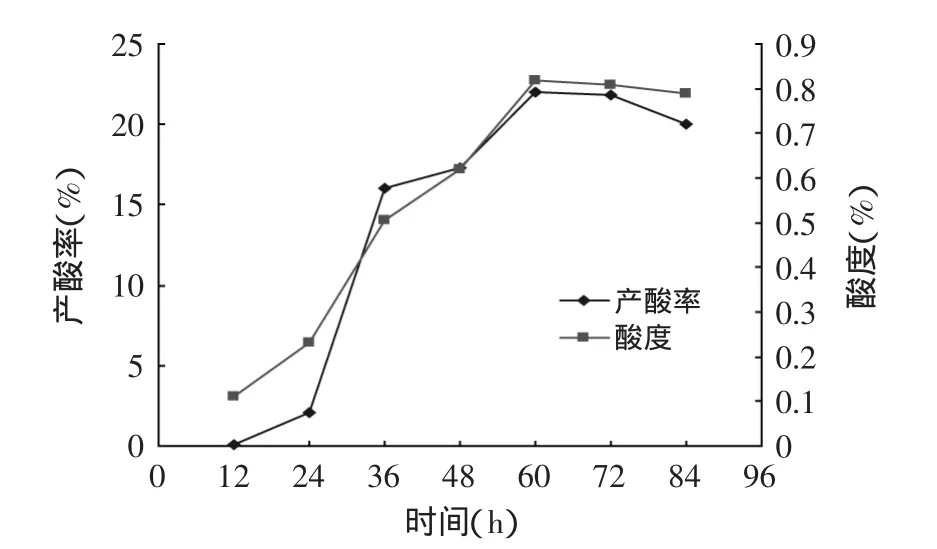
圖3 發酵過程中酸度和產酸率的變化Fig.3 The fermentation process of changes of the concentration of citric acid and acid production rate
從圖2發酵過程中pH、還原糖的變化看出,發酵12~48h發酵液中還原糖下降迅速,說明菌種處于對數生長期,培養基中草料及其他基質被利用。菌種生物量增長且產酸,發酵液的pH下降。60h后,發酵過程基本結束。pH也趨于穩定在2.5左右。從圖3可見,發酵過程中酸度、產酸率在12~60h之間增加較快,到60h后產酸不再增加,也說明到60h時發酵趨于結束。產酸達0.82%。稻草纖維素的產酸轉化率達22%。
通過測定發酵原料和殘渣中纖維素和半纖維素的含量發現,由于發酵過程中菌體生物量的增加,發酵過程纖維素、半纖維素的變化不能反映發酵液中草料的變化(數據未列出)。但通過測定發酵過程中固形物與原料中草料的質量差(即固形物的變化)如圖4可知,發酵開始階段草料的利用大于菌體的生長,固形物的變化為負;隨著菌體的生長,生物量的增加大于草料的利用,固形物的變化為正;到48h后,菌體的對數生長期轉入穩定期;從72~84h菌體已到衰亡期,固形物的變化有所降低。
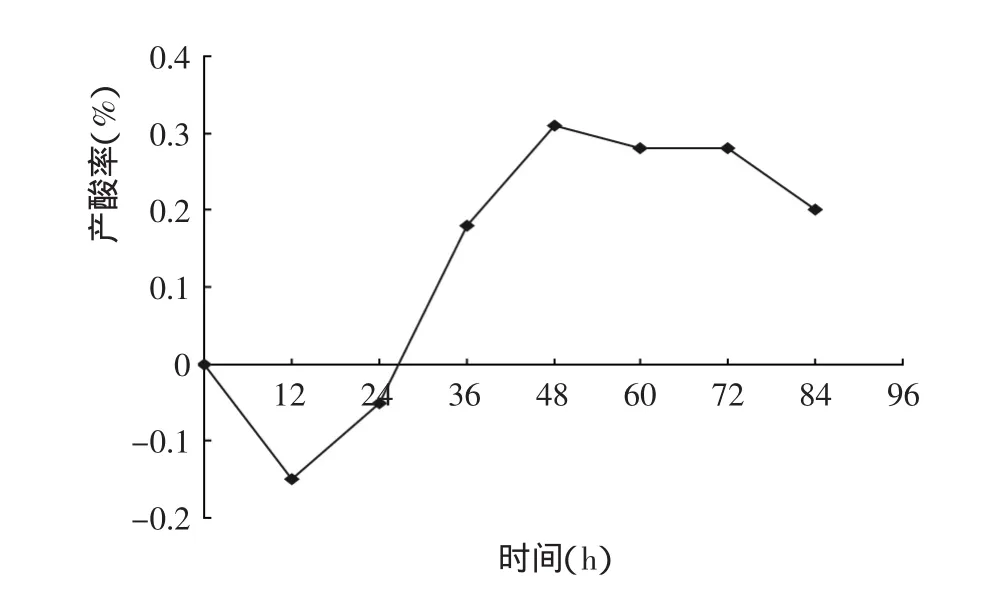
圖4 發酵過程中固形物的變化Fig.4 The fermentation process of changes of change in solids
從實驗結果看,發酵過程菌體生長迅速,發酵過程纖維素草料利用快。直接利用菌株S6的纖維素酶系和產酸酶系分解纖維素原料產酸,纖維素酶解和產酸進行偶聯,省去了纖維素原料糖化過程[9-10],節約了秸稈類纖維素利用的成本。因此,菌株S6有進一步研究和開發的價值。
3 結論與討論
有關用淀粉質以外的原料產檸檬酸的研究中,有報道用甘蔗渣[11]、蘋果渣[12]、纖維素水解液[9-10]等產檸檬酸的研究。由于目前的纖維素酶活力不高,使纖維素酶解糖化的成本高,限制了纖維素原料的高值化工業應用。本文利用馴化篩選的黑曲霉S6對直接利用纖維素原料產檸檬酸進行了初步研究,結果表明,菌株S6能利用纖維素原料產酸,且預處理稻草為產酸的適宜碳源。以預處理稻草為碳源,發酵12h CMC酶活力達218.4U/mL,濾紙酶活力44.1U/mL,發酵60h產酸率達22%。酶解和產酸偶聯進行,省去了將纖維素酶解的步驟,節約了成本。此外,發酵提取檸檬酸后的殘渣(菌體+未利用的秸稈成分)可作為動物飼料,因為發酵過程增加了殘渣的蛋白質含量,降低了原料中難以消化吸收的物質等。
研究中發現,菌株S的纖維素酶不耐酸,纖維素酶失活快。如何提高菌株S的纖維素酶酶活力、產酸率;特別是如何提高纖維素酶耐酸能力保持其在低pH下的活力是具有挑戰性的課題,有待進一步研究探索。
[1]方詡,秦玉琪,李雪芝,等.纖維素酶與木質纖維素生物轉化的研究進展[J].生物工程學報,2010,26(7):864-869.
[2]Namita B,Chetna J,Rupinder T,et al.Highly Thermostable and pH-Stable Cellulases fromAspergillus nigerNS-2:Properties and Application for Cellulose Hydrolysis[J].ApplBiochem Biotechnol,2014,172:141-156.
[3]盛曉曉,周如金,唐玉斌.纖維素原料制取燃料酒精的研究概述[J].食品與發酵工業,2012,38(1):138-142.
[4]葉生梅,許盼吉,汪江林.稻草秸稈的預處理及發酵乙醇的實驗研究[J].中國糧油學報,2009,24(6):133-136.
[5]沈萍,陳向東.微生物學實驗[M].北京:高等教育出版社,2007:51-52.
[6]王博彥,金其榮.發酵有機酸與應用手冊[M].北京:中國輕工業出版社,2000:49-50:72-73.
[7]王德培,周婷,張靈燕,等.氮離子注入和微波復合誘變選育高產檸檬酸的黑曲霉研究[J].中國釀造,2012,31(5):123-127.
[8]甄靜,王繼雯,謝寶恩,等.一株纖維素降解真菌的篩選、鑒定及酶學性質分析[J].微生物學通報,2011,38(5):709-714.
[9]謝慧君,盧利方,陳建,等.纖維素熱解后用于檸檬酸發酵的研究[J].食品工業科技,2005,26(11):149-150.
[10]劉毅,袁月華.稻草纖維素糖化液發酵檸檬酸的條件研究[J].廣東農業科學,2012(15):86-89.
[11]Masoud Y,Adel H,Seyed A,et al.Citric Acid Production from Sugarcane Bagasse through Solid State Fermentation Method usingAspergillus nigerMold and Optimization of Citric Acid Production by Taguchi Method[J].Jundishapur J Microbiol,2013 6(9):e7625.
[12]吳怡瑩,張苓花,明靜文,等.以蘋果渣為原料固體發酵生產檸檬酸的研究[J].大連輕工業學院學報,1994,13(2):72-77.

