綠茶下腳料中EGCG的分離與體外抗氧化性能研究
李邦玉,劉 臣,陳 萌,陳 柳,俞 晟,王耀榮
(1.蘇州市職業大學應用化學研究室,江蘇蘇州 215104;2.蘇州大學材料與化學化工部,江蘇蘇州 215123)
化學家從茶葉中分離出茶多酚后發現其具有優良的抗氧化性,特別是其中兒茶素類化合物具有很活潑的羥基氫,能提供大量的氫質子與自由基反應,有效地清除人體內過剩的活性氧自由基和抑制脂質過氧化,具有顯著的抗衰老保健作用[1]。表沒食子兒茶素沒食子酸酯(EGCG)是兒茶素中的主體成份,自從1929年人們從茶葉中提取分離出來后,許多科學工作者對EGCG生理功效進行了研究,發現EGCG具有抗腫瘤、抗動脈粥樣硬化、抗衰老、抗菌消炎、降糖和降壓等多種生物學功能[2],所以其被廣泛應用于食品、藥品和飲料行業。
本實驗選用食用級溶劑作為EGCG的提取純化溶劑,采用安全、經濟的聚酰胺樹脂分離純化方法,制備適用于食品、化妝品、醫療、保健用的EGCG產品。該方法簡便可靠,可以應用于工業化大生產,使得綠茶的下腳料得到合理的應用。采用紫外可見光譜法對EGCG的溫度穩定性、EGCG與DPPH·的反應等進行了初步探索,從光譜圖的變化直觀地判斷體系的內部反應,粗略得到EGCG體外抗氧化的溫度條件,獲得跟蹤EGCG與DPPH·反應的檢測波長。以VC等常見抗氧化劑為參照系,采用鄰苯三酚自氧化法研究了EGCG對·的清除能力,采用DPPH·法研究了EGCG體外抗氧化活性,初步判斷EGCG是一個很好的天然抗氧劑。
1 材料與方法
1.1 材料與儀器
DPPH· sigma公司;聚酰胺薄膜層析板 臺州市路橋四甲生化塑料廠;聚酰胺樹脂 60~100目,滄州寶恩吸附材料科技有限公司;三(羥甲基)氨基甲烷鹽酸鹽 上海如吉生物科技發展有限公司;茶多酚 南京仁信化工有限公司;鄰苯三酚,乙酸乙酯等其他試劑 均為國產分析純;綠茶的下腳料 蘇州東山碧螺春茶廠提供。
P230型高效液相色譜儀 配有P230+紫外檢測器、P230/P230p高壓恒泵,EC2000色譜工作站,大連依利特分析儀器有限公司;RUC-5200型超聲波清洗機 上海睿祺公司;不銹鋼循環水多用真空泵 上海滬西分析儀器廠;RE52-3旋轉蒸發儀 上海滬西分析儀器廠;玻璃層析柱 400mm×15mm,定制;UV1801紫外可見分光光度儀 北京坤健捷誠科技發展有限公司。
1.2 實驗方法
1.2.1 EGCG的分離提純 取綠茶下腳料10g,置250mL容量瓶中,加入95%乙醇150mL,80℃超聲(工作頻率24kHz,功率300W)提取30min,提取兩次,合并提取液,過濾,80℃減壓回收乙醇,得濃縮液上聚酰胺樹脂柱,以乙醇-醋酸梯度洗脫,薄層層析跟蹤檢測,收集EGCG部位流分,脫色,濃縮,重結晶,得 EGCG純品,液相色譜法檢測產品成分與純度。
利用液相色譜法分析產品純度及含量。色譜條件為:色譜柱:Shimpak C18(4.6mm ×150mm,5μm);流動相:甲醇-水-冰醋酸(20∶80∶0.2);檢測波長:280nm,流速:1.0mL·min-1;柱溫:30℃,進樣量 5μL。
1.2.2 不同溫度下EGCG紫外可見吸收光譜圖的測定 在10mL比色管中盛5mL同一濃度的EGCG溶液,分別置于 20、40、60、80℃ 水浴鍋中恒溫加熱30min,在200~600nm范圍內掃描樣品的紫外可見吸收光譜。
1.2.3 選擇 EGCG與 DPPH·反應的掃描波長實驗 按表1方案吸取不同濃度的EGCG乙醇溶液加入直徑1cm比色皿中,再加入3.5mL 0.0176g/L DPPH·乙醇溶液,室溫避光靜置20min后,以50%乙醇作參比,在200~600nm范圍內掃描樣品的紫外可見吸收光譜。

表1 EGCG與DPPH·反應加樣表Table 1 The scheme of the reaction of EGCG with DPPH·
1.2.4 EGCG清除DPPH·能力測定
1.2.4.1 溶液的配制 DPPH·標準儲備液:準確稱取20mg DPPH·用無水乙醇定容于250mL容量瓶中,得到濃度為2×10-4mol/L的DPPH·溶液,貼上標簽,暗處保存。
DPPH·標準應用液:取DPPH·標準儲備液用無水乙醇定容,制備0.0176g/L DPPH·標準應用液,貼上標簽,暗處保存。
1.2.4.2 DPPH·標準曲線的繪制 分別從0.0176g/L DPPH·標準應用液中取0.2、0.4、0.8、1.6、3.2mL 于比色管中,添加無水乙醇至10mL,配成濃度分別為3.52、7.04、14.08、28.16、56.32μg/mL 溶液。在 517nm波長測定不同濃度DPPH·的吸光度值,繪制其標準曲線。
1.2.4.3 EGCG清除DPPH·能力測定 參考Larrauri等[3-5]的方法進行清除自由基實驗。按表2方案吸取不同濃度的EGCG乙醇溶液加入直徑1cm比色皿中,再加入3.5mL 0.0176g/L DPPH·乙醇溶液,室溫避光靜置20min后,以50%乙醇作參比,于517nm處測定其吸光值。按以下公式得出其清除率:
清除率(%)=[1-(A-B)/A0]×100

表2 EGCG清除DPPH·實驗加樣表Table 2 The scheme of the reaction of EGCG with DPPH·
抑制百分數(%)=[(A0-A)/A0]×100
式中:A0為鄰苯三酚的自氧化速率;A為加入樣液后鄰苯三酚的自氧化速率;單位均為吸光度每分鐘的增值。
2 結果與討論
2.1 EGCG的分離純化及檢測
2.1.1 EGCG的分離提純 隨著EGCG應用領域越來越廣泛,對其提取純化制備技術也提出了更高的要求。要使EGCG能夠極大程度地發揮醫療、保健作用,需要一種安全、經濟的EGCG提取純化方法,能夠保證EGCG原料的質量穩定、安全可控。因此,本實驗選用食用級的95%乙醇溶劑作為EGCG的提取純化溶劑,用超聲萃取綠茶下腳料,過濾,減壓,濃縮液上安全、經濟的聚酰胺樹脂柱分離純化,以乙醇-醋酸梯度洗脫,薄層層析跟蹤檢測(如圖1所示),發現乙醇與醋酸體積比為1∶4時洗脫效果最好。收集EGCG流分,脫色,濃縮,重結晶,得 EGCG純品。方法簡便,可以應用于工業化大生產,使綠茶的下腳料作為資源得到合理運用。

圖1 EGCG餾分薄層色譜跟蹤圖Fig.1 Thin layer chromatogram of the extracted EGCG products
2.1.2 液相色譜法檢測EGCG產品成分及含量純化的樣品及EGCG對照品色譜如圖2、圖3所示。由純化樣品的液相色譜圖可知,EGCG較純,含量大于97%,只混有極少量其它雜質。提取收率達到12%。
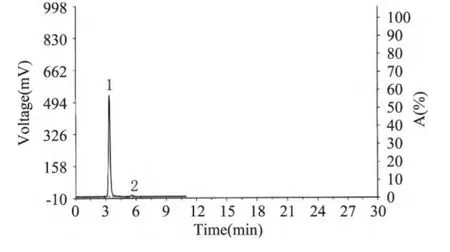
圖2 純化樣品的液相色譜圖Fig.2 HPLC chromatogram of the extracted EGCG products

圖3 EGCG對照品液相色譜圖Fig.3 HPLC chromatogram of EGCG standard reagent
2.2 紫外可見吸收光譜法考察EGCG受溫度的影響
由圖4可知EGCG在276nm處有特征吸收。
實驗考察了溫度對EGCG的影響。由圖5可知,溫度升高到40℃后吸收曲線就發生變化了,當溫度升高到60℃后就破壞了EGCG的結構,225nm處吸收峰分裂且強度驟降,276nm處吸收峰消失,而在325nm處的吸收峰變強。吳平等[6]報道在高溫下,EGCG可能發生降解、異構化、脫沒食子酸化和自動氧化等反應,隨著EGCG的下降,有GA的產生,而其異構體GCG也明顯增加。所以EGCG在高溫下容易變質,應在合適的低溫如室溫下考察其抗氧化性能。
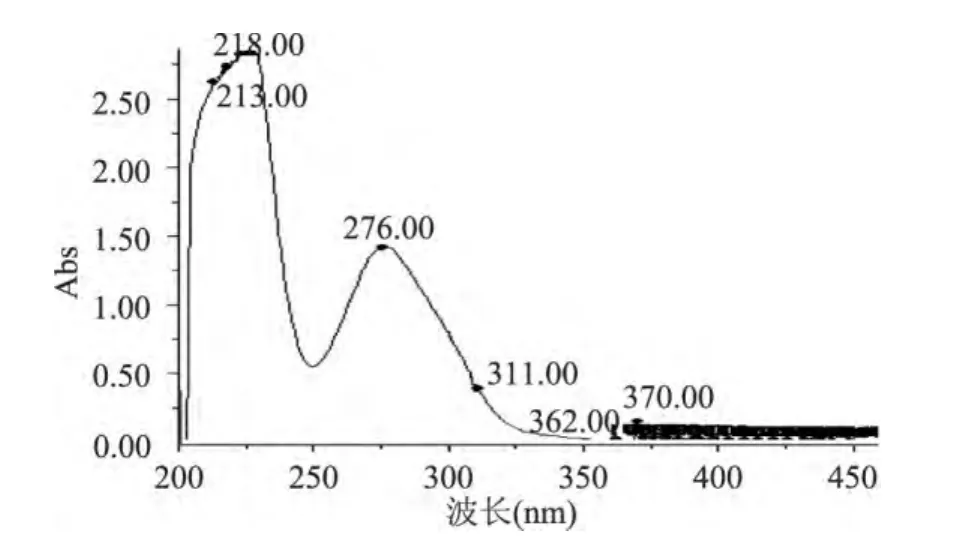
圖4 EGCG紫外可見光譜掃描圖Fig.4 UV visible spectroscopy of EGCG

圖5 溫度對EGCG紫外可見光譜影響圖Fig.5 UV visible spectroscopy of EGCG under different temperature conditions
2.3 EGCG對DPPH·的清除能力測定
2.3.1 EGCG與DPPH·反應的掃描波長選擇 從DPPH·在無水乙醇中的光譜圖6中可見,DPPH·在326nm和517nm處出現兩個特征吸收。

圖6 DPPH的紫外可見吸收光譜圖Fig.6 UV visible spectroscopy of DPPH·
EGCG能使紫紅色DPPH·溶液褪色,表明EGCG與DPPH·發生了反應。實驗中嘗試用EGCG與DPPH·發生反應后體系的紫外可見光譜圖來跟蹤該反應。如圖7所示,EGCG在517nm處沒有吸收,而DPPH·中添加了EGCG后,其吸收光譜圖發生了明顯變化,在326nm和517nm處兩個特征吸收都失去了特征性,在425nm處出現新的寬吸收峰。
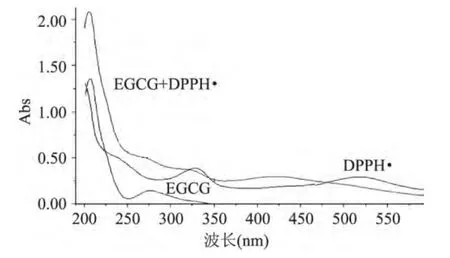
圖7 EGCG與DPPH·反應中光譜變化圖Fig.7 UV visible spectroscopy changes of the reaction system of EGCG with DPPH·
同時,不同濃度的EGCG與DPPH·發生反應后體系的紫外可見光譜圖如圖8所示,除了發現反應體系的圖譜與DPPH·的吸收光譜圖不同之外,體系的光譜在DPPH·517nm處吸收強度隨EGCG濃度的增大而有規律地依次降低。而DPPH·另一特征吸收326nm處的吸收強度變化沒有規律性,所以通常借助517nm處的吸收強度變化來評價物質的抗氧化活性[7]。實驗比較了VC和茶多酚分別與DPPH·反應后體系的紫外可見光譜圖,發現上述兩個反應體系的圖譜變化規律類似于EGCG與DPPH·反應體系的光譜變化規律。通過紫外可見光譜法初步探討了DPPH·與溫度的關系,如圖9所示。溫度升高,DPPH·自由基的顏色明顯褪去。從圖9上可知不同溫度下的光譜圖差別很大,517nm處的特征吸收強度逐漸降低,而425nm寬峰處吸收強度逐漸增強,326nm處特征吸收沒有太大變化。所以溫度過高使得517nm處特征吸收消失,不利于利用517nm處的吸收強度變化來評價物質的抗氧化活性。

圖8 不同濃度的EGCG與DPPH·發生反應后體系的光譜圖Fig.8 UV visible spectroscopy of the reaction system of different concentrations EGCG with DPPH·
總之,在討論抗氧化劑消除DPPH·的反應時,應選擇517nm波長監測,同時在較低溫度如室溫下進行。
2.3.2 DPPH·標準溶液的標準曲線 利用DPPH·在無水乙醇中的517nm處的特征吸收,繪制DPPH·標準曲線,得出DPPH·標準曲線的回歸方程為Y=0.0151+0.0281x(R=0.999909),如圖10所示。在0~60μg/mL范圍內DPPH·乙醇溶液濃度與吸光度值之間呈現良好的線性關系。
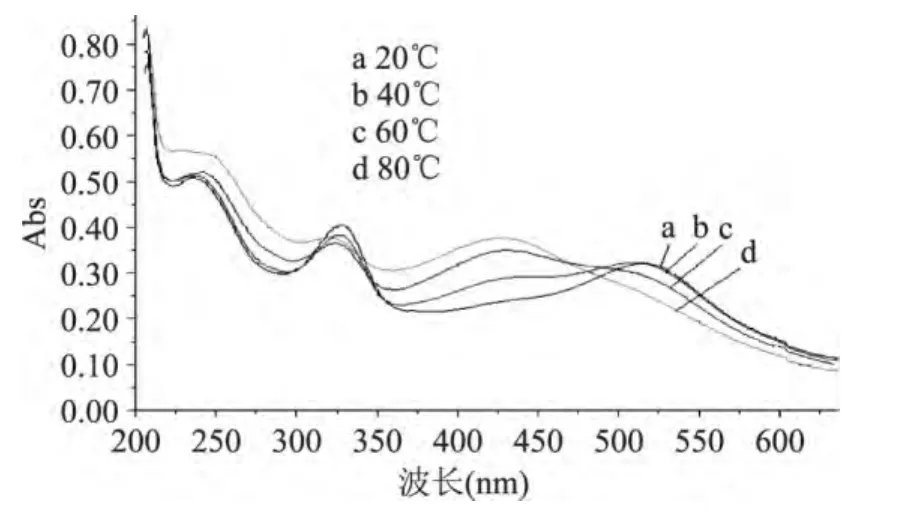
圖9 DPPH·在不同溫度下紫外可見光譜圖Fig.9 UV visible spectroscopy of DPPH·under different temperature conditions

圖10 DPPH·標準溶液的標準曲線Fig.10 Standard curves of DPPH·standard solution
2.3.3 EGCG清除DPPH· 圖11是EGCG對DPPH·清除效果圖。由該圖可知,EGCG對DPPH·有很強的清除作用,清除率隨EGCG濃度的增加而上升,在EGCG濃度為32μg/mL時清除率達到80%,其IC50值約為12μg/mL。同時,用茶多酚、維生素C標準品做比較實驗,發現EGCG的清除效果比VC好,但不如市售茶多酚,可能是市售茶多酚里面不僅含有EGCG,還含有其他成分,某些成分的清除效果應比EGCG還好。

圖11 EGCG對DPPH·自由基清除圖Fig.11 Scavenging effects of EGCG on DPPH·

圖12 EGCG對·清除圖Fig.12 Scavenging effects of EGCG on ·
3 結論
本文成功地從綠茶下腳料中提取出了純度很高的EGCG單體。EGCG在低溫如室溫下比較穩定,適宜考察其抗氧化性能。在室溫等低溫下于517nm波長處監測抗氧化劑EGCG清除DPPH·的性能比較合適。EGCG對自由基有較強清除作用,清除DPPH·、·的能力比維生素C強,其清除上述兩類自由基的IC50值分別為 12μg/mL 和 5.9μg/mL。總之,EGCG是一種較好的天然抗氧化劑。
[1]鄔新榮,王岳飛,張士康,等.茶多酚保健功能研究進展與保健食品開發[J].茶葉科學,2010,30:501-505.
[2]Jane V,Higdon B F.Tea catechins and polyphenols:health effects,metabolism,and antioxidant functions[J].Crit Rev Food Science and Nutrition,2003,43(1):89-143.
[3]Larraufi J A,Sanchez M C,Saura C F.Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomaee peels[J].J Agic Food Chem,1998,46(7):2694-2697.
[4]劉朝霞,胡士德,鄒坤,等.資木瓜乙醇提取物的體外抗氧化活性研究[J].三峽大學學報:自然科學版,2008,30(4):72-75.
[5]李紅,張元湖.應用DPPH·法測定蘋果提取物的抗氧化能力[J].山東農業大學學報:自然科學版,2005,36(1):35-39.
[6]吳平.表沒食子兒茶素沒食子酸酯的熱穩定性研究[D].合肥:安徽農業大學,2011:2-4.
[7]余芳,安辛欣.富硒綠茶中茶多酚及水提物的抗氧化活性研究[J].江蘇農業科學,2012,40(8):298-300.

