磁性伊利石復合材料的制備及其對Co(Ⅱ)吸附性能的影響
胡春聯,陳元濤,張煒,肖江,池亞玲,赫文芳
(青海師范大學化學系,青海 西寧 810008)
磁性伊利石復合材料的制備及其對Co(Ⅱ)吸附性能的影響
胡春聯,陳元濤,張煒,肖江,池亞玲,赫文芳
(青海師范大學化學系,青海 西寧 810008)
采用化學共沉淀法制備了磁性伊利石復合材料,并對其吸附性能進行研究。首先利用紅外光譜(FTIR)、場發射掃描電鏡(SEM)和振動樣品磁強計(VSM)對磁性伊利石進行表征,然后研究了吸附劑濃度、吸附時間、pH值和溫度對Co(Ⅱ)在磁性伊利石上吸附的影響,并采用Lagrange準二級動力學方程、Langmuir等溫線方程及Freundlich等溫線方程對實驗數據進行擬合。結果表明:Fe3O4納米粒子成功地復合在了伊利石表面;pH值和溫度對Co(Ⅱ)在伊利石上的吸附影響較大;Co(Ⅱ)在磁性伊利石上的吸附符合Lagrange準二級動力學方程;熱力學符合Langmuir等溫線方程,并且高溫利于吸附。
磁性復合材料;吸附;Co(Ⅱ);動力學;熱力學
鈷是一種重要的金屬礦物,廣泛應用于各個生產部門,但排放的Co(Ⅱ)對環境中的動植物具有明顯的毒害作用。隨著鈷資源的日益枯竭和人類對環境保護要求的不斷提高,對Co(Ⅱ)廢水的處理與分離就變得越來越重要[1]。近年來,關于對重金屬離子的處理方法主要有:離子交換法、化學沉淀法、電解法、吸附法等[2-4]。離子交換法可用于濃縮溶液中的痕量重金屬,但價格較貴;化學沉淀法能夠較快地去除溶液中大量的重金屬離子,但是需要加入過量的沉淀劑,且沉淀劑本身往往含有毒性,另外,該方法流程長,處理費用高;電解法耗電量較大,限制了其廣泛應用;而吸附法是一種比較簡便易行的方法,因其具有操作簡單、吸附容量可觀及天然吸附劑資源豐富等優勢而受到廣泛的重視。伊利石是一種富鉀的2∶l型層間缺失的二八面體硅酸鹽云母類黏土礦物,屬于兩個硅氧四面體夾一個鋁氧八面體(即T-O-T)結構,且無膨脹性[5-9]。相比其他黏土礦物,伊利石具有比表面積大、粒徑小、陽離子交換能力強、成本低等特點,因此,對環境中的重金屬離子具有較好的吸附能力[10-11],但是,難以解決其在處理廢水后回收利用的問題。Fe3O4是一種理想的磁性粒子,特別是其超順磁行為,容易在外磁場作用下實現定位、定向移動[12]。將磁性微粒附載于具有交換吸附性能和比表面積較大的微孔礦物中而制備的磁性復合材料在環保領域有著廣泛的應用前景[13]。
目前,有關磁性伊利石復合材料及其在處理廢水后快速回收利用的研究報道并不多見。因此,在伊利石中附載一定量的磁性微粒,可利用外加磁場將其從懸浮液中快速分離回收,實現再利用,可有效降低企業在廢水處理方面的成本。
本課題組已經做過一些伊利石相關的研究工作[14-15],本文是在伊利石上附載Fe3O4并以該材料作為吸附劑,對Co(Ⅱ)的吸附性能進行研究,從吸附劑濃度、pH值、時間及溫度等因素進行考察,并進一步研究Co(Ⅱ)在磁性伊利石上的吸附動力學及熱力學行為。
1 實驗部分
1.1 材料與儀器
材料:四水合氯化亞鐵、六水合氯化鐵、氫氧化鈉、六水合二氯化鈷、偶氮氯膦(Ⅲ)、乙酸、乙酸鈉、鹽酸、氫氧化鈉(以上均為分析純)及伊利石(購于河北省靈壽縣錦川礦產品加工廠)。
儀器:KQ-250DV型數控超聲清洗器(昆山市超聲儀器有限公司)、TU-1901雙光束紫外可見分光光度計(北京普析通用儀器有限公司)、BSA224SCW電子天平(賽多利斯科學儀器有限公司)、IKA KS 4000i控溫搖床(成都智誠科靈儀器儀表有限公司)、pH計(賽多利斯科學儀器有限公司)、微量進樣器(上海髙鴿工貿有限公司)、臺式高速離心機(H1850 cence ,湖南湘儀離心機儀器有限公司)、Nexus 670 FT-IR(美國 Nicolet公司)、冷場場發射掃描電子顯微鏡(日本電子JSM)和振動樣品磁強計VSM(Lake Shore 7410)。
1.2 實驗方法
1.2.1 磁性伊利石復合材料的制備
在氮氣下,采用化學共沉淀法制備磁性伊利石復合材料。具體制備過程如下:分別稱取2.97g FeCl3·6H2O和1.20g FeCl2·4H2O于250mL燒杯中,同時將6g伊利石粉(200目)加入,并加入50mL蒸餾水,用2mol/L的NaOH溶液調節pH值至9~10,并轉入圓底燒瓶中,65℃恒溫水浴,機械攪拌4h后停止。冷卻至室溫,再用蒸餾水洗滌至中性,最后用乙醇洗滌兩次。于真空60℃下干燥8h,備用。
1.2.2 吸附實驗
采用靜態批式法,取一定量的磁性伊利石儲備液和Co(Ⅱ)溶液于15mL聚乙烯離心管中,并通過微量進樣器添加HCl或NaOH溶液來調節pH值,置于恒溫振蕩器上振蕩24h,此時吸附反應達到平衡,在8000r/min下離心30min,取一定量的上層清液,采用分光光度法在波長660nm處測定上清液中Co(Ⅱ)的含量。所有實驗數據均為三次實驗的平均值,所測數據的相對誤差約為±5%。
1.2.3 數據處理
Co(Ⅱ)的吸附率(Y)的計算公式如式(1)。

Kd的表達式如式(2)。

式中,C0為Co(Ⅱ)的初始濃度,mol/L;Ce為吸附平衡后液相中Co(Ⅱ)的濃度,mol/L;kd為表觀分配系數,mL/g;V為體系體積,mL;m為吸附劑質量,g。
2 結果與討論
2.1 結構表征
2.1.1 SEM分析
圖1中(a)和(b)分別是伊利石和磁性伊利石復合材料的場發射掃描電鏡圖,(a)可以很明顯觀察到伊利石呈不規則的鱗片狀結構,而(b)則幾乎觀察不到鱗片狀結構,Fe3O4顆粒包覆在伊利石的表面,且成團聚狀,這將有利于磁性伊利石處理重金屬離子后磁分離回收。
2.1.2 紅外光譜分析
在圖2(a)中,3699cm-1左右的吸收峰為結構羥基的伸縮振動峰;在3623cm-1附近的峰是吸附水的伸縮振動峰;在3439cm-1附近處的峰對應于水在1633cm-1處的彎曲振動吸收峰;在798cm-1及779cm-1附近處的峰表明該伊利石樣品中混有石英;在695cm-1附近的峰為Si—O伸縮振動峰;在532cm-1和470cm-1附近的吸收峰為A1—O—Si和Si—O—Si的彎曲振動峰;然而,圖2(b)磁性伊利石所對應的紅外圖譜中,在516cm-1附近處出現一小峰,則為Fe—O伸縮振動峰,表明四氧化三鐵較好地復合在伊利石表面。
2.1.3 磁滯回線
由圖3知,該磁性復合粒子的飽和磁化強度為12.68emu/g,磁滯回線過原點,且以原點為中心,基本上呈中心對稱,并且幾乎沒有剩磁現象,且該粒子矯頑力為0,所合成的樣品具有良好的順磁性。

圖1 伊利石和磁性伊利石的掃描電鏡
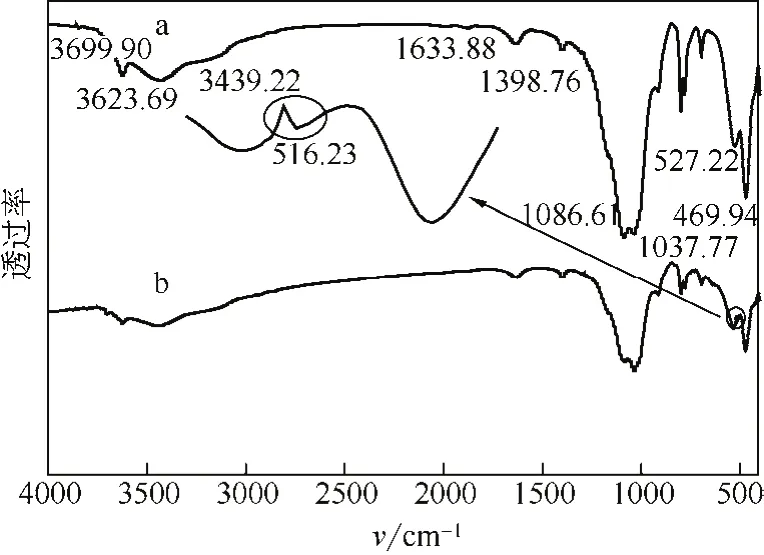
圖2 伊利石(a)和磁性伊利石復合材料(b)的紅外光譜圖
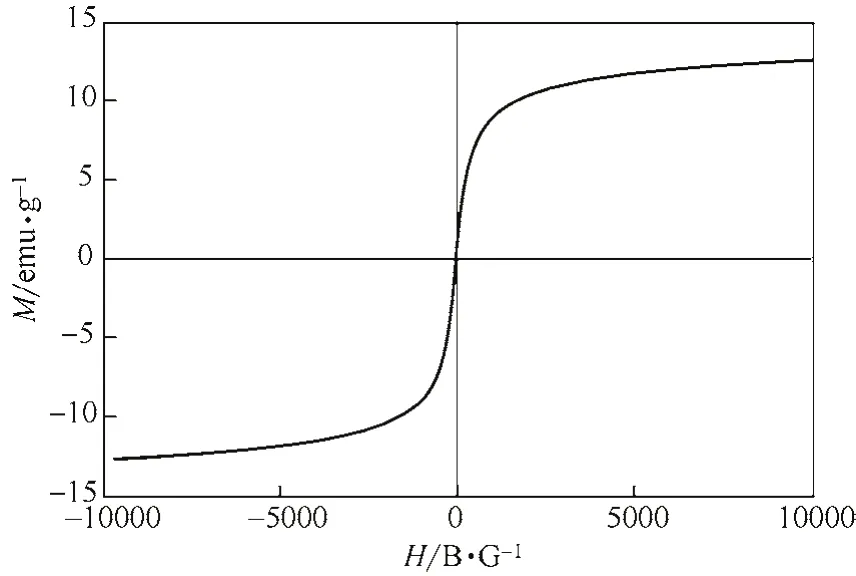
圖3 磁性伊利石復合材料的磁滯回線
2.2 初始濃度、吸附時間、pH值及溫度對Co(Ⅱ)吸附的影響
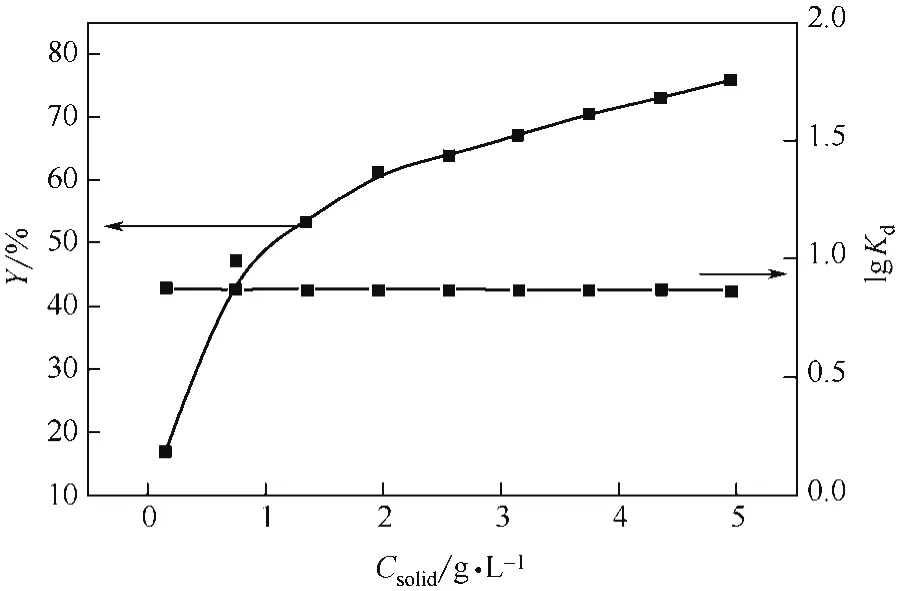
圖4 磁性伊利石濃度對Co(Ⅱ)吸附的影響
2.2.1 吸附劑初始濃度
由圖4可知,隨著吸附劑濃度的增加,吸附率逐漸增大。可能的原因是隨著吸附劑濃度的增加,吸附位點也增加,吸附質被吸附的概率增大,因而吸附量會增加。從圖4中還可以發現,分配系數Kd值會隨著吸附劑濃度的增加而逐漸減少,可能歸因于吸附劑濃度的變化,吸附劑表面官能團會存在競爭或者團聚。即增多的可吸附位點使得金屬離子的吸附率增大,同時增多的官能團之間的競爭又使得吸附劑的吸附和絡合能力下降,從而導致Kd值下降。這與伊利石和Al2O3對Co(Ⅱ)的吸附規律基本相同[14,16]。
2.2.2 吸附時間的影響及其動力學特征
圖5為吸附時間對Co(Ⅱ)在磁性伊利石上吸附的影響。由圖5中可以看出,Co(Ⅱ)的吸附率隨著吸附時間的增加而增加,并且逐漸趨于平衡的狀態。吸附在8h內達到平衡,表明Co(Ⅱ)在磁性伊利石上的吸附以化學吸附為主,物理吸附為輔[15]。Co(Ⅱ)在磁性伊利石上的吸附動力學準二階方程如式(3)。

圖5 吸附時間對Co(Ⅱ)吸附的影響和磁性伊利石吸附Co(Ⅱ)的準二級動力學方程(圖5中插圖)

式中,qt和qe分別為吸附t時和平衡時的吸附量,mg/g;t為吸附時間,h;k為吸附速率常數,g/(mg·h)。圖5內附插圖為t/qt-t的線性擬合曲線,其相關動力學參數如下:qe= 1.627mg/g,k= 0.246g/ (mg·h),R2= 0.9999,則表明準二級動力學模型能夠很好地擬合Co(Ⅱ)在磁性伊利石上的吸附動力學,同時k值也表明吸附在較短的時間內是能夠達到平衡的。實驗中對懸濁液振蕩24h可確保吸附實驗達到平衡狀態。
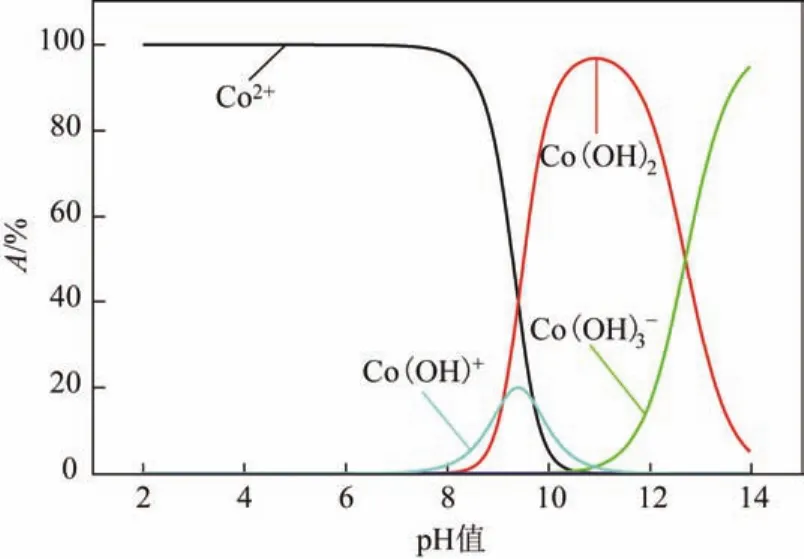
2.2.3 pH值對Co(Ⅱ)吸附的影響
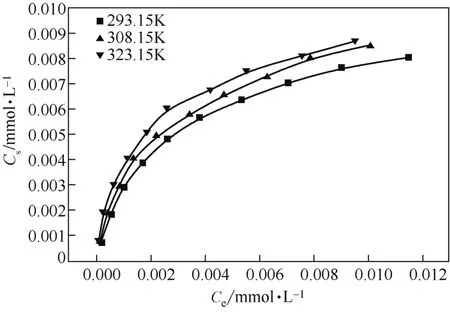
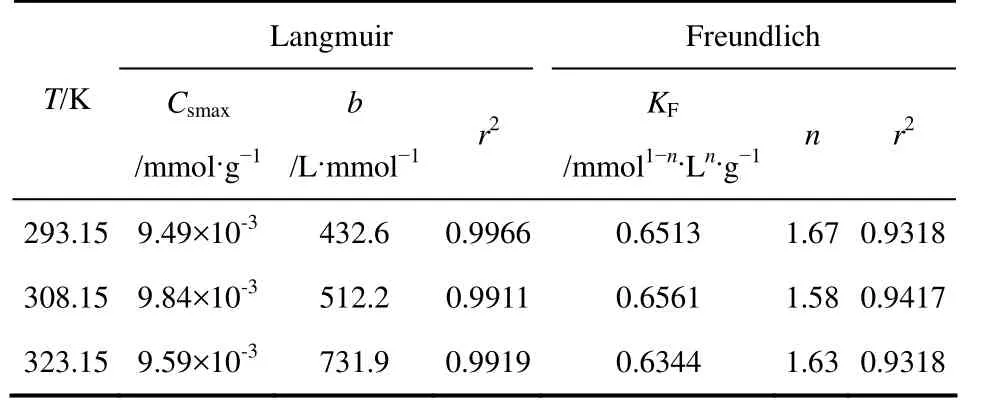
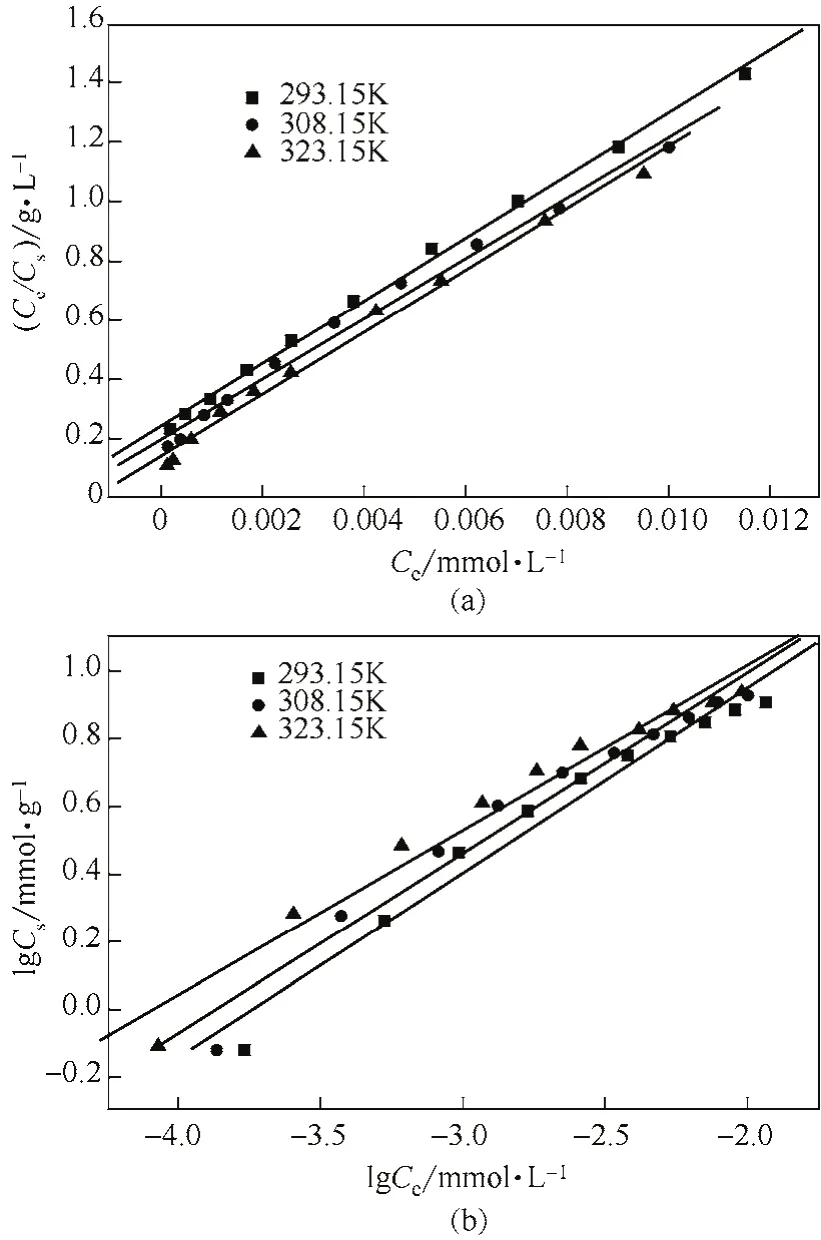
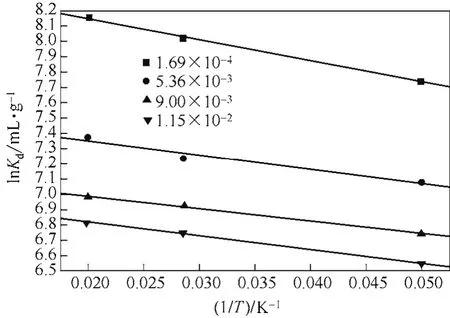
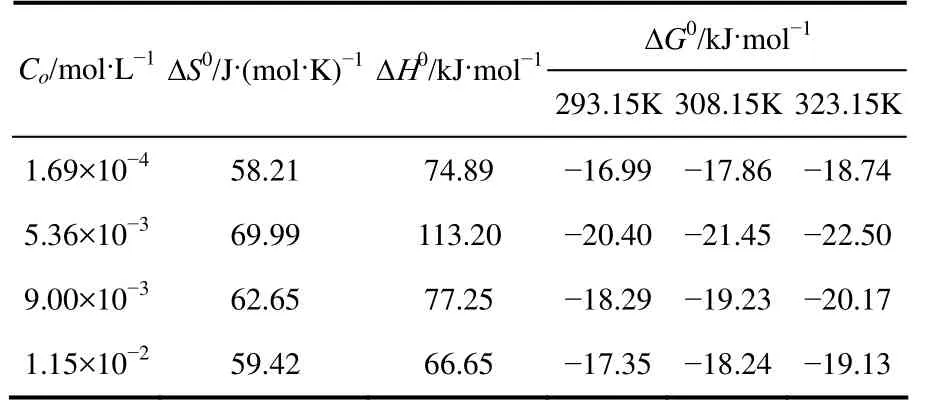
pH值對Co(Ⅱ)吸附的影響見圖6,由圖6可以看出,當3.5 2.2.4 溫度對Co(Ⅱ)吸附的影響及吸附熱力學 溫度是影響Co(Ⅱ)在磁性伊利石上吸附的一個重要因素。通過在不同溫度(T= 293.15K,308.15K,323.15K)下對Co(Ⅱ)在磁性伊利石上的吸附進行研究。實驗結果示于圖8,在Co(Ⅱ)濃度較低的情況下,溫度對吸附的影響較小,此時,影響吸附的主要因素是Co(Ⅱ)的初始濃度。但是,總的趨勢為:Co(Ⅱ)在磁性伊利石上的吸附率隨著溫度的升高而增大,即升高溫度有利于吸附。下面分別用Langmuir和Freundlich模型對實驗數據進行擬合,則結果示于圖9,相關參數于表1。 圖6 pH值對磁性伊利石吸附Co(Ⅱ)的影響 圖7 Co(Ⅱ)在不同pH值下水解相對百分比 圖9中的(a)是根據Langmuir等溫線方程所擬合的曲線,如式(4)。 圖8 Co(Ⅱ)在不同溫度下的吸附等溫線 表1 不同溫度下Langmuir 和Freundlich模擬的擬合參數 圖9 不同溫度下Co(Ⅱ)在磁性伊利石上吸附的兩種吸附模型 式中,Csmax為飽和吸附量,mmol/g;b為Langmuir常數,L/mmol。對Ce/Cs-Ce的線性擬合,則三種溫度下的r2值分別為:0.9966,0.9911,0.9919。 圖9中的(b)是根據Freundlich等溫方程所擬合的曲線,如式(5)。 式中,KF,mmol·L/g;n為常數。則它們的r2值分別為0.9318、0.9417、0.9318。說明Langmuir方程比Freundlich方程更符合磁性伊利石對Co(Ⅱ)的吸附過程。 Co(Ⅱ)在磁性伊利石上的吸附相關熱力學函數ΔH0,ΔG0,ΔS0,可以由在不同溫度下的吸附等溫線(圖10)得到,則其計算公式如式(9)、式(10)。 圖10 Co(Ⅱ)在磁性伊利石上吸附的熱力學參數 由吸附等溫線可以得出表2中的數據,由表2可知,ΔH0>0表明Co(Ⅱ)在磁性伊利石上的吸附是一個放熱過程。ΔG0<0表明Co(Ⅱ)在磁性伊利石上的吸附過程為自發過程,則高溫更有利于Co(Ⅱ)在磁性伊利石上的吸附。 (1)Co(Ⅱ)在磁性伊利石上的吸附在8h內達到平衡,并且吸附過程服從準二級動力學模型。 表2 Co(Ⅱ) 在磁性伊利石上的吸附熱力學參數 (2)pH值是影響Co(Ⅱ)在磁性伊利石上的吸附的一個重要原因,pH<8.8時,則Co(Ⅱ)在磁性伊利石上的吸附率逐漸增大,在pH = 8.8達到最大,隨后稍微降低。 (3)Co(Ⅱ)在磁性伊利石上的吸附屬于自發過程,溫度升高有利于吸附的進行,并且吸附過程符合Langmuir等溫吸附線。 [1] 楊黎燕,李仲謹,趙新法,等. 交聯淀粉微球對Co2+吸附行為的研究[J]. 離子交換與吸附,2010,26(5):401-408. [2] 鄭樂友,石互英. 鈦酸納米管對水中鈷離子的吸附研究[J]. 廣州化工,2013,41(8):96-98. [3] Zhao G X,Li J X,Ren X M,et al. Few-layered graphene oxide nanosheets as superior sorbent for heavy metal ion pollution management[J].Environment Science & Technology,2011,45:10454-10462. [4] Someda H H. Influence of the support base on the sorption of Co(Ⅱ) with mixed solvents[J].Journal of Hazardous Materials,2007,149:189-198. [5] 李娜,王凡,趙恒,等. 伊利石礦物的主要應用領域評述[J]. 中國非金屬礦工業導刊,2012(2):32-36. [6] 單傳省,林金輝,項軍,等. 川西伊利石鈦酸酯表面改性研究[J]. 中國非金屬礦工業導報,2011(1):22-24. [7] Gu X Y,Evans Les J. Modeling the adsorption of Cd(Ⅱ),Cu(Ⅱ),Ni(Ⅱ),Pb(Ⅱ),and Zn(Ⅱ) onto Fithian illite[J].Journal of Colloid and Interface Science,2007,307:317-325. [8] Konan K L,Peyratout C,Smith A,et al. Surface modifications of illite in concentrated lime solutions investigated by pyridine adsorption[J].Journal of Colloid and Interface Science,2012,382:17-21. [9] Gamze Turan N,Elevli Sermin,Mesci Basak,et al. Adsorption of copper and zinc ions on illite:Determination of the optional conditions by statistical design of experiments[J].Applied Clay Science,2011,52:392-399. [10] Ajouyed Omar,Hurel Charlotte,Marmier Nicolas. Evaluation of the adsorption of hexavalent chromium on kaolinite and illite[J].Journal of Environment Protection,2011,2:1347-1352. [11] 張暉,張麗鵬,于先進,等. 放射性核素60Co(Ⅱ)在伊利石上的吸附行為[J]. 核化學與放射化學,2011,33(3):167-172. [12] 袁志成,董愛娟,蔣澤權,等. Fe3O4/凹凸棒石磁性納米復合材料的制備與表征[J]. 化學世界,2011,10:603-606. [13] 王維清,馮啟明,趙曉東. Fe3O4/坡縷石磁性復合材料的制備及其表征[J]. 非金屬礦,2010,33(1):21-23. [14] Liu X,Chen Y T,Chi Y L,et al. Effect of pH,ionic strength,foreign ions,humic-acid and temperature on sorption of radionuclide60Co(Ⅱ) on illite[J].Journal of Radio analytical and Nuclear Chemistry,2012,292:1357-1366. [15] 劉霞,陳元濤,胡君,等. pH,離子強度,時間和溫度對Cd(Ⅱ)在伊利石上的吸附的影響[J]. 核化學與放射化學,2012,34(6):358-363. [16] Zhang C C,Liu Z J,Chen L,et al. Influence of pH,humic,ionic strength,foreign ions,and temperature on60Co(Ⅱ) sorption onto γ-Al2O3[J].J. Radioanal Nucl. Chem.,2012,292:411-419. [17] Tewari P H,Campbell A B,Lee Woon. Adsorption of Co2+by oxides from aqueous solution[J].Canadia Journal of Chemisty,1972,50:1642-1648. [18] Li P Z,Yu X J,Zhang X,et al. Impact of environmental conditions on the sorption behavior of60Co(Ⅱ) on illite[J].J. Radioanal Nucl. Chem.,2013,295:1473-1485. [19] 程翠蘭,毋偉,沈淑玲,等. 納米四氧化三鐵吸附水中汞離子的研究[J]. 北京化工大學學報,2008,35(3):5-8. Preparation of magnetic illite composite and its sorption behavior for Co(Ⅱ) HU Chunlian,CHEN Yuantao,ZHANG Wei,XIAO Jiang,CHI Yaling,HE Wenfang Magnetic illite composite was synthesized by chemicalco-precipitation and its sorption behavior was investigated. Magnetic illite composite was characterized by Fourier transfer infrared (FTIR),scanning electron microscope (SEM) and vibrating sample magnetometer (VSM). The sorption behavior of magnetic illite for Co(Ⅱ) was studied as a function of solid content,contact time,pH and temperature. The Lagrange pseudo-second order kinetic model,Langmuir isotherm and Freundlich equation were used to fit the data. The results manifested that magnetic illite composite was successfully obtained. Sorption was strongly affected by pH and temperature. The sorption of magnetic illite for Co(Ⅱ) was found to follow the Lagrange pseudo-second-order kinetic model. With respect to thermodynamics,sorption of Co(Ⅱ) increased with increasing temperature and fitted the Langmuir isotherm. magnetic composite;sorption;cobalt(Ⅱ);kinetics;thermodynamics TL941.21 A 1000-6613(2014)09-2409-06 10.3969/j.issn.1000-6613.2014.09.029 2014-01-20;修改稿日期:2014-02-10。 國家自然科學基金(20967006)及教育部“新世紀優秀人才”支持計劃(NCET-07-0476)項目。 胡春聯(1990—),女,碩士研究生。聯系人:陳元濤,教授,碩士生導師。E-mail chenyt@qhnu.edu.cn。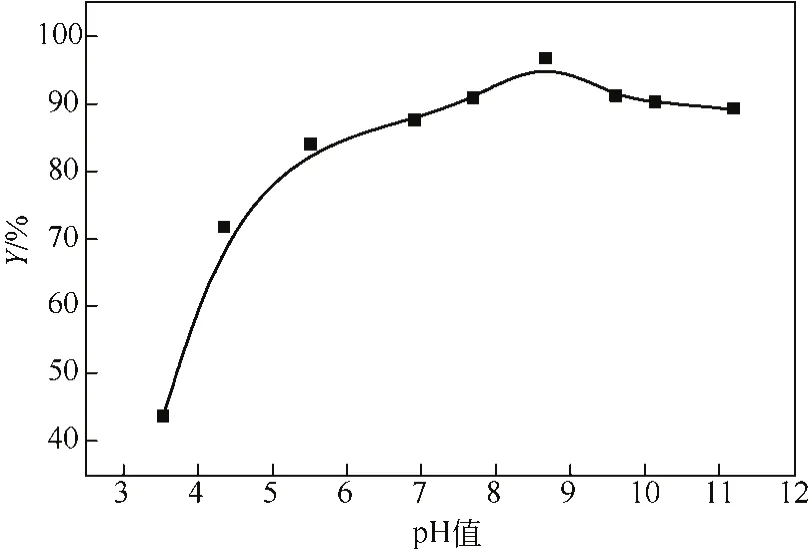
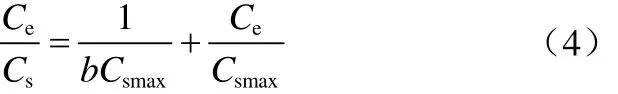

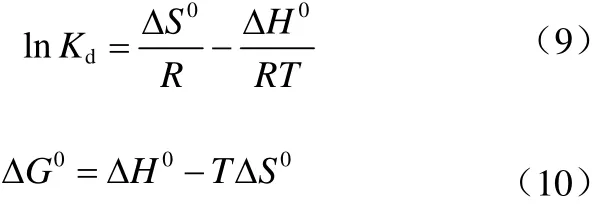
3 結 論
(Department of Chemistry,Qinghai Normal University,Xining 810008,Qinghai,China)

