蝦青素保護(hù)線粒體和抑制氧化應(yīng)激誘導(dǎo)的內(nèi)皮祖細(xì)胞凋亡*
龔志剛,丁世芳,姜其鈞,付文波
(1.南方醫(yī)科大學(xué)研究生院,廣州 510515;2.廣州軍區(qū)武漢總醫(yī)院心內(nèi)科,武漢 430070)
蝦青素保護(hù)線粒體和抑制氧化應(yīng)激誘導(dǎo)的內(nèi)皮祖細(xì)胞凋亡*
龔志剛1,2,丁世芳2,姜其鈞2,付文波2
(1.南方醫(yī)科大學(xué)研究生院,廣州 510515;2.廣州軍區(qū)武漢總醫(yī)院心內(nèi)科,武漢 430070)
目的 探討蝦青素對(duì)體外氧化應(yīng)激誘導(dǎo)人外周血內(nèi)皮祖細(xì)胞凋亡的影響及其機(jī)制。方法體外培養(yǎng)人外周血單核細(xì)胞源的內(nèi)皮祖細(xì)胞,分為正常對(duì)照組、模型組(給予叔丁基過氧化氫100μmol·L-1)、預(yù)處理組(給予叔丁基過氧化氫100μmol·L-1+蝦青素0.1,1.0,10.0 nmol·L-1預(yù)處理24 h)。噻唑藍(lán)(MTT)法檢測(cè)細(xì)胞存活率;4',6-二脒基-2-苯基吲哚(DAPI)染細(xì)胞檢測(cè)細(xì)胞凋亡率;2',7'-二氯熒光黃雙乙酸鹽(DCFH-DA)法檢測(cè)細(xì)胞內(nèi)活性氧(ROS)水平;比色法檢測(cè)半胱氨酸天冬氨酸蛋白酶(caspase-3)活性;陽離子脂質(zhì)JC-1法測(cè)定線粒體膜電位。結(jié)果MTT檢測(cè)發(fā)現(xiàn),隨著蝦青素濃度的增加,內(nèi)皮祖細(xì)胞的存活率也增加。與模型組[(48.5±4.3)%]比較,蝦青素+叔丁基過氧化氫組細(xì)胞存活率明顯升高[(57.6±8.2)%,(77.6±7.5)%,和(85.3±6.1)%,P<0.05];DAPI染細(xì)胞檢測(cè)發(fā)現(xiàn),預(yù)處理組凋亡細(xì)胞明顯減少,模型組凋亡小體形成率(27.8±3.2)%,3個(gè)預(yù)處理組凋亡小體形成率分別為[(20.4±2.9)%,(14.9±1.7)%和(7.8±0.7)%,P<0.05];caspase-3活性檢測(cè)表明,與模型組(0.345±0.018)比較,預(yù)處理組活性隨蝦青素劑量增大而依次降低[(0.291±0.013),(0.209±0.004),(0.169±0.013),P<0.05];DCHF-DA分子探針檢測(cè)細(xì)胞內(nèi)ROS發(fā)現(xiàn),與模型組比較,預(yù)處理組細(xì)胞內(nèi)ROS水平呈劑量依賴性降低,熒光強(qiáng)度明顯減弱。JC-1法線粒體膜電位檢測(cè)顯示,與模型組比較,預(yù)處理組線粒體膜電位丟失被明顯抑制。結(jié)論蝦青素通過減少細(xì)胞內(nèi)ROS,保護(hù)線粒體膜電位,下調(diào)caspase-3活性,最終起到抗氧化應(yīng)激誘導(dǎo)的EPCs凋亡。
蝦青素;氧化應(yīng)激;內(nèi)皮祖細(xì)胞;細(xì)胞凋亡;線粒體膜電位
內(nèi)皮祖細(xì)胞(endothelial progenitor cells,EPCs)在外周循環(huán)血中的數(shù)量與功能是促進(jìn)再內(nèi)皮化,使其完整性得以維持的重要因素[1]。研究表明EPCs對(duì)氧化應(yīng)激損傷敏感[2];活性氧(reactive oxygen species,ROS)水平升高是冠心病、缺血-再灌注損傷,以及經(jīng)皮冠狀動(dòng)脈介入治療損傷的共同特征[3],由此構(gòu)成的引起內(nèi)皮祖細(xì)胞損傷和凋亡的血管整體/局部氧化應(yīng)激微環(huán)境,可能是患者外周血EPCs的數(shù)量及功能明顯減少/受損的直接原因[4]。因此,探尋增強(qiáng)EPCs抗氧化應(yīng)激能力,改善其數(shù)量和功能,可能是血管損傷后再內(nèi)皮化治療藥物作用的新靶點(diǎn)[5]。蝦青素(astaxanthin,ASX)對(duì)氧化應(yīng)激引起的多種細(xì)胞如人神經(jīng)干細(xì)胞[6],臍靜脈內(nèi)皮細(xì)胞[7],腎小球系膜細(xì)胞[8],視網(wǎng)膜細(xì)胞[9]等的凋亡具有顯著保護(hù)作用。但ASX對(duì)EPCs是否具有抗氧化應(yīng)激損傷引起凋亡的作用,目前筆者尚未見報(bào)道。筆者在本研究中利用體外培養(yǎng)人外周血單核細(xì)胞源的EPCs,叔丁基過氧化氫(tert-butyl hydroperoxide,tBHP)制作氧化應(yīng)激損傷模型,觀察并探討ASX對(duì)tBHP誘導(dǎo)EPCs凋亡的保護(hù)作用及其機(jī)制。
1 材料與方法
1.1 藥物與試劑 Histopaque1077淋巴細(xì)胞分離液(美國Amersham Biosciences公司);M199培養(yǎng)液、胎牛血清、細(xì)胞培養(yǎng)板(美國Gibico公司);胰酶(上海博光生物技術(shù)公司);硫氰酸熒光(fluorescein isothocyanate,FITC)標(biāo)記荊豆凝集素I(FITC-UEA-I)、人纖維連接蛋白、ASX、叔丁基過氧化氫(tBHP)、四甲基偶氮唑鹽(methylthiazolyldiphenyl-tetrazolium bromide,MTT)均購于美國Sigma公司;乙酰化低密度脂蛋白(DiI-Ac-LDL)購于美國Molecular Probe公司;重組人血管內(nèi)皮生長(zhǎng)因子(rh-VEGF165)、重組人堿性成纖維細(xì)胞生長(zhǎng)因子(rh-b-FGF)均購于英國Pepro Tech公司;PE標(biāo)記鼠抗人CD133單克隆抗體(德國Miltenyi Biotec公司);FITC標(biāo)記鼠抗人CD34單克隆抗體(美國Southern Biotech公司);PE標(biāo)記鼠抗人VEGF-R2單克隆抗體、Caspases活性檢測(cè)試劑盒(美國R&D System公司);ROS檢測(cè)試劑盒、線粒體膜電位檢測(cè)試劑盒(JC-1)、DAPIApoptosis Detection試劑盒購自碧云天生物技術(shù)研究所。
1.2 人EPCs的分離、培養(yǎng)和鑒定 取健康志愿者外周血,以1∶2比例磷酸鹽緩沖液(phosphate buffered solution,PBS)稀釋后,緩慢移至Histopaque1077淋巴細(xì)胞分離液上方,400×g室溫離心30 min,分離出中間單個(gè)核細(xì)胞層。將分離好的單核細(xì)胞用含有10% PBS、20%胎牛血清、rh-VEGF10 ng·mL-1、rh-b-FGF 10 ng·mL-1的M199培養(yǎng)液稀釋成5×106·m L-1,放置于37℃,5%二氧化碳(CO2)孵箱中培養(yǎng);培養(yǎng)到第4天,用PBS洗去非貼壁細(xì)胞,換培養(yǎng)液繼續(xù)培養(yǎng);取第7天的細(xì)胞,加入2.4 mg·L-1DiI-Ac-LDL和10 mg·L-1FITC-UEA-I于37℃孵育1 h后,用熒光顯微鏡檢測(cè)雙染色陽性細(xì)胞百分比。另取第7天的細(xì)胞,用0.25%胰蛋白酶消化,分別加入10 mg·L-1PE標(biāo)記的VEGF-R2單克隆抗體、10 mg·L-1PE標(biāo)記的CD133單克隆抗體、10 mg·L-1FITC標(biāo)記的CD34抗體,4℃孵育30 min后,上流式細(xì)胞儀檢測(cè)細(xì)胞表面標(biāo)志物表達(dá)率。于第7天,加入無血清的培養(yǎng)液同步化細(xì)胞24 h,進(jìn)行后續(xù)實(shí)驗(yàn)。
1.3 人EPCs的tBHP損傷模型的建立 同步化后的EPCs用0.25%胰酶消化,以每孔1×103的密度接種于96孔板,分別加入濃度為30,60,120,240μmol·L-1的tBHP干預(yù)6 h,加入MTT(5 g·L-1)10μL在37℃孵育4 h后吸去上清液,加入二甲亞砜100μL,振蕩10 min溶解結(jié)晶,上酶標(biāo)儀檢測(cè)450 nm波長(zhǎng)處的吸光度(A)值。根據(jù)細(xì)胞存活情況選擇合適的tBHP作用濃度用于后續(xù)干預(yù)實(shí)驗(yàn)。細(xì)胞存活率(%)=(模型組A值/對(duì)照組A值)×100%。
1.4 ASX對(duì)正常和損傷細(xì)胞存活率的影響 待細(xì)胞長(zhǎng)到鋪滿板底70%~80%時(shí),預(yù)處理組加入終濃度分別為0.1,1.0,10.0 nmol·L-1的ASX溶液于37℃孵育24 h后,換為無血清MEM(minimum essential medium),再加終濃度為100μmol·L-1的tBHP溶液繼續(xù)培養(yǎng)6 h后,MTT法檢測(cè)細(xì)胞存活率。
1.5 細(xì)胞凋亡率的測(cè)定 藥物處理好的細(xì)胞除去培養(yǎng)基,用PBS洗2次,binding buffer重懸并調(diào)整細(xì)胞數(shù)為1×106·mL-1,然后用4%多聚甲醛固定15 min,用DAPI(2.5μg·mL-1)染核20 min,在熒光顯微鏡下攝細(xì)胞圖像,觀察細(xì)胞核形態(tài)。熒光顯微鏡下,活細(xì)胞核呈彌散均勻熒光,細(xì)胞凋亡時(shí),細(xì)胞核或細(xì)胞質(zhì)內(nèi)可見濃染致密的顆粒塊狀熒光,核出現(xiàn)不同程度的固縮,可見DNA熒光碎片(凋亡小體)。分別選取5個(gè)視野,并計(jì)數(shù)細(xì)胞100個(gè),計(jì)算細(xì)胞凋亡小體形成率,細(xì)胞凋亡小體形成率(%)=凋亡小體細(xì)胞數(shù)/總的細(xì)胞數(shù)× 100%,取5次結(jié)果的平均值來評(píng)價(jià)細(xì)胞凋亡率。
1.6 測(cè)定caspase-3活性 按caspase-3 Colorimeric Assay Kit說明書進(jìn)行。細(xì)胞1×106個(gè)溶于細(xì)胞溶解液50μL后,加入2×反應(yīng)緩沖液50μL和酶底物(DEVD-pNA)5μL,37℃孵育1 h,用酶標(biāo)儀在波長(zhǎng)405 nm下測(cè)A值。
1.7 細(xì)胞內(nèi)ROS水平測(cè)定 采用DCFH-DA檢測(cè)細(xì)胞內(nèi)ROS水平。96孔板,經(jīng)藥物處理后的各組EPCs,用10μmol·L-1DCFH-DA熒光探針的培養(yǎng)液于37℃細(xì)胞培養(yǎng)箱內(nèi)孵育20 min,用無血清細(xì)胞培養(yǎng)液洗3次以去除探針,酶標(biāo)儀檢測(cè)DCF,激發(fā)波長(zhǎng)488 nm,發(fā)射波長(zhǎng)525 nm。DCF相對(duì)熒光強(qiáng)度(%)=處理組的熒光值/對(duì)照組的熒光值×100%。
1.8 細(xì)胞線粒體膜電位的測(cè)定 采用JC-1法。接種于96孔板,經(jīng)藥物處理后的各組EPCs,除去培養(yǎng)基, PBS洗2次,滴加JC-1工作液100μL,37℃,5%CO2孵箱中培養(yǎng)20 min,1×Incubation Buffer洗2次,于熒光顯微鏡下觀察。JC-1是一種陽離子脂質(zhì)熒光染料,作為檢測(cè)線粒體跨膜電位指示劑。JC-1有單體和多聚體兩種狀態(tài),低濃度時(shí)以單體形式存在,高濃度時(shí)以多聚體形式存在,兩者的發(fā)射光譜不同,JC-1可透過正常細(xì)胞膜以單體狀態(tài)聚集胞內(nèi),正常細(xì)胞線粒體的膜電位(ΔΨ)具有極性,JC-1依賴于ΔΨ的極性被迅速攝入線粒體內(nèi),并因濃度增高而在線粒體內(nèi)形成多聚體,多聚體發(fā)射光為紅色熒光;而在線粒體膜通透性改變,線粒體膜電位去極化時(shí),JC-1從線粒體內(nèi)釋放,紅光強(qiáng)度減弱,以單體的形式存在于胞質(zhì)內(nèi)發(fā)綠色熒光,根據(jù)這一特征檢測(cè)線粒體膜電位的變化。
1.9 統(tǒng)計(jì)學(xué)方法 用SPSS13.0版統(tǒng)計(jì)分析軟件進(jìn)行分析,所有數(shù)據(jù)用均數(shù)±標(biāo)準(zhǔn)差(±s)表示,采用單因素方差分析及t檢驗(yàn),P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 EPCs的形態(tài)與鑒定 EPCs體外培養(yǎng)48 h后出現(xiàn)集落,4 d后多數(shù)集落已經(jīng)形成,于第8天后加入DiI-Ac-LDL和FITC-UEA-I染色,其中90%細(xì)胞吞噬DiI-Ac-LDL(熒光顯微鏡下呈紅色),及FITC-UEA-I (熒光顯微鏡下呈綠色)染色陽性。采用PE標(biāo)記的鼠抗人CD133,FITC標(biāo)記的鼠抗人CD34以及PE標(biāo)記的鼠抗人VEGF-R2抗體于流式細(xì)胞儀檢測(cè)細(xì)胞表面標(biāo)志,結(jié)果顯示CD133,CD34及VEGF-R2陽性率分別為(89.5±5.3)%,(66.3±6.3)%和(93.1±8.3)%。證實(shí)所分離培養(yǎng)的細(xì)胞為EPCs,見圖1。

A.DiI-Ac-LDL染色;B.FITC-UEA-I染色;C.DiI-Ac-LDL+FITC-UEA-I染色圖1 EPCs熒光染色鑒定圖A.DiI-Ac-LDL staining;B.FITC-UEA-Istaining;C.DiI-Ac-LDL+FITC-UEA-IstainingFig.1 Fluorescent staining on EPCs
2.2 tBHP損傷EPCs模型的建立 MTT檢測(cè)結(jié)果顯示不同濃度tBHP作用EPCs 6 h后,細(xì)胞存活率表現(xiàn)為隨藥物濃度增加而降低的劑量依賴關(guān)系。當(dāng)tBHP濃度在30μmol·L-1時(shí),細(xì)胞存活率為(83.6±10.1)%, 60μmol·L-1時(shí)為(65.1±8.8)%,120μmol·L-1時(shí)為(34.7±13.2)%,至最大濃度240μmol·L-1時(shí),細(xì)胞大部分死亡,細(xì)胞存活率為(6.3±4.6)%,與對(duì)照組(100%)比較,差異有統(tǒng)計(jì)學(xué)意義(P<0.05,n=6)。當(dāng)tBHP濃度約為100μmol·L-1時(shí),細(xì)胞存活率(48.5± 4.3)%(P<0.05,n=6),約維持在50%,后續(xù)實(shí)驗(yàn)選擇該條件建立tBHP誘導(dǎo)EPCs的氧化損傷模型。見圖2。
2.3 ASX對(duì)tBHP誘導(dǎo)的內(nèi)皮祖細(xì)胞存活率下降的影響 MTT結(jié)果顯示,預(yù)實(shí)驗(yàn)中給予濃度0.1,1.0, 10.0 nmol·L-1的ASX對(duì)EPCs的存活率沒有影響。與模型組比較,各實(shí)驗(yàn)濃度的ASX呈劑量依賴性提高細(xì)胞存活率,當(dāng)ASX的濃度達(dá)到10 nmol·L-1時(shí),細(xì)胞存活率從(57.6±8.2)%升高至(85.3±6.1)%(P<0.05,n=6),顯著提高EPCs存活率。
2.4 ASX對(duì)tBHP誘導(dǎo)EPCs凋亡的影響 應(yīng)用DAPI染細(xì)胞檢測(cè)ASX對(duì)tBHP引起EPCs凋亡的影響。tBHP 100μmol·L-1處理EPCs 6 h后,細(xì)胞出現(xiàn)典型的凋亡核形態(tài)學(xué)改變,與對(duì)照組比較,細(xì)胞染色質(zhì)濃縮,核固縮明顯,凋亡小體數(shù)目顯著增加,ASX預(yù)處理24 h后,可顯著改善細(xì)胞凋亡狀況,隨著作用濃度的增加,作用逐漸增強(qiáng),ASX濃度在10.0 nmol·L-1時(shí),改善最為顯著。經(jīng)過凋亡小體計(jì)算統(tǒng)計(jì),正常對(duì)照組凋亡小體形成率為(4.8±0.7)%,100μmol·L-1tBHP損傷6 h組凋亡小體形成率(27.8±3.2)%,與正常對(duì)照組比較明顯增多,差異有統(tǒng)計(jì)學(xué)意義(P<0.05,n=6), ASX在0.1,1.0,10.0 nmol·L-1預(yù)處理24 h后再加100μmol·L-1tBHP處理6 h,凋亡小體形成率分別為(20.4±2.9)%,(14.9±1.7)%和(7.8±0.7)%(P<0.05,n=6),可見ASX對(duì)tBHP誘導(dǎo)的細(xì)胞凋亡具有明顯的保護(hù)作用,見圖3。
2.5 ASX對(duì)tBHP誘導(dǎo)EPCs caspase-3活性的影響應(yīng)用紫外分光光度法檢測(cè)EPCs caspase-3活性,結(jié)果顯示:與正常對(duì)照組(0.096±0.014)比較,模型組caspase-3活性(0.345±0.018)顯著升高(P<0.05,n= 6);而經(jīng)ASX預(yù)處理24 h后,與模型組比較,隨著ASX劑量從0.1,1.0,10.0 nmol·L-1增加而caspase-3活性依次下降[(0.291±0.013),(0.291±0.013),(0.169± 0.013),P<0.05,n=6],提示ASX可通過調(diào)節(jié)caspase-3活性抑制tBHP誘導(dǎo)的EPCs細(xì)胞凋亡。
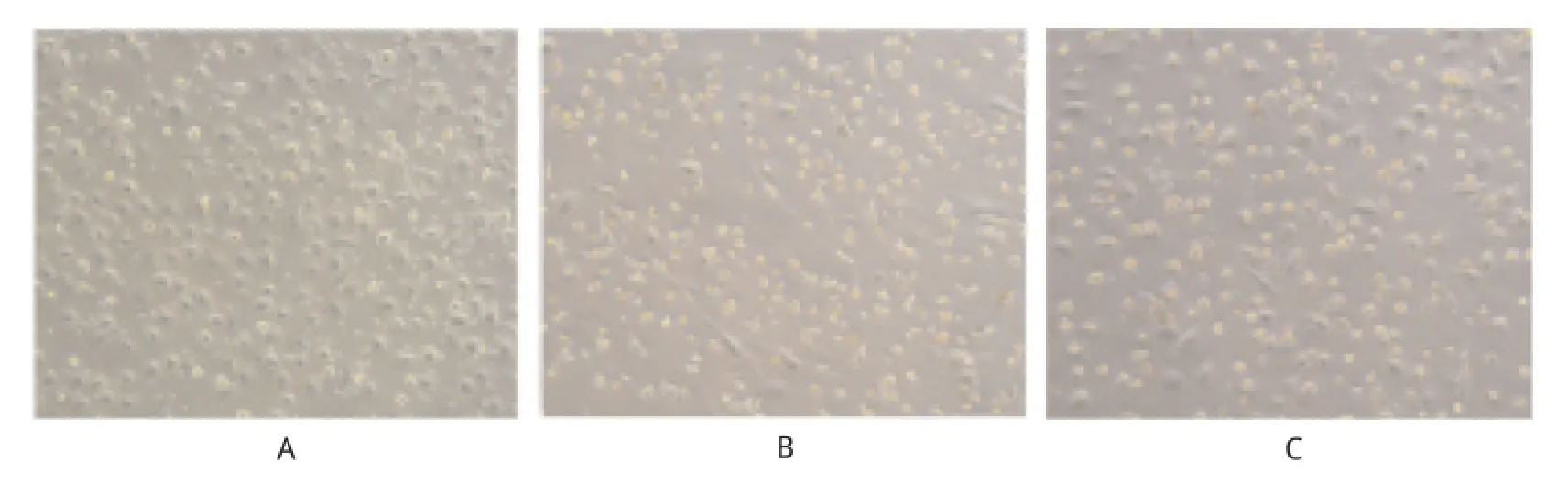
A.對(duì)照組;B.模型組;C.預(yù)處理組圖2 3組內(nèi)皮祖細(xì)胞存活檢測(cè)A.control group;B.model group;C.pretreatment groupFig.2 Detection on cell viability of three groups of EPCs

A.對(duì)照組;B.模型組;C.預(yù)處理組圖3 3組內(nèi)皮祖細(xì)胞凋亡的檢測(cè)A.control group;B.model group;C.pretreatment groupFig.3 Detection on cell apoptosis of three groups of EPCs
2.6 ASX對(duì)細(xì)胞內(nèi)ROS的影響 tBHP滲透進(jìn)入細(xì)胞,迅速轉(zhuǎn)化為叔丁氧基,并進(jìn)而促進(jìn)細(xì)胞內(nèi)ROS的形成。DCHF-DA是檢測(cè)細(xì)胞內(nèi)ROS的分子探針,其本身無熒光,當(dāng)它進(jìn)入細(xì)胞與細(xì)胞內(nèi)ROS結(jié)合時(shí),產(chǎn)生一種熒光物質(zhì)DCF,DCF的熒光強(qiáng)度反映細(xì)胞內(nèi)ROS水平。本實(shí)驗(yàn)檢測(cè)結(jié)果顯示,100μmol·L-1tBHP損傷組,EPC細(xì)胞內(nèi)ROS水平顯著增加,熒光強(qiáng)度增大;而經(jīng)ASX(0.1,1.0,10.0 nmol·L-1)預(yù)孵育組, EPCs細(xì)胞內(nèi)ROS水平呈劑量依賴性降低,ASX濃度在10 nmol·L-1時(shí),ROS水平降低最為顯著,熒光強(qiáng)度較損傷模型組明顯減弱,見圖4。
2.7 EPCs線粒體膜電位檢測(cè) 本實(shí)驗(yàn)熒光顯微鏡下觀察結(jié)果顯示正常對(duì)照組為黃綠色,模型組線粒體膜電位丟失,綠色熒光強(qiáng)度變強(qiáng),而經(jīng)10 nmol·L-1ASX預(yù)處理24 h后,其線粒體膜電位丟失得以明顯抑制,呈現(xiàn)黃綠素?zé)晒?但較對(duì)照組黃綠色稍偏綠;說明ASX能抑制tBHP引起的EPCs線粒體膜電位去極化,從而提高線粒體膜電位水平,進(jìn)而對(duì)線粒體膜電位丟失促發(fā)的EPCs凋亡具有一定的保護(hù)作用,見圖5。
3 討論
ROS是細(xì)胞凋亡中的第二信使[10]。研究證實(shí),氧化還原失衡引發(fā)的ROS過度升高(氧化應(yīng)激)可加重內(nèi)皮祖細(xì)胞凋亡和損傷,造成其數(shù)量和功能下降,嚴(yán)重影響血管內(nèi)皮修復(fù),引起再內(nèi)皮化不全或延遲,導(dǎo)致臨床心血管不良事件的發(fā)生。
ASX是一種酮式類胡蘿卜素,源自雨生紅球藻類受到較長(zhǎng)時(shí)間環(huán)境脅迫時(shí),細(xì)胞內(nèi)產(chǎn)生的一種抵御不良環(huán)境的長(zhǎng)期分子機(jī)制,具有多種生物活性,其中最重要的是其極高的抗氧化活性,可應(yīng)對(duì)細(xì)胞內(nèi)氧化應(yīng)激造成的損傷,使細(xì)胞渡過難關(guān)[11],tBHP是用于構(gòu)建細(xì)胞氧化損傷的常用試劑,其化學(xué)性質(zhì)與過氧化氫(H2O2)相似,但更穩(wěn)定,不易降解。tBHP能模擬氧化應(yīng)激損傷,直接破壞膜結(jié)構(gòu),最終導(dǎo)致細(xì)胞或線粒體膜的破壞[12]。

A.對(duì)照組;B.模型組;C.預(yù)處理組圖4 3組內(nèi)皮祖細(xì)胞內(nèi)ROS的檢測(cè)A.control group;B.model group;C.pretreatment groupFig.4 Detection on ROS in three groups of EPCs
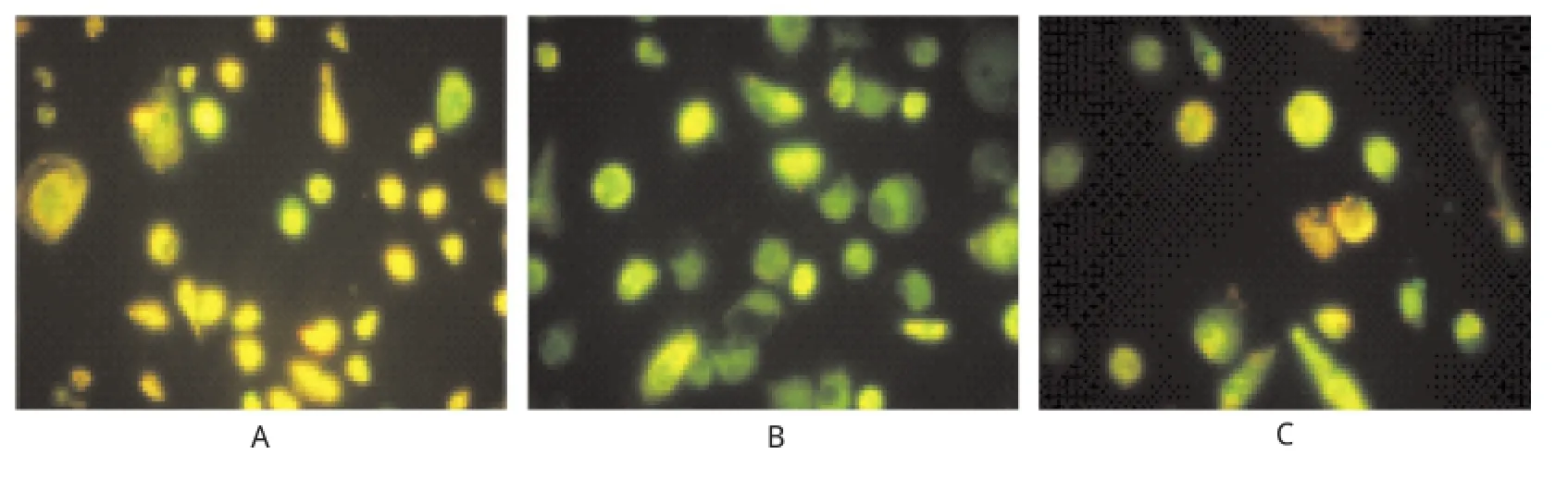
A.對(duì)照組;B.模型組;C.預(yù)處理組圖5 3組內(nèi)皮祖細(xì)胞線粒體膜電位的檢測(cè)A.control group;B.model group;C.pretreatment groupFig.5 Detection on mitochondrialmembrane potential in three groups of EPCs
細(xì)胞凋亡是多基因、多種分子參與的復(fù)雜生命過程。研究發(fā)現(xiàn),caspase-3是細(xì)胞凋亡發(fā)生和調(diào)控機(jī)制中的重要分子,是凋亡途徑下游進(jìn)行底物酶解的關(guān)鍵蛋白酶,caspase-3的激活是凋亡發(fā)生的最早期事件,它對(duì)染色質(zhì)固縮、DNA片段化起重要的執(zhí)行作用[13]。本研究通過DAPI檢測(cè)發(fā)現(xiàn)tBHP可明顯的引起內(nèi)皮祖細(xì)胞的凋亡,單純ASX對(duì)內(nèi)皮祖細(xì)胞無損傷作用,ASX對(duì)tBHP誘導(dǎo)的內(nèi)皮祖細(xì)胞凋亡具有明顯的保護(hù)作用。在ASX抑制EPCs的凋亡中發(fā)現(xiàn)ASX對(duì)caspase-3的活性有下調(diào)效應(yīng),在10.0 nmol·L-1水平能顯著抑制其激活。
研究發(fā)現(xiàn)線粒體在細(xì)胞凋亡過程中起著樞紐作用,線粒體膜電位的下降被認(rèn)為是細(xì)胞凋亡級(jí)聯(lián)反應(yīng)中的早期表現(xiàn),線粒體膜電位一旦破壞,可導(dǎo)致線粒體外膜的破裂,各種凋亡因子會(huì)隨之釋放,導(dǎo)致細(xì)胞凋亡的發(fā)生[14]。本實(shí)驗(yàn)發(fā)現(xiàn),tBHP損傷組細(xì)胞線粒體膜電位明顯低于空白對(duì)照組,而ASX保護(hù)組的細(xì)胞線粒體膜電位較損傷組有明顯的提高,可見tBHP誘導(dǎo)的氧化應(yīng)激損傷降低了EPCs線粒體膜電位,啟動(dòng)了線粒體途徑細(xì)胞凋亡,而ASX能明顯提高EPCs線粒體膜電位,抑制tBHP誘導(dǎo)的線粒體途徑細(xì)胞凋亡。
綜上所述,本研究顯示ASX通過減少細(xì)胞內(nèi)ROS,保護(hù)線粒體膜電位,下調(diào)caspase-3活性,最終起到抗氧化應(yīng)激誘導(dǎo)的EPCs凋亡。本研究為ASX抗氧化應(yīng)激損傷,改善EPCs數(shù)量和功能,促進(jìn)損傷血管再內(nèi)皮化提供了實(shí)驗(yàn)依據(jù)。
[1] BALAJI S,KING A,KESWANI S.The role of endothelial progenitor cells in postnatal vasculogenesis[J].AdvWound Care,2013,2(6):283-295.
[2] INGRAM D A,KRIER T R,MEAD L E,et al.Clonogenic endothelial progenitor cells are sensitive to oxidative stress [J].Stem Cells,2007,25(2):297-304.
[3] TURGEON J,DUSSAULT S,HADDAD P,et al.Probucol and antioxidant vitamins rescue ischemia-induced neovascularization in mice exposed to cigarette smoke: potential role of endothelial progenitor cells[J]. Atherosclerosis,2010,208(2):342-349.
[4] WERNER N,KOSIOL S,SCHIEGL T,et al.Circulating endothelial progenitor cells and cardiovascular outcomes [J].N Engl JMed,2005,353(10):999-1007.
[5] IMANISHIT,TSUJIOKA H,AKASAKA T.Endothelial progenitor cells dysfunction and senescence:contribution to oxidative stress[J].Curr Cardiol Rev,2008,4(4):275-286.
[6] KIM J H,CHOIW,LEE J H,et al.Astaxanthin inhibits H2O2-mediated apoptotic cell death in mouse neural progenitor cells viamodulation of P38 and MEK signaling pathways[J].Microb Biotech,2009,19(11):1355-1363.
[7] ADLURIR S,THIRUNAVUKKARASU M,ZHAN L,et al. Cardioprotective efficacy of a novel antioxidantmix Vitae-Pro against ex vivo myocardial ischemia-reperfusion injury [J].Cell Biochem Biophys,2013,67(2):281-286.
[8] MANABE E,HANDA O,NAITO Y,et al.Astaxanthin protectsmesangial cells from hyperglycemia-induced oxidative signaling[J].J Cell Biochem,2008,103(6):1925-1937.
[9] DONG L Y,JIN J,LU G,et al.Astaxanthin attenuates the apoptosis of retinal ganglion cells in db/db mice by inhibition of oxidative stress[J].Mar Drugs,2013,11(3): 960-974.
[10] DERNBACH E,URBICH C,BRANDES R P,et al.Antioxidative stress-associated genes in circulating progenitor cells:evidence for enhanced resistance against oxidative stress[J].Blood,2004,104(12):3591-3597.
[11] PASHKOW F J,WATUMULLDG,CAMPBELLC L.Astaxanthin:a novel potential treatment for oxidative stress and inflammation in cardiovascular disease[J].Am J Cardiol, 2008,101(10A):58-68.
[12] HAIDARAK,MOREL I,ABALEA V,et al.Mechanism of tertbutylhydroperoxide induced apoptosis in rat hepatocytes:involvement of mitochondria and endoplasmic reticulum[J].Biochim Biophys Acta,2002,1542(1):173-185.
[13] CASE A,INGRAM D A,HANELINE L S.Oxidative stress impairs endothelial progenitor cell function[J]. Antioxidants Redox Signaling,2008,10(11):1895-1907.
[14] FU D,CHEN T,SZETO H,et al.Mitochondrial targeted antioxidant peptide ameliorateshypertensive cardiomyopathy [J].J Am Coll Cardiol,2011,58(1):73-82.
DOI 10.3870/yydb.2014.06.005
Astaxanthin Inhibits Endothelial Progenitor Cell Apoptosis Induced by Oxidative Stress via Mitochondria-targeted Protective Mechanism
GONG Zhi-gang1,2,DING Shi-fang2,JIANG Qi-jun2,FU Wen-bo2
(1.Graduate School of Southern Medical University,Guangzhou 510515,China;2.Department of Cardiology,Wuhan General Hospital of Guangzhou Command,Wuhan 430070,China)
ObjectiveTo investigate the effect of astaxanthin(ASX)on endothelial progenitor cells(EPCs)injury induced by oxidative stressin vitroand to explore its underlyingmechanism.MethodsCultured EPCs isolated from peripheral blood were randomly divided into5 groups:normal control,model group[tert-butyl hydroperoxide(tBHP)100μmol·L-1],and ASX+tBHP groups(the cellswere preconditioned with ASX 0.1,1.0,and 10.0 nmol·L-1,respectively).The cell viability was measured by MT Tmethod.The level of reactive oxygen species(ROS)was determined by DCFH-DA method.The changes of mitochondrialmembrane potential(MMP)and apoptosis ratio were detected by JC-1 method and DA PImethod,respectively. caspase-3 activity changes of EPCs were detected.ResultsThe cell viability of EPCs was improved with the increasing concentration of ASX.Compared with themodel group[(48.5±4.3)%],0.1,1.0,10.0 nmol·L-1ASX significantly increased the cell viabilities[(57.6±8.2)%,(77.6±7.5)%,and(85.3±6.1)%,P<0.05].The results of DAPIstaining revealed that ASX pretreatment could significantly reduce the apoptotic rate of EPCs.The apoptotic rate of the model group was(27.8± 3.2)%,while that of ASX+tBHP groupswas[(20.4±2.9)%,(14.9±1.7)%,and(7.8±0.7)%,P<0.05],respectively.The data from caspase-3 activity assay indicated that ASX precondition could also remarkably decrease the caspase-3 activity forEPCs.The caspase-3 activity of the model group was(0.345±0.018),while that of the ASX+tBHP group were[(0.291± 0.013),(0.209±0.004),and(0.169±0.013),P<0.05],respectively.In addition,treatmentwith tBHP resulted in an increase of DCF fluorescence,while ASX precondition could decrease the DCF fluorescence,which suggested the accumulation of intercellular ROS for EPCs.Injury of michondrialmembrane resulted in the loss of mitochondrial membrane potential(MMP). The MMP detected by JC-1 method revealed that compared with model group,pretreatment of ASX inversed the reduction of MMP.ConclusionAstaxanthin inhibits endothelial progenitor cell apoptosis induced by oxidative stress through inhibiting ROS production,improving themitochondrial function and down-regulating caspase-3 activity.
Astaxanthin;Oxidative stress;Endothelial progenitor cell;Cell apoptosis;Mitochondrialmembrane potential
R966
A
1004-0781(2014)06-0712-06
2013-10-03
2013-12-18
*湖北省自然科學(xué)基金項(xiàng)目(2012FFB06803)
龔志剛(1971-),男,湖北隨州人,副主任醫(yī)師,博士,從事心內(nèi)科臨床工作。電話:(0)13397199595,E-mail:13397199595@189.cn。
丁世芳(1957-),女,山東招遠(yuǎn)人,主任醫(yī)師,教授,從事心內(nèi)科臨床研究工作。電話:027-68879415,E-mail:dingshifangmd@yahoo.com.cn。

