大孔吸附樹(shù)脂對(duì)金銀花多糖脫色工藝研究
何俊婷
(陜西新藥技術(shù)開(kāi)發(fā)中心,陜西西安 710075)
金銀花為忍冬科植物忍冬(Lonicera japonica Thunb.)的干燥花蕾或初開(kāi)的花。金銀花多糖是從金銀花中提取的結(jié)構(gòu)復(fù)雜的大分子化合物。藥理研究表明,金銀花多糖具有顯著的免疫增強(qiáng)作用、抗氧化活性及一定的抗菌作用[1-3]。采用水提醇沉法得到的金銀花粗多糖含雜質(zhì)較多,顏色深,給其深入研究及產(chǎn)品開(kāi)發(fā)帶來(lái)了困難,必須對(duì)粗提物進(jìn)行進(jìn)一步純化。而粗多糖的純化要經(jīng)歷的脫蛋白及脫色素工藝要使用大量的有機(jī)溶劑,工藝復(fù)雜繁瑣,成本高,造成環(huán)境污染。
大孔樹(shù)脂廣泛用于中草藥有效成分的分離、純化,其具有表面積大、孔隙率大、機(jī)械強(qiáng)度高、熱穩(wěn)定性好、交換速率快的特點(diǎn)。采用大孔樹(shù)脂法進(jìn)行多糖脫色,具有脫色率高、多糖保留率高的優(yōu)點(diǎn)。
本文采用大孔吸附樹(shù)脂純化金銀花多糖,通過(guò)響應(yīng)面法優(yōu)化工藝條件,為制備高純度的金銀花多糖奠定基礎(chǔ)。
1 實(shí)驗(yàn)部分
1.1 材料與儀器
金銀花,采收于山東平邑縣;LS-206、LS-46、LS-30、AB-8、D941、LXD-762、LSA-700、LSA-700B 型樹(shù)脂;無(wú)水葡萄糖、氯仿、正丁醇、乙醇、丙酮、苯酚、濃硫酸均為分析純;木瓜蛋白酶、牛血清蛋白、馬斯亮藍(lán)G-250均為生化試劑。
AG-135型電子天平;Heidolph WB-digit旋轉(zhuǎn)蒸發(fā)儀;SHB-B95真空泵;101B-2型電熱鼓風(fēng)干燥箱;Varian-50CONC型紫外分光光度儀。
1.2 實(shí)驗(yàn)方法
1.2.1 多糖提取 用水提取金銀花藥材,液料比12 mL/g,每次提取時(shí)間116 min,提取3次,提取溫度96~100℃,得到水提物,減壓濃縮至相對(duì)密度為1.08~1.12,用4倍體積量的無(wú)水乙醇沉淀,靜置,抽濾,濾餅復(fù)溶于水,采用酶-Sevage法[4]對(duì)金銀花粗多糖進(jìn)行脫蛋白。水層再次醇沉,用乙醇、乙醚、丙酮洗淋,真空干燥,得粗多糖。
1.2.2 提純[5-7]精密稱取經(jīng)預(yù)處理的樹(shù)脂1.0 g置具塞錐形瓶中,加入2 mg/mL金銀花粗多糖溶液100 mL,室溫下置于恒溫振蕩器中,頻率200 r/min振蕩,使樣品與樹(shù)脂充分吸附,過(guò)濾,取濾液測(cè)定。計(jì)算多糖保留率、多糖的脫色率及蛋白脫除率。
1.3 分析方法
1.3.1 多糖含量測(cè)定 采用苯酚-硫酸法測(cè)定[8]。
1.3.2 脫色率的測(cè)定[5]將金銀花多糖水溶液配制成一定濃度,進(jìn)行紫外-可見(jiàn)全波段(200~700 nm)掃描。結(jié)果顯示,金銀花多糖水溶液顯淺黃棕色,掃描范圍無(wú)明顯的吸收峰,無(wú)最大吸收波長(zhǎng),根據(jù)互補(bǔ)色原理,金銀花多糖水溶液吸收藍(lán)灰色波段的可見(jiàn)光,選擇波段中心360 nm為檢測(cè)波長(zhǎng),測(cè)定溶液的吸光度,計(jì)算多糖脫色率。
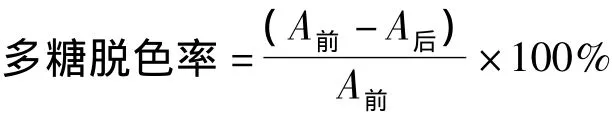
其中,A前,A后分別為脫色前后的樣品在360 nm處的吸光度值。
1.3.3 蛋白質(zhì)脫除率測(cè)定[4]脫除率的計(jì)算公式如下:
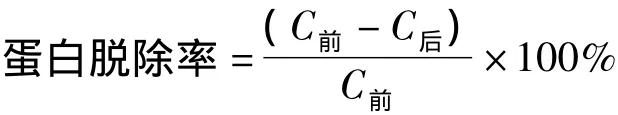
其中,C前,C后分別為脫蛋白前后蛋白質(zhì)的濃度。
2 結(jié)果與討論
2.1 樹(shù)脂篩選
7種大孔樹(shù)脂法純化金銀花多糖的效果見(jiàn)表1。
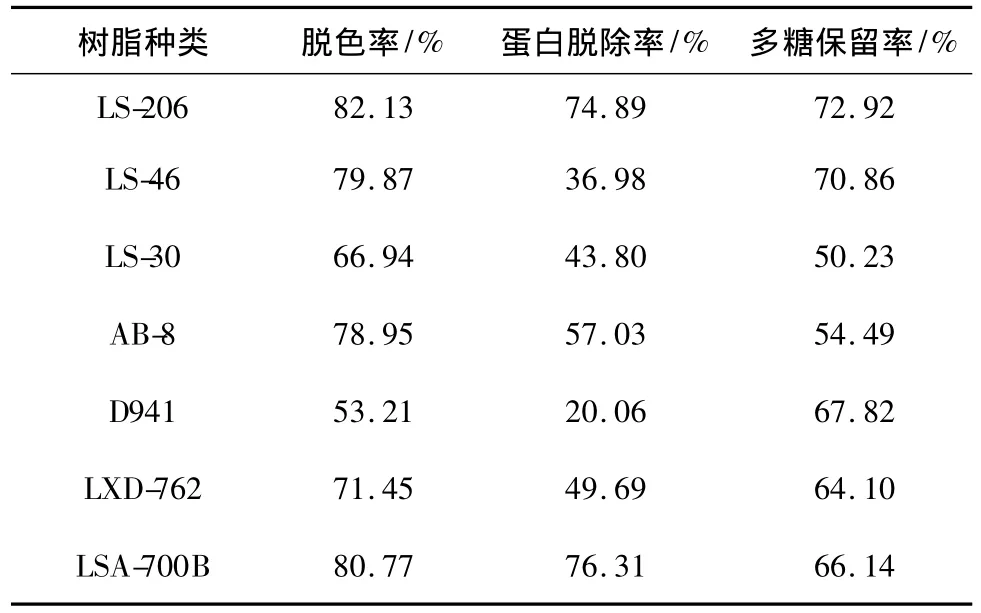
表1 7種大孔吸附樹(shù)脂純化效果Table 1 Purification effect of seven kinds of macroporous adsorption resin
由表1可知,LS-206型大孔吸附樹(shù)脂脫色率較高,達(dá)到82.13%,多糖保留率最高,蛋白脫除率可達(dá)到74.89%。因此,選擇LS-206型樹(shù)脂繼續(xù)進(jìn)行動(dòng)態(tài)吸附研究。
2.2 動(dòng)態(tài)單因素考察
2.2.1 上樣量考察 取濃度為2 mg/mL金銀花粗多糖溶液,上樣流速為1 BV/h,考察1~5 BV(BV為樹(shù)脂體積數(shù))上樣量對(duì)金銀花純化效果的影響,結(jié)果見(jiàn)圖1。
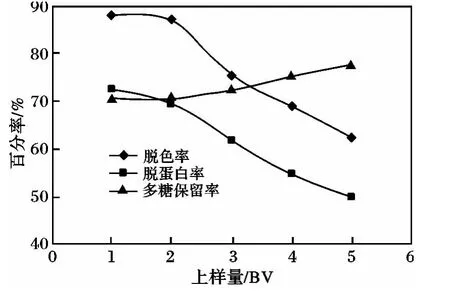
圖1 上樣量對(duì)脫色率、多糖保留率及蛋白脫除率的影響Fig.1 Effect of sample quantity on absorption of colorants,polysaccharide retention rate and protein removal rate by LS-206 resin
由圖1可知,上樣量為2 BV時(shí),多糖的脫色率在85%以上,當(dāng)上樣量達(dá)到3 BV以上時(shí)脫色率及脫蛋白率明顯下降。
2.2.2 上樣濃度考察 取2 BV多糖溶液上柱,流速為1 BV/h,考察上樣濃度對(duì)金銀花多糖純化效果的影響,結(jié)果見(jiàn)圖2。
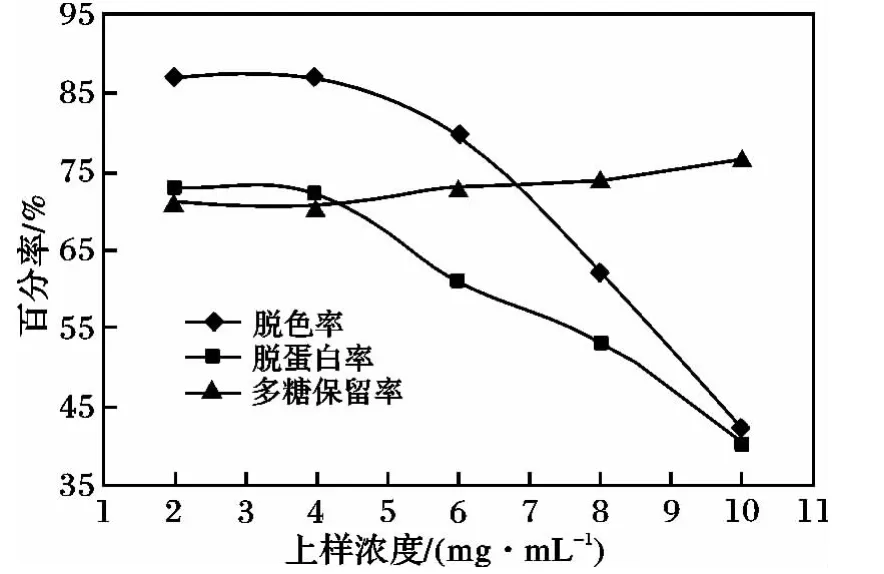
圖2 上樣液濃度對(duì)脫色率、多糖保留率及蛋白脫除率的影響Fig.2 Effect of sample solution concentration on absorption of colorants,polysaccharide retention rate and protein removal rate by LS-206 resin
由圖2可知,當(dāng)溶液濃度在4 mg/mL時(shí),純化效果較好,但隨著樣品濃度提高,脫色效果快速下降。
2.2.3 上柱流速考察 取配制濃度為4 mg/mL,樣品量為2 BV金銀花粗多糖溶液上樣,考察不同流速對(duì)金銀花多糖純化效果的影響,結(jié)果見(jiàn)圖3。
由圖3可知,流速在2 BV/h時(shí),分離效果較好,隨著流速增快,分離效果也呈現(xiàn)急速下降的趨勢(shì)。
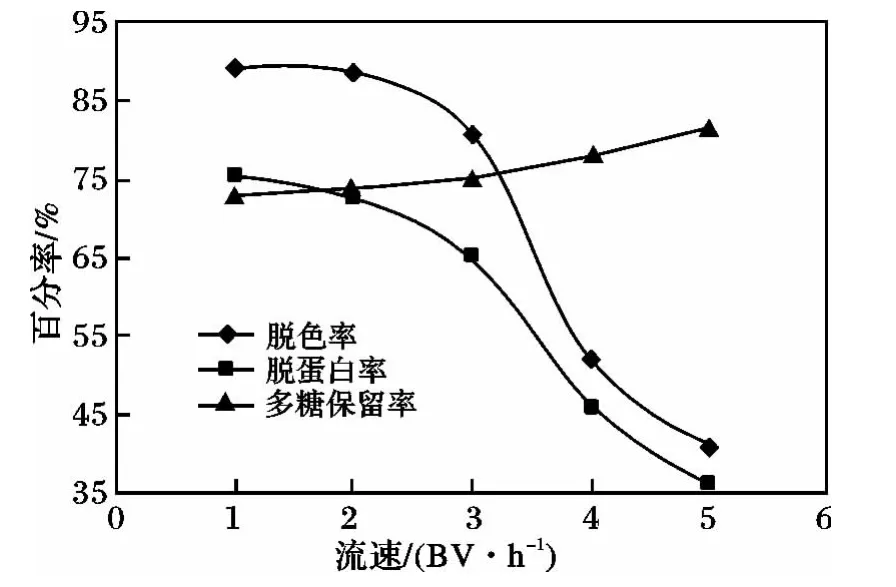
圖3 上柱流速對(duì)脫色率、多糖保留率及蛋白脫除率的影響Fig.3 Effect of solution flow rate on absorption of colorants,polysaccharide retention rate and protein removal rate by LS-206 resin
2.3 響應(yīng)面法考察動(dòng)態(tài)吸附法純化金銀花多糖
2.3.1 實(shí)驗(yàn)結(jié)果 綜合評(píng)價(jià)單因素實(shí)驗(yàn)的結(jié)果,以脫色率為指標(biāo),依據(jù)Box-Benhnken的中心組合試驗(yàn)設(shè)計(jì)原理,選取對(duì)色譜柱分離影響顯著的上樣濃度、上柱流速、上樣量3個(gè)因素,設(shè)計(jì)3因素3水平面優(yōu)化實(shí)驗(yàn),通過(guò) Design-Expert7.1.6響應(yīng)面分析軟件設(shè)計(jì)本實(shí)驗(yàn),共有17組實(shí)驗(yàn),其中12個(gè)是析因?qū)嶒?yàn),5個(gè)中心實(shí)驗(yàn)。分析因素與水平設(shè)計(jì)見(jiàn)表2,響應(yīng)面分析方案、實(shí)驗(yàn)結(jié)果見(jiàn)表3。

表2 響應(yīng)面實(shí)驗(yàn)因素與水平Table 2 Factors and levels of response surface experiment
對(duì)各因素回歸擬合后,得到回歸方程為:Y=90.89 -1.06 X1-0.74 X2-0.26 X3-1.28 X1X2-0.55 X1X3+0.38 X2X3- 1.45- 1.36-
當(dāng)P<0.000 1時(shí),所對(duì)應(yīng)條件對(duì)響應(yīng)值的作用是極其顯著的;P<0.05時(shí)所對(duì)應(yīng)條件影響為顯著。經(jīng)分析,回歸方程模型(P<0.000 1)是高度顯著的。用方程描述各單因素與響應(yīng)值之間的關(guān)系時(shí),因變量和全體自變量之間的線性關(guān)系顯著(r=76.16/77.65=0.98),表明該回歸模型可靠且顯著,用本模型來(lái)估算各因素對(duì)金銀花多糖的大孔吸附樹(shù)脂脫色過(guò)程的影響是合理的。3個(gè)因素中上樣量和上柱流速為顯著因素,3個(gè)因素對(duì)純化過(guò)程影響大小順序依次為上樣量>上柱流速>上樣濃度。上樣量平方項(xiàng)、上柱流速平方項(xiàng)、上柱流速與上樣量交互、上樣量與上樣濃度交互的影響也很顯著。
通過(guò)響應(yīng)面分析計(jì)算得,在穩(wěn)定狀態(tài)下,金銀花多糖脫色的最佳工藝條件:上樣量A=1.35 BV,上柱流速 B=1.44 BV/h,上樣濃度 C=2.95 mg/mL,最大響應(yīng)值(即脫色率)為91.10%。
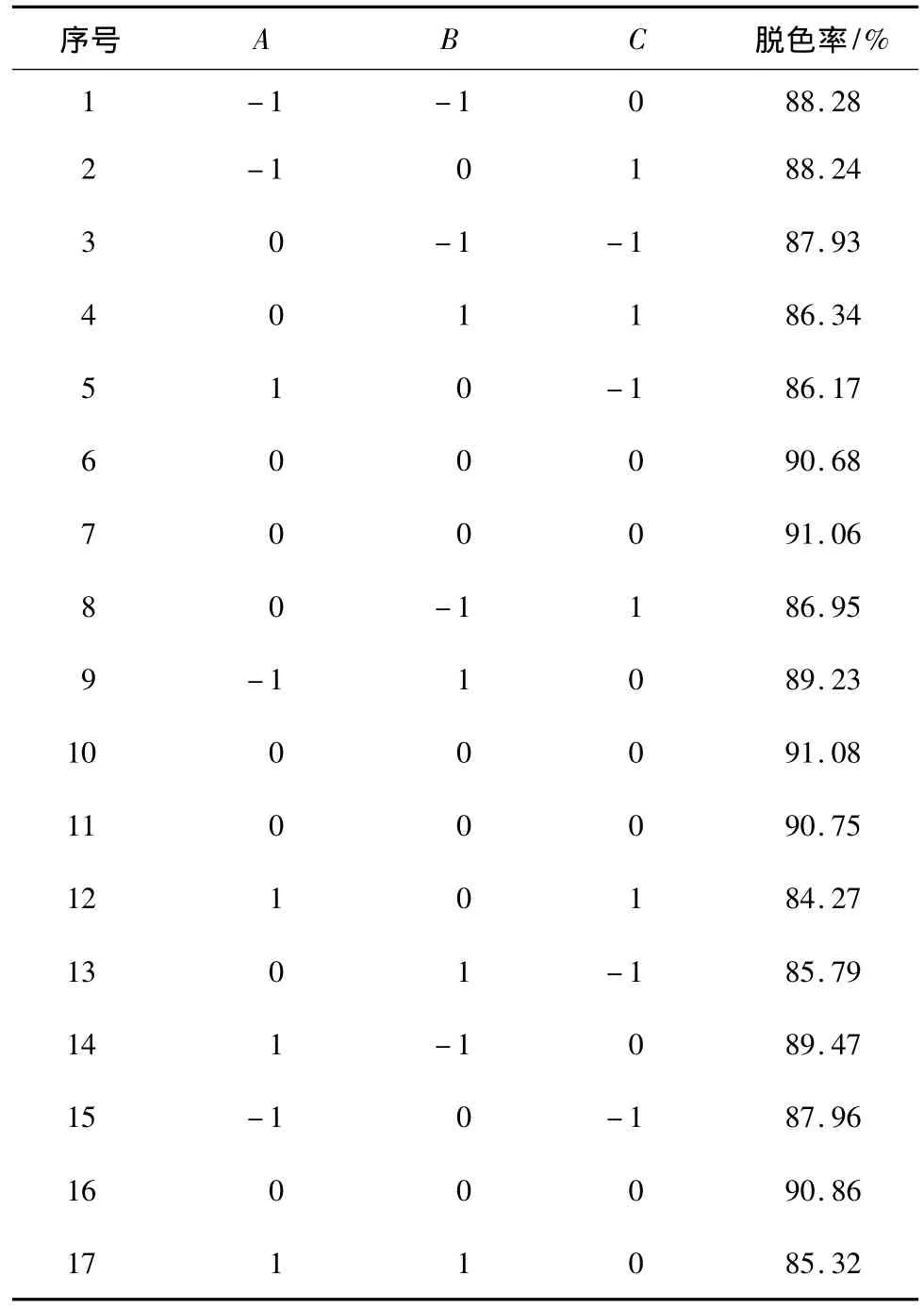
表3 響應(yīng)面優(yōu)化方案設(shè)計(jì)及響應(yīng)值Table 3 Response surface central composite design and response
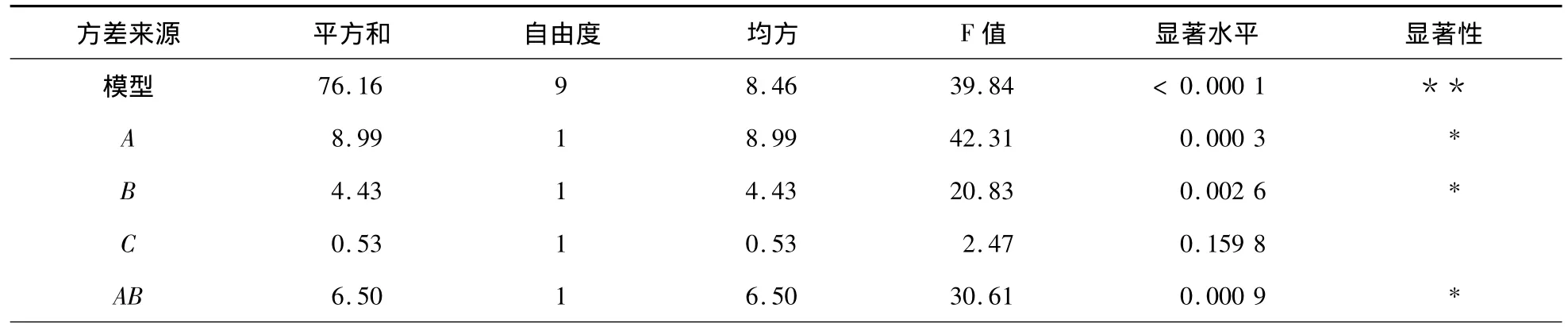
表4 方差分析表Table 4 Variance analysis table
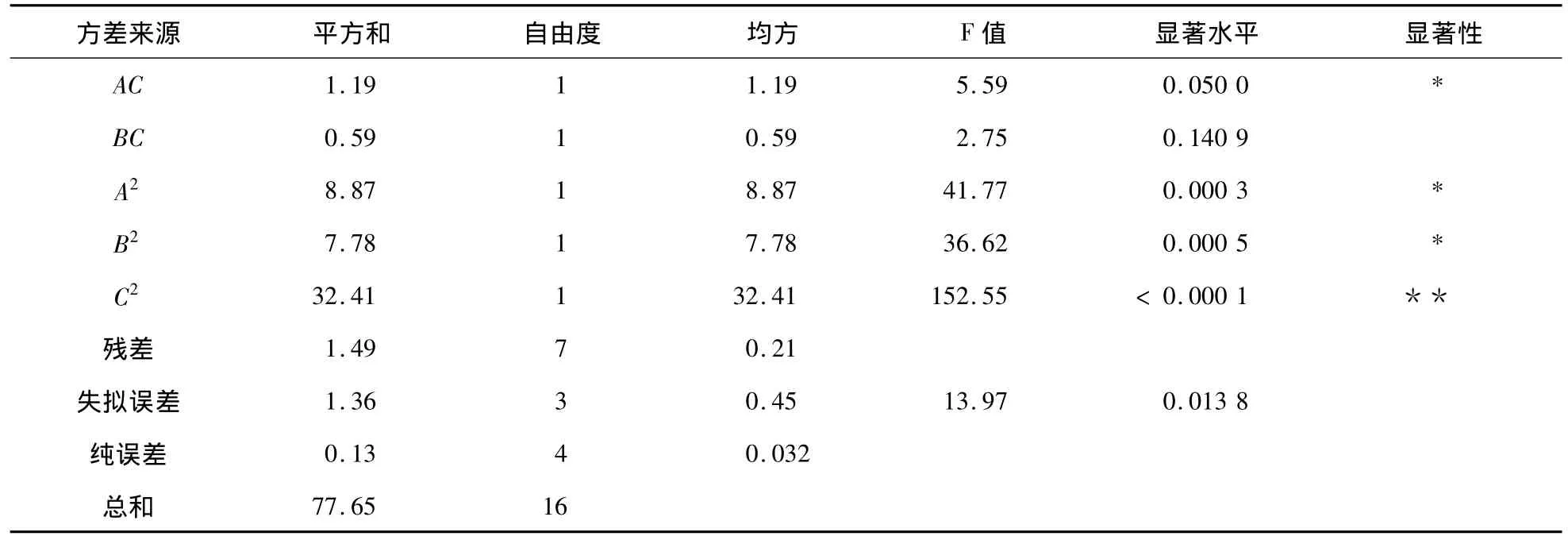
續(xù)表4
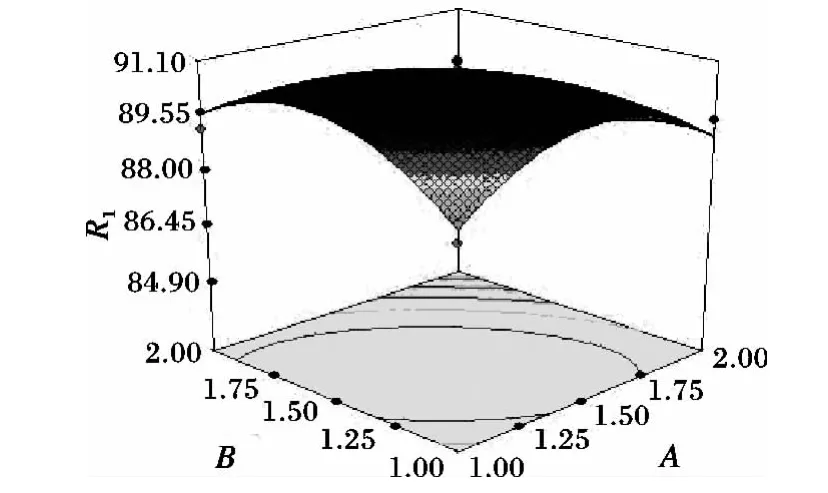
圖4 上樣量與上柱流速對(duì)脫色率的交互影響Fig.4 Interaction of sample volume and elution flow rate on decolorization rate
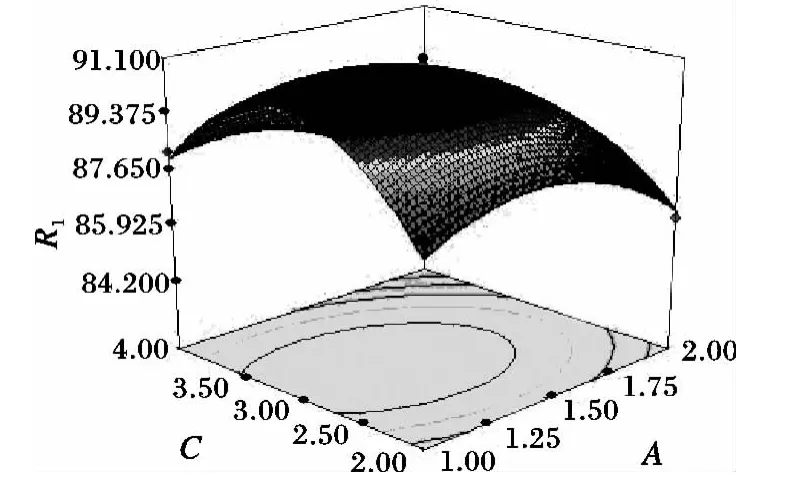
圖5 上樣量與樣品濃度對(duì)脫色率的交互影響Fig.5 Interaction of sample volume and sample solution concentration on decolorization rate
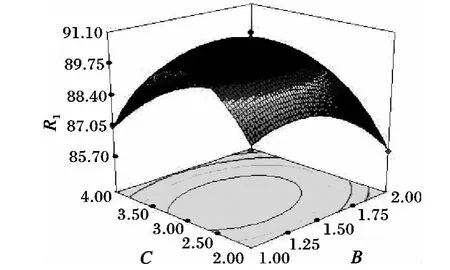
圖6 樣品濃度與上樣流速對(duì)脫色率的交互影響Fig.6 Interaction of elution flow rate and sample solution concentration on decolorization rate
2.3.2 驗(yàn)證實(shí)驗(yàn) 為操作方便,修正優(yōu)化工藝條件為:上樣量 1.4 BV,上樣流速 1.5 BV/h,上樣濃度3 mg/mL,用蒸餾水沖洗,合并收集脫色溶液,濃縮,測(cè)其脫色率,結(jié)果見(jiàn)表5。

表5 驗(yàn)證實(shí)驗(yàn)結(jié)果Table 5 Verification test results
由表5可知,3次平行實(shí)驗(yàn)結(jié)果,多糖脫色率在90%以上,平均脫色率達(dá)91.04%,經(jīng)檢測(cè)多糖保留率為81.29%,脫蛋白率為83.83%。
3 結(jié)論
大孔樹(shù)脂法工藝簡(jiǎn)單,成本低廉,可重復(fù)再生利用,純化工藝過(guò)程溫和,是有效且適宜的金銀花多糖純化方法。本研究采用靜態(tài)吸附實(shí)驗(yàn)篩選出最適合的大孔樹(shù)脂為L(zhǎng)S-206型大孔吸附樹(shù)脂,金銀花多糖脫色最優(yōu)工藝參數(shù)為:上樣量1.4 BV,上樣流速1.5 BV/h,樣品濃度3 mg/mL。在此工藝條件下,金銀花多糖脫色率為 91.04%,多糖保留率為81.29%,脫蛋白率為83.83%。為金銀花進(jìn)一步的分離純化奠定了基礎(chǔ)。
[1]殷洪梅,呂新勇,蕭偉.金銀花多糖的制備工藝優(yōu)化及免疫活性研究[J].中國(guó)中藥雜志,2010,35(4):453-455.
[2]李爾春.金銀花多糖的分離純化與生物活性研究[D].西安:陜西師范大學(xué),2009.
[3]林雄平,陳曉清,蘇育才,等.金銀花和苦丁茶多糖提取物抗菌活性研究[J].亞熱帶植物科學(xué),2008,37(1):51-53.
[4]殷洪梅,尚墻,蕭偉.金銀花多糖脫蛋白方法的研究[J].中草藥,2010,41(4):584-586.
[5]李婉婷.款冬花多糖提取及分離純化工藝研究[D].西安:西北大學(xué),2010.
[6]姚芳蓮.大孔樹(shù)脂對(duì)中藥多糖的分離純化[D].天津:天津大學(xué),2009.
[7]趙駿,蓮娜,馬躍飛,等.AB-8樹(shù)脂和D101樹(shù)脂純化桑葉多糖的比較[J].天津中醫(yī)學(xué)院學(xué)報(bào),2003,22(2):21-22.
[8]劉延吉,李峰,郭迎春,等.苯酚硫酸法測(cè)定長(zhǎng)白楤木根多糖含量的研究[J].安徽農(nóng)業(yè)科學(xué),2006,34(5):830-831.

