源地沙塵對南海東北部海域異養細菌生物量及群落結構的影響
侯瑞,白潔*,高會旺,趙陽國,張曉浩
1. 中國海洋大學海洋環境與生態教育部重點實驗室,山東 青島 266100;2. 中國海洋大學環境科學與工程學院,山東 青島 266100
海洋異養細菌是海洋生態系統中物質循環和能量流動的重要組成部分,在海洋環境中占有重要地位(趙三軍等,2003)。由于海洋異養細菌數量大、繁殖速度快、轉換效率高、生物量循環迅速,海水中的氮、磷等營養鹽常常成為影響異養細菌生長的重要限制因子(Rivkin等,1997)。沙塵沉降作為陸源營養物質和污染物質向海洋輸送的重要途徑,是海洋中這些限制性營養元素的重要來源(Griffin等,2004;高會旺等,2009)。因此,沙塵沉降對于海洋異養細菌的作用,尤其是對貧營養海域異養細菌生長的影響十分巨大。相關研究發現,沙塵沉降不僅可以顯著影響海洋異養細菌的生物量和活性(Herut等,2005;Pulido-Villena等,2010),還能夠使細菌的群落結構發生一定的變化(Lekunberri等,2010)。
南海是我國面積最大的海域,具有典型的大洋特征,屬于貧營養海區(袁梁英,2005),其海水中異養細菌數量較小且分布不均,極易受外界營養物質的影響(Yuan等,2011)。而且南海是亞洲沙塵沉降的主要區域(Gao等,1997),沙塵所攜帶的營養物質在一定程度上緩解了南海的海水營養限制(Wong等,2002),對南海貧營養海區異養細菌的生長有積極的影響。Guo等(2013)對南海北部的研究中發現,沙塵氣溶膠的添加可以促進異養細菌的生長,并使細菌的異養程度進一步加大;但由于沒有去除浮游動物的攝食壓力,其研究中并未出現異養細菌生物量的顯著增加,細菌群落結構也沒有出現明顯變化。并且,沙塵在遠距離輸運過程中與會與空氣中的污染物相互作用,使其含有重金屬和有毒有機物等,從而可能對海洋生物和生態系統產生損害效應(高會旺等,2009)。因此,為了單純考慮沙塵中營養物質對南海營養限制的緩解和對異養細菌生長的促進;在去除攝食壓力的條件下,進行源地沙塵對南海異養細菌生物量和群落結構影響的研究具有重要的科學意義。
本論文擬在已有研究的基礎上,通過對南海東北部海域海洋異養細菌進行沙塵富集模擬培養研究,在單獨添加兩種沙塵和耦合添加營養鹽與沙塵的情況下,觀察沙塵的營養物質溶出情況和培養體系內細菌生物量的變化,討論兩種沙塵對南海異養細菌生長的短期和長期影響;分析不同的沙塵添加組培養始末的細菌群落結構的變化,探討異養細菌群落結構對沙塵添加的響應機制。
1 材料與方法
1.1 沙塵采集處理
采集中國沙塵暴沙源地之一庫布奇沙漠包頭附近的表層沙塵樣品,用干凈無菌的 PET瓶 4 ℃保存。在實驗室對沙塵過網篩進行粒徑分級,分為直徑25 μm以下(標記為D1)和直徑150 μm(標記為 D2)以下的沙塵樣品,分別保存。因為小于40 μm的沙塵是能夠形成沙塵暴的粒徑范圍,所以用粒徑25 μm以下的沙塵D2代表能夠漂浮到空中形成沙塵暴的沙塵部分,用粒徑150 μm以下的沙塵樣品D1代表原位沙塵。
1.2 沙塵沉降模擬培養
于2013年3月份利用 “東方紅2號” 科學考察船 , 在 南 海 東 北 部 A1(20.50°N,120.50°E)、A2(19.00°N,120.50°E)作為采水站位(圖 1)。由CTD采水器(Seabird 25,USA)采集3 m深的表層海水并測得其初始溫度、鹽度和PH等現場數據。溶解氧DO由WTW 500i便攜水質分析儀測得。水樣采集后,通過63 μm的篩絹過濾以除去大型浮游動物,裝于1.5 L無菌的PET瓶中,在通有循環海水的培養箱中進行培養。在A1站做長時間培養,時間為7 d;A2為短時間培養站,時間為3 d。
培養共分為 6組:對照組、D1、D2、N+P、D1+N+P、D2+N+P,每個組都包含3個平行。其中,添加的D1為粒徑150 μm的沙塵、D2為粒徑25 μm的沙塵、添加的N為KNO3、P為KH2PO4。添加營養物的量為沙塵添加量為0.05 g·L-1。分別在每天的固定時間在無菌的條件下取培養系統的細菌樣品。取樣時,用WTW 500i便攜水質分析儀測定培養瓶中的溫度、鹽度、pH、DO等現場數據。在培養結束后,在無菌的條件下用0.22 μm的核孔膜過濾瓶中的海水作為分子生物學樣品,于-80 ℃保存。
培養進行的同時,參照 Lekunberri等在 2010年的沙塵營養物質溶出的方法,將兩種沙塵添加到通過0.22 μm核孔膜過濾的海水中進行溶出實驗。溶出實驗的沙塵添加量與培養條件相同,在溶出1 d后取DOC和營養鹽樣品。

1.3 DOC和營養鹽
DOC樣品用高溫燃燒氧化法由島津TOC-V型總有機碳測定儀測定(Knap等,1994)。
1.4 異養細菌生物量
將細菌樣品過濾到0.22 μm的核孔膜上,經過DAPI染色,用Leica Dmla熒光顯微鏡進行計數。用換算因子20 fg·cell-1將異養細菌數量換算為以碳單位表示的細菌的生物量(趙三軍等,2003)。
1.5 異養細菌群落結構
1.5.1 DNA提取與擴增
采用美國產環境微生物樣品總群落基因組DNA提取(PowerSoil_DNA提取)試劑盒提取總DNA。采用16S rRNA基因通用引物,以總DNA為模板,進行PCR擴增。PCR 引物采用真細菌16S rRNA 通用引物,分別為 BA101F:5’-TGGCGGACGGGTGAGTAA-3’; BA534R :5’-ATTACCGCGGCTGCTGG-3’。引物 BA534R 的5’端有一個40 bp的GC夾,由Invitrogen合成。PCR反應程序為:預變性94 ℃,5 min;并接以30個循環包括,94 ℃變性40 s,55 ℃退火40 s,每一循環降0.1 ℃,72 ℃延伸1 min,循環完畢,72 ℃延伸5 min。
1.5.2 DGGE分析
采用Bio-Rad公司DcodeTM基因突變檢測系統進行DGGE分析。電泳結束后,剝膠銀染,并掃描獲取膠圖。將DGGE圖譜數字化,以同一遷移率下,有條帶計為1,無條帶計為0。采用SPSS軟件(SPSS Inc., Chicago IL)對各泳道群落進行聚類分析,并進行 Shannon-Weiner多樣性指數(H′)分析,H′通過公式H′ = ?∑PilnPi計算,其中Pi是泳道中條帶的相對信號強度。
1.5.3 序列測定與分析
選取數量較大或變化較大的條帶回收 DNA(Schwirger等,1998)。取回收的 DNA為模板,以產生該DGGE圖譜相同的不帶GC夾的引物,采用同前體系和PCR程序進行擴增,PCR產物切膠純化(德國,Nucleo Spin ExtractⅡ,Macherey-Nagel生產)后,按產品說明書克隆 T-載體(PMD19-T,寶生物)。對轉化子的篩選采用了藍白斑及PCR的方法,PCR直接以白斑菌落為模板,采用能與 T-載體插入點兩側特異結合的M13通用引物進行檢測。每條帶選取5個陽性克隆,同樣以M13通用引物進行測序。
將所有序列提交到 RDP Ⅱ數據庫中進行在線分類,同時計算各類群的比例。下載相似序列后,采用Clustal W對齊序列并去除冗余序列后,應用MEGA 4.0軟件以相鄰法繪制系統進化樹。
1.6 數據處理
采用SPSS軟件(SPSS Inc., Chicago IL)中多因素方差分析計算各培養分組的結果之間的差異顯著性;應用 Correlate 程序計算分析不同指標類型結果之間的相關性。
2 結果與討論
2.1 站位初始環境特征和沙塵溶出情況
A1、A2站位都位于南海東北部巴士海峽區域,它是南海連通大洋的唯一深水通道,有著重要的地理位置(李立,2002)。2個站位現場環境情況見表1,其表層海水都處于高水溫、高鹽度和高pH值的狀態。A1站位的DOC、DIN和磷酸鹽濃度都處于較低的水平,與Yuan等(2011)在附近海域的觀測值(DOC:70 μmol·L-1,DIN:4 μmol·L-1,:0.1 μmol·L-1)相比;2個站位的DOC濃度均低于檢測值,A2站的DIN濃度相對較低,而2個站位磷酸鹽濃度則較高。根據Fisher等(1992)提出營養鹽的限制濃度 DIN:2 μmol·L-1,:0.2 μmol·L-1;可知A2可能受氮限制,A1可能受到磷限制。2個站位異養細菌豐度與 He等(2009)對鄰近海域的觀測值對比(異養細菌豐度:(1.6±0.8)×106cell·mL-1),可知A2站異養細菌水平正常,而A1站可能處于異養細菌暴發的狀態。

表2 1 d內沙塵溶出情況Table 2 Nutrient concentration dissolution from dust
在2個站位的沙塵溶出實驗中,添加沙塵1 d時各種營養物質的濃度均發生了一定變化(表2)。在A1站,原位沙塵D1的添加分別使DOC和DIN濃度增加了 8.25 μmol·L-1和 0.77 μmol·L-1;而小粒徑沙塵D2的添加使DOC和DIN濃度分別增加了26.76 μmol·L-1和 1.52 μmol·L-1;兩種沙塵的添加沒有使培養體系中磷酸鹽濃度得以增加。同樣在 A2站,原位沙塵D1的添加分別使DOC和DIN濃度增加了 5.71 μmol·L-1和 0.64 μmol·L-1,而小粒徑沙塵D2的添加分別使培養體系中DOC和DIN濃度增加了 17.20 μmol·L-1和 1.15 μmol·L-1;A2 站位的磷酸鹽濃度在1 d內也沒有發生明顯變化。
兩種沙塵在1 d內基本沒有溶出磷酸鹽,原位沙塵D1和小粒徑沙塵D2的添加平均分別使初始海水的DOC增加了0.21倍和0.65倍,使DIN濃度平均分別增加了0.19倍和0.36倍。結果說明,本次研究中所用的沙塵能夠在短時間內能緩解海水中的營養限制,特別是DOC和氮限制;而能夠形成沙塵暴的小粒徑沙塵在短期內溶出的營養物質比原位沙塵多,在短期內對海水異養細菌的影響更大。
2.2 異養細菌生物量的變化
根據圖2結果,沙塵和營養鹽的不同添加組均使培養體系中異養細菌生物量相對于對照組出現了明顯增長(P<0.05)。在A1站,培養周期7 d內除對照組外,各組的異養細菌生物量都出現了增長。其中D2組的細菌生物量在第3天達到最大值0.109 mg·L-1,是對照組的2.79倍;D1組在第6天才達到最大值0.099 mg·L-1,是對照組的3.19倍。然而,沙塵與營養鹽聯合添加的培養組則呈現出不同的趨勢。由于氮和磷的添加,這三個組的異養細菌生物量短期內會迅速增長,分別在第2天達到最大值; NP組為0.155 mg·L-1,是對照組的3.23倍;D1+NP組為 0.164 mg·L-1,是對照組的 3.42倍;D2+NP為 0.188 mg·L-1,是對照組的 3.92倍。與A1相似的結果,A2站的3 d的短期培養中,對照組的異養細菌生物量緩慢下降;NP組、D1+NP組和D2+NP組的細菌生物量均在第2天達到了最大值;NP組為 0.114 mg·L-1,是對照組的 3.17倍;D1+NP組為 0.120 mg·L-1,是對照組的 3.33倍;D2+NP為 0.133 mg·L-1,是對照組的 3.69倍。而D1組和D2組細菌生物量則一直呈現上升趨勢;其中在第3天時,D2組的細菌生物量為0.055 mg·L-1,是對照組的 1.96倍;D2組的細菌生物量為 0.072 mg·L-1,是對照組的2.57倍。
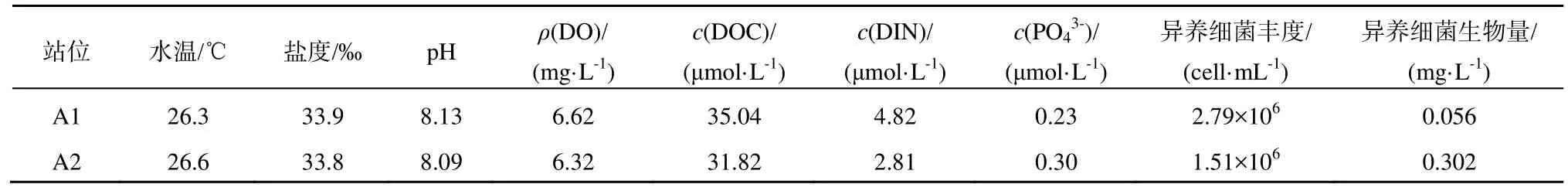
表1 站位環境初始值Table 1 Initial environmental factors of the stations
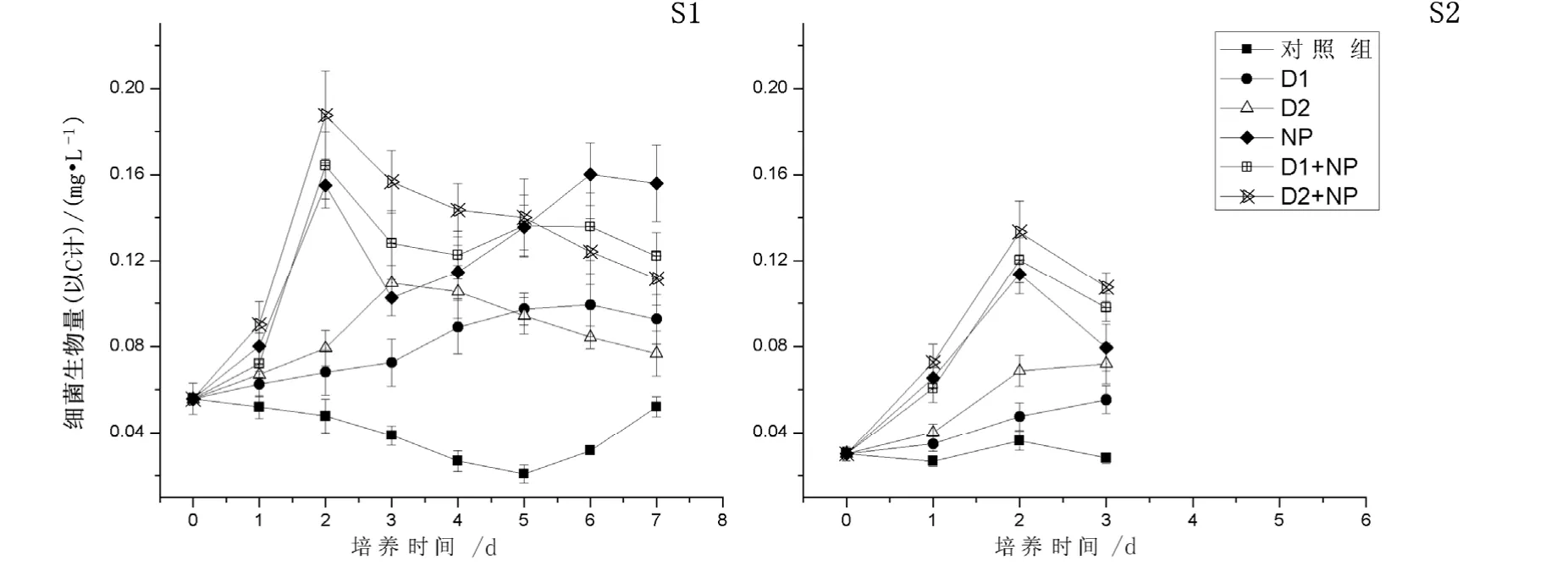
圖2 不同營養物添加組細菌生物量的變化Fig. 2 Variation of bacterial biomass among different treatments
在2個站位第3天,添加原位沙塵的D1組和添加小粒徑沙塵D2組的細菌生物量都明顯大于對照組(P<0.05),而且D2組的細菌生物量明顯大于D1組(P<0.05);在聯合添加氮和磷的情況下,添加原位沙塵的D1+NP組和添加小粒徑沙塵D2+NP組的細菌生物量比只添加氮和磷的NP組大,但不明顯(P>0.05),生物量在D1+NP組與D2+NP組之間也不存在顯著差異性(P>0.05)。這說明在營養受限制的情況下,兩種沙塵的添加均可在短期內極大地促進異養細菌的生長,而能夠形成沙塵暴的小粒徑沙塵對異養細菌生長的影響尤為明顯;在營養不受限制的情況下,沙塵的添加對細菌生物量的增加的促進作用不明顯。
在A1站培養第7天時,NP組的細菌生物量明顯大于D1+NP組和D2+NP組(P<0.05);D1組和D2組的細菌生物量明顯大于對照組(P<0.05);而細菌生物量在D1+NP組與D2+NP組之間和D1組與D2組之間都沒有顯著性差異(P>0.05)。這說明,在營養鹽受限制的情況下,沙塵的添加長期內會促進異養細菌的生長;在營養鹽充足的情況下,沙塵的添加在長期內會抑制異養細菌的生長;而小粒徑沙塵和原位沙塵對異養細菌生物量的長期影響差別不大。
2.3 細菌群落結構變化
因為在貧營養條件下沙塵對異養細菌的生物量影響更為明顯,所以本研究對A1站的D1組和D2組在培養7 d前后的細菌群落結構進行研究。圖3-A是A1站添加沙塵培養7 d前后海水中細菌群落結構變化的DGGE指紋圖譜,分別對應了A1站位分別在培養前0 d時、D1組和D2組7 d時的細菌群落結構情況。根據聚類分析圖3-B,初始0 d的樣品與2個培養7 d后樣品相似性平均為47%,而2個培養7 d后樣品之間的相似性為60%。對各樣品DGGE條帶多樣性分析的結果,培養0 d樣品的香農指數(H’)最大,7 d的培養后添加沙塵D1的D1-7d樣品的香農指數(H’)大于添加沙塵D2的D2-7d樣品。結果說明,在A1站培養初始0 d的細菌群落功能多樣性最高且與其余樣品相似度最差,添加D1和D2兩種沙塵培養7 d后的細菌群落結構會相對簡化,其中添加小粒徑沙塵 D2在培養 7 d后的細菌群落結構多樣性最低。之前研究也出現添加沙塵后,能夠利用沙塵溶出營養物質的細菌會大量地生長繁殖,使細菌群落結構趨于簡單,物種多樣性出現降低的情況(Schafer等,2001;Guo等,2013)。
從DGGE圖中可明顯分辨出10個條帶,編號為1-10。可以發現,不同樣品在 DGGE 上呈現的條帶在數目與亮度上均存在差異。細菌條帶數目的多少可以反映出樣品中優勢細菌菌群的多少,而同一位置條帶亮度的不同,則可反映出不同樣品中優勢細菌數量的差異。從整體看,樣品0 d的優勢菌最多,樣品 D1-7d、D2-7d中優勢菌較少,并且優勢菌數量和種類較為一致。對比添加沙塵培養前后細菌群落中優勢菌的變化,發現培養前的優質菌條帶1、條帶5的和條帶8代表的在培養后失去了優勢地位;條帶4、條帶10在培養前后均為優勢菌;而條帶2、條帶3、條帶6和條帶9在培養結束后成為優勢菌。這說明,在添加兩種不同沙塵后細菌的群落結構發生了一定的變化,而且兩種沙塵添加后的群落結構相似。

圖3 A1站位培養前后細菌群落DGGE (A)與聚類分析圖譜(B)Fig. 3 Bacterial DGGE profiles and Cluster analysis trees of A1 station samples
將典型條帶1-10進行克隆測序后,采用RDP中的Sequence Match程序與已知序列對比,并構建系統發育樹,結果如圖4。結果表明,這10個克隆屬于細菌界,主要分布于 α-變形菌綱( Alphaproteobacteria ) 、 γ-變 形 菌 綱(Gammaproteobacteria)、鞘脂桿菌綱(Sphingobacteria)、疣微菌綱(Verrucomicrobiae)、葉綠體(chloroplast)和放線菌(Actinobacteria)。其中,γ-變形菌綱(Gammaproteobacteria)和 α-變形菌綱(Alphaproteobacteria)一直是細菌群落中的優勢菌,并且培養后它們的優勢均進一步增大(條帶2、條帶4、條帶6和條帶9),成為培養結束后的最優勢菌群;這是因為它們都能夠快速適應對外界環境的變化,其中γ-變形菌綱能夠適應外部事件對生存環境的不規則擾動,并能直接利用外源DOC作為生長的碳源,而α-變形菌綱則會更多的從浮游植物的暴發中獲得生長需要的營養物質(Pukall等,1999)。另外,培養后鞘脂桿菌(Sphingobacteria)也成為優勢菌(條帶 3);而疣微菌綱(Verrucomicrobiae)和葉綠體(chloroplast)在沙塵添加培養后的明顯減小(條帶1、條帶5)。細菌群落結構的變化說明了沙塵的添加培養后,細菌群落中異養菌群優勢凸顯,自養菌相對衰弱,細菌群落的異養程度增大。
3 結論
1)南海東北部兩個典型站位A1、A2都屬貧營養狀態,其異養細菌豐度相對較低。本次研究中的沙塵能夠在短時間內溶出DOC和DIN,并且小粒徑沙塵D2在段時間內溶出的營養物質較多,平均使系統中DOC和DIN濃度增加了0.65倍和0.36倍。
2)添加沙塵后,2個站位的培養系統中異養細菌生物量出現不同程度增長。在短期內,兩種沙塵的單獨添加均可極大地促進異養細菌的生長,而能夠形成沙塵暴的小粒徑沙塵對異養細菌生長的影響尤為明顯;在添加氮和磷的情況下,兩種沙塵的添加對異養細菌生物量的增加的促進作用不明顯。長時間培養后,沙塵的單獨添加會促進異養細菌生物量的增加,而在添加沙塵和磷的情況下,兩種沙塵的添加會抑制異養細菌生物量的增長;而且小粒徑沙塵和原位沙塵對異養細菌生物量的長期影響差別不大。
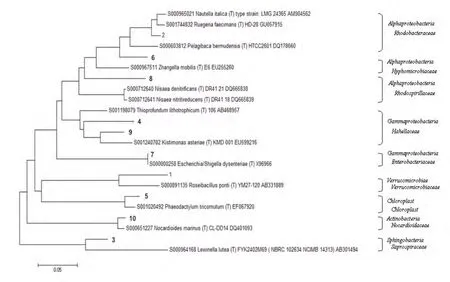
圖4 DGGE優勢條帶系統發育圖譜Fig. 4 Phylogenetic tree of constructed by the sequences of t he excised DGGE bands
3)對A1站的在單獨添加兩種沙塵培養7 d前后的細菌群落結構分析的對比發現:添加兩種沙塵后,能夠利用外源營養的 α-變形菌綱( Alphaproteobacteria) 和 γ-變 形 菌 綱(Gammaproteobacteria)成為培養結束后的優勢菌群,而且細菌群落的異養程度進一步增大;并且細菌群落的生物多樣性會降低,細菌群落結構出現簡化的趨勢。兩種沙塵的添加后細菌的群落結構的變化基本一致,而小粒徑沙塵D2的添加使得細菌群落多樣性的降低最明顯。
FISHER T R, PEELE E R.1992. Ammerman J.W., Harding LW. Nutrient limition of hytoplankton in Chesapeake Bay [J]. Marine Ecology Progress Series, 82: 51-63.
GAO Y, AROMOTO R, Duce R A, et al. 1997.Temporal and spatial distribution of dust and its deposition to the China Sea [J]. Tell Us,49B: 172-189.
GRIFFIN D W, KELLOGG C A. 2004.Dust storms and their impact on ocean and human health: Dust in earth atmosphere [J]. Eco Health, 1:284-295.
GUO C, JING H, KONG L, et al. 2013. Effect of East Asian aerosol enrichment on microbial community composition in the South China Sea [J]. Journal of Plankton Research, 35: 485-503.
HE L, YIN K, YUAN X C, LI D M, et al.2009.Spatial distribution of viruses,bacteria and chlorophyll in the northern South China Sea [J]. Aquatic Microbial Ecology, 54: 153-162.
HERUT B, ZOHARY T, KROM M D, et al. 2005. Response of East Mediterranean surface water to Saharan dust: On-board microcosm experiment and fi eld observations[J]. Deep-Sea Research II, 52:3024-3040.
KNAP A, MICHAELS A, CLOSE A, et al. 1994. Protocols for the Joint Global Ocean Flux Study (JGOFS) Core Measurement. Scientific Committee on Oceanic Research Manual and Guides[S]. Paris:UNESCO, 29: 10-243.
LEKUNBERRI I, THOMAS L, ESTELA R.2010.Effects of a dust deposition event on coastal marine microbial abundance and activity,bacterial community structure and ecosystem function [J]. Journal of Plankton Research, 32 (4): 381-396.
PUKALL R, PAE¨UKER O, BUNTEFUM D, et al. 1999. High sequence diversity of Alteromonas macleodii-related cloned and cellular 16S rDNAs from a Mediterranean seawater mesocosm experiment [J].FEMS Microbiology Ecology, 28: 335-344.
PULIDO-VILLENA E, REROLLE V, GUIEU C. 2010. Transient fertilizing effect of dust in P-deficient LNLC surface ocean [J]. Geophysical Research Letters, 37: L01603.
RIVKIN R B, ANDERSON M R. 1997. Inorganic nutrient limitation of oceanic bacterioplankton. Limnology and Oceanography [J]. 42:730-740.
SCHAFER H, BERNARD L, COURTIES C. 2001.Microbial community dynamics in Mediterranean nutrient-enriched seawater mesocosms:changes in the genetic diversity of bacterial populations [J]. FEMS Microbiology Ecology, 34 (3): 243-253.
SCHWIRGER F, TEBBE C C. 1998. A new approach to utilize PCR-single strand conformation polymorphism for 16S rRNA based microbial community analysis [J]. Applied and Environmental Microbiology, 64:4870-4876.
WONG G T F, CHUNG S W, SHIAH F K,et al. 2002. Nitrate anomaly in the upper nutricline in the northern South China Sea-evidence for nitrogen fixation [J]. Geophysical Research Letters, 29: 2097.
YUAN X, HE L, YIN K, et al. 2011. Bacterial distribution and nutrient limitation in relation to different water masses in the coastal and northwestern South China Sea in late summer [J]. Continental Shelf Research, 31: 1214-1223.
曾愛娣. 2010. AA3連續流動注射法測定水中的氨氮和總磷[J].環境研究與監測, 22 (3): 54-55.
陳廣善, 劉曉東, 陳葆德. 2006.亞洲大陸 2000-2002年春季大氣沙塵時空特征的數值模擬[J]. 環境科學, 27 (1): 18.
高會旺, 祁建華, 石金輝, 等. 2009.亞洲沙塵的遠距離輸送及對海洋生態系統的影響[J]. 地球科學進展, 24 (1): 1-10.
李立. 2002. 南海上層環流觀測研究進展[J]. 臺灣海峽, 21: 114-125.
孫西艷,洪陵成,葉宏萌. 2010.在線鎘柱還原-流動注射法測定水樣中硝酸鹽氮實驗[J].水資源保護, 26 (5): 75-77.
袁梁英. 2005. 南海北部營養鹽結構特征 [D]. 廈門: 廈門大學: 10-12.
趙三軍,肖 天,岳東海. 2003.秋季東黃海異養細菌 (heterotrophic bacteria)的分布特點[J]. 海洋與湖沼, 34(3): 295-305.

