間充質干細胞對糖尿病病變模型大鼠血視網膜屏障的影響研究
周金文,利煥廉,左 煒
(深圳市福田區人民醫院 眼科,廣東 深圳 518033)
?
間充質干細胞對糖尿病病變模型大鼠血視網膜屏障的影響研究
周金文,利煥廉*,左 煒
(深圳市福田區人民醫院 眼科,廣東 深圳 518033)
目的:通過臨床觀察,對來源于脂肪的間充質干細胞影響糖尿病視網膜病變情況進行分析,并評價其對模型大鼠血視網膜屏障的干預效果,同時進一步研究脂肪來源的間充質干細胞在視網膜中的分化情況。方法:利用STZ腹腔注射干預下誘導構建DR大鼠模型,采用尾靜脈注射來源于脂肪的間充質干細胞從而實現對模型進一步的干預,安排專人負責監測血糖變化情況。使用伊凡斯藍灌注法對模型大鼠血視網膜屏障功能進行評價,利用免疫熒光法詳細觀察來源于脂肪的間充質干細胞在視網膜中的分化情況。結果:實施干預措施之后,大鼠血糖數值出現明顯降低,視網膜中的來源于脂肪的間充質干細胞可對視網膜光感受器細胞以及膠質細胞中的獨特成分進行感應。結論:來源于脂肪的間充質干細胞能夠在DR的視網膜中明顯地對向光感受器以及膠質細胞方向進行分化,可以有效改善模型大鼠血視網膜屏障功能,對于修復模型大鼠血視網膜屏障損傷起著十分積極的作用。實施干預之后,糖尿病動物模型血糖水平出現明顯下降。
間充質干細胞;糖尿病病變;模型大鼠血視網膜屏障
為尋找在臨床治療中,不僅能夠對糖尿病視網膜病變(DR)進行治療,同時還可對DR微血管以及神經退行性改變情況進行有效干預的治療策略,對間充質干細胞對糖尿病病變模型大鼠血視網膜屏障的影響進行詳細的研究,現匯報如下。
1 材料與方法
1.1 材料
選擇50只Wistar大鼠,均為雄性,體重180~203g,平均體重(195±3.6)g,所用大鼠均由北京維通利華實驗動物技術有限公司提供,飼養于解放軍總醫院。血糖儀:德國原裝進口的羅康全活力型(第2代)血糖儀;血糖試紙:臺灣博仕瓏血糖儀試紙。其他實驗試劑、儀器均符合國家質量標準,同時此次試驗中全部步驟均符合動物實驗規范中的相關規定。
1.2 方法
對AMSCs(成人脂肪組織)進行分離以及培養,具體方法如下:選擇成人脂肪組織,采用D-Hank′S方法對其進行反復沖洗,剪碎之后,在Ⅰ型膠原酶、36℃下消化30min,洗滌、終止消化。過濾,確保ADMSCs成為單細胞懸液,并對其進行培養。經過十天的培養,待細胞融合83%~93%時,用濃度為0.26%的胰酶進行常規消化傳代。
選取42只大鼠為試驗組,尾靜脈注射來源于脂肪的間充質干細胞從而實現對模型進一步干預,安排專人負責監測血糖變化情況。使用伊凡斯藍灌注法對模型大鼠血視網膜屏障功能進行評價,利用免疫熒光法詳細觀察來源于脂肪的間充質干細胞在被觀測對象的胰腺、肝腎以及脾、眼球的分布情況和在視網膜中的分化情況。同時將剩余8只大鼠作為對照組,不進行任何干預,只對其進行血糖監測。
1.3 統計學分析
2 結果
2.1 AMSCs對大鼠血糖影響情況
試驗之前,經檢測發現試驗所用的大鼠與對照組的大鼠血糖數值比較無明顯差異。對試驗組大鼠注射AMSCs,并且每周處死4只之后,研究結果顯示,干預的第一周實驗組與對照組血糖水平比較差異明顯。且在此后第2~4周,差異依然存在。在試驗組之間,除了第一周與第二周有明顯差異,剩余三周之間的差異并不明顯。試驗組的血糖水平隨著干預時間越長,血糖數值越低,在實施干預第三周之后,血糖的下降水平出現放慢趨勢,開始呈現出穩定狀態。詳見表1。

表1 AMSCs干預對糖尿病大鼠血糖影響
注:a表示與對照組比較;b表示試驗組內部組別之間比較。
2.2 AMSCs在視網膜局部的分布以及分化情況
實施尾靜脈注射7天之后,在試驗組的視網膜外殼層中可以發現大量AMSCs集中存在,而在視網膜的內核層以及節細胞層,則可見較少的AMSCs,內核層細胞主要存在于內側,如圖1所示。同時,在視網膜中觀察發現AMSCs 可十分明顯向對祥光感受器細胞分化及膠質細胞方向進行分化。
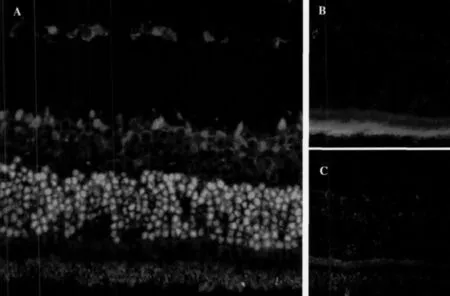
圖1 AMSCs在視網膜中的分布情況
3 討論
糖尿病視網膜病變又被稱之為DR,屬于較為嚴重的糖尿病眼部并發癥,在臨床治療中又被稱之為導致患者視力喪失的“三大重要殺手之一”[1-4]。隨著我國現代化建設不斷向前推進,人們生活水平得到了極大的改善,我國的糖尿病發病人數呈現十分明顯的上升趨勢[5-7]。盡管在醫學界研究日益深入的社會條件下,廣大醫生已經擁有了較為豐富的認知以及治療觀念,然而依然存在較大比例的患者由于各種各樣的原因而出現視力障礙[8]。
臨床研究表明,無論何種來源的干細胞都可以在治療糖尿病上發揮十分明顯的功能,S. Arnhold在研究中發現[2],使用BMSCs可以大大提升STZ誘導糖尿病小鼠身體內部胰島再生的情況,這對于改善動物模型的血糖有著十分積極的意義。本次研究發現AMSCs在DR模型中十分明顯的向光感受器和膠質細胞方向分化[3,10],此外,與對照組相比,干預的第一周兩組血糖水平比較差異明顯,并在此后的第2~4周,差異依然存在。而在試驗組之間,除了第一周與第二周有明顯差異,剩余三周之間的差異并不明顯。試驗組的血糖水平隨著干預時間越長,血糖數值越低,在實施干預第三周之后,血糖的下降水平出現放慢趨勢,開始呈現出穩定狀態。
綜上所述,來源于脂肪的間充質干細胞能夠在DR的視網膜中明顯地對向光感受器以及膠質細胞方向進行分化。可以有效地改善模型大鼠血視網膜屏障功能,對于修復模型大鼠血視網膜屏障損傷起著十分積極的作用。實施干預之后,糖尿病動物模型血糖水平出現明顯下降。
[1] FRIEDLANDER M, DORRELL MI, RITTER MR, et al. Progenitor cells and retinal angiogenesis[J]. Angiogenesis,2007,10 (2):89-101.
[2] ARNHOLD S, ABSENGER Y, KLEIN H,et al. Transplantation of bone marrow-derived mesenchymal stem cells rescue photoreceptor cells in the dystrophic retina of the rhodopsin knockout mouse[J]. Graefe’s Archive for Clinical and Experimental Ophthalmology,2007,245 (3):411-422.
[3] 田蓓,黎曉新,沈麗,等.造血干細胞對糖尿病小鼠視網膜血管內皮細胞影響的研究[J]. 中華眼科雜志,2006,42(9):818-825.
[4] HERNANDEZ C, SIMO R. Strategies for blocking angiogenesis in dibactieretino pathy:mbasie scieneetoe linieal Practice[J]. Curr OPin Investig Drugs,2012,16(8):1209-1211.
[5] ENGERMAN R,FINKELSTEIN D, AGUIRREQETAL. Oculareom plications[J].Diabetes,2012,31(SuPPI1PtZ):82-84.
[6] 馬曉萍,袁非.血管內皮生長因子與早期糖尿病大鼠視網膜屏障破壞的相關性[J].復旦學報:醫學版,2008,35(3):427-430.
[7] 劉學政,蕭鴻,王中彬,等.糖尿病早期大鼠視網膜毛細血管細胞凋亡研究[J].眼科研究,2001,19(1):35-38.
[8] 王淑靜,楊建軍,張焱.兩種中藥多糖對巨噬細胞超微結構影響的分析[J].寧夏醫學院報,2010,22(5):315-317.
[9] 邱世翠,李海濱,彭啟海,等.枸杞對小鼠淋巴細胞增殖和IL-2產生的影響[J].中國中醫藥科技,2001,8(3):266.
[10] 楊建軍,胡淑婷,張眾,等.枸杞多糖對培養心肌細胞自由基損傷的超微結構影響[J].中國中醫基礎醫學雜志,2001,7(1):37-39.
(責任編輯:魏 曉)
Effects of Mesenchymal Stem Cells on Diabetic Retinopathy in Rat Model of Blood Retinal Barrier
Zhou Jinwen,Li Huanlian,Zuo Wei
(Department of Ophathalmology, Futian Hospital of Shenzhen City, Shenzhen 518033,China)
Objective:through clinical observation, the derived from adipose mesenchymal stem cells of diabetic retinopathy were analyzed, and evaluate the rat model of blood retinal barrier effect of the intervention, and further study of adipose derived mesenchymal stem cells differentiation in the retina. Methods:using the intraperitoneal injection of STZ under the intervention of the constructed model induced by DR in rats, the cells so as to realize the model further intervention by tail vein injection derived from adipose mesenchymal, arrange personnel responsible for monitoring blood glucose changes. At the same time, choose to use the Evans blue perfusion method to evaluate the function of model rat of blood retinal barrier. At the same time with observed by immunofluorescence method, derived from adipose mesenchymal stem cells differentiation in the retina.Results:after the intervention, the numerical rats blood glucose was significantly reduced in the retina, sources in adipose mesenchymal stem cells can be induced to photoreceptor cells and glial cells of the unique composition. Conclusion:derived from adipose mesenchymal stem cells to DR in retina was to the photoreceptor and glial cell differentiation. Can effectively improve the function of model rat of blood retinal barrier, the injury model of blood retinal barrier plays a very active role. After an intervention, blood glucose levels in diabetic animal model decreased.
Mesenchymal Stem Cells; Diabetic Retinopathy; Rat Model of Blood Retinal Barrier
2014-09-23
2013年度深圳市福田區衛生公益性科研項目(FTWS201366)
周金文(1978-),深圳市福田區人民醫院主治醫師,研究方向為眼科臨床。
利煥廉(1979-),深圳市福田區人民醫院主治醫師,研究方向為眼科臨床。
R774
A
1673-2197(2014)23-0010-02

