痛風患者血清P2X7R水平的檢測及其與炎癥因子的相關性研究
彭勇 陳勇 鄔秀娣 張振 于靜雅 龔瓊瑤
痛風患者血清P2X7R水平的檢測及其與炎癥因子的相關性研究
彭勇 陳勇 鄔秀娣 張振 于靜雅 龔瓊瑤
目的 通過檢測痛風性關節炎患者血清中嘌呤能受體(P2X7R)及痛風相關炎癥因子的水平,并分析P2X7R與痛風相關炎癥因子的相關性,探討P2X7R在痛風發病中的作用。 方法 采用ELISA法檢測20例痛風初次發作患者(痛風組,包括急性發作期和完全緩解期)、20例高尿酸血癥患者(高尿酸血癥組)及20例健康志愿者(健康對照組)血清中P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平,比較痛風組患者急性發作期和完全緩解期各指標間的差異,以及痛風組患者急性發作期和完全緩解期與其他兩組間的差異;分析各組P2X7R水平與血沉、C反應蛋白、IL-1β、TNF-α、IL-6、IL-8及IL-18水平的相關性。 結果 痛風組患者急性發作期的P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平均顯著高于完全緩解期、高尿酸血癥組及健康對照組,差異均有統計學意義(均P<0.05);而痛風組患者完全緩解期、高尿酸血癥組及健康對照組的P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平組間比較均無明顯統計學差異(均P>0.05)。P2X7R表達與血沉、C反應蛋白、IL-1β及IL-18均呈正相關(均P<0.05),而與TNF-α、IL-6及IL-8無明顯相關(P>0.05)。 結論 痛風患者急性發作期血清中的P2X7R表達水平升高且與血沉、C反應蛋白、IL-1β及IL-18炎癥指標密切相關,推測P2X7R可能是痛風急性發作的一個關鍵因素,并可能成為預防痛風的急性發作的新靶點。
痛風 嘌呤能受體 高尿酸血癥 白細胞介素
痛風性關節炎是一種由高尿酸血癥引起單鈉尿酸鹽(MSU)沉積所致的晶體相關性關節病,屬自身炎癥性疾病[1]。痛風的發病機制盡管目前尚未十分明確,但近年來多數研究均認為MSU晶體可以與胞膜Toll樣(TLRs)受體以及胞內的NALP3炎癥體結合,然后通過一系列信號傳導途徑誘導白細胞介素(IL)-1β前體及IL-18等炎癥因子的轉錄、成熟及釋放從而引起痛風的急性發作[2-4]。這雖然可以解釋MSU晶體誘發痛風發作的機制,但并非所有高尿酸血癥的患者或者有MSU晶體沉積的患者就一定會發展為痛風,說明單一因素的MSU晶體沉積并不一定能誘發痛風急性炎癥的發生。因此,近年來有學者提出嘌呤能受體(P2X7R)可能是痛風急性發作的一個潛在調節器[5]。Eleftheriadis等[6]發現P2X7R抑制劑可以抑制MSU晶體誘導的淋巴細胞IL-1β的分泌和增殖。筆者通過檢測痛風患者血清中P2X7R及痛風相關炎癥因子的水平,分析P2X7R與各炎癥指標的相關性,探討P2X7R與痛風相關炎癥因子的關系及其在痛風發病過程中的作用,現報道如下。
1 對象和方法
1.1 對象 收集2013-06—2014-01我院風濕免疫科門診和住院20例初次發病的痛風患者及20例高尿酸血癥患者,痛風組患者均符合1977年美國風濕病學會痛風的診斷標準[7],并分為急性發作期和完全緩解期兩個階段,急性發作期符合以下條件:(1)痛風初次發作0~48h內,臨床表現為寡關節腫脹疼痛,患者主訴疼痛程度評分(VRS-4法)>5分;(2)炎癥指標(血沉和C反應蛋白)升高。完全緩解期為初次急性發作經正規抗炎治療7~14 d后且符合以下條件:患者主訴疼痛程度評分<1分,炎癥指標(血沉和C反應蛋白)降至正常范圍。所有患者血清尿酸水平均高于正常范圍,其中男性>420μmol/L,女性>360μmol/L。選取同期在我院健康體檢中心常規體檢的健康志愿者20例作為健康對照組。所有受試者均排除合并有心血管系統疾病、惡性腫瘤、肝病、腎功能障礙、高血壓、糖尿病、其他急慢性炎癥、感染及自身免疫性疾病等其他疾病病史者。本研究得到寧波市倫理委員會批準,所有受試者均知情同意。
1.2 標本采集 所有受試者均空腹8h以上,晨起抽取外周靜脈血5ml。室溫下待血液凝固后,3 000 r/min離心10min,收集上清液,于-80℃冰箱保存待測。痛風組急性發作期患者采血前未進行任何治療;痛風組完全緩解期患者為急性發作期患者經非甾體抗炎藥和秋水仙堿或激素正規治療7~14d后,痛風完全緩解后取血。同時記錄3組留血當日在我院進行實驗室化驗的血沉、C反應蛋白及血尿酸水平等一般資料。
1.3 監測方法和指標 采用ELISA法檢測痛風組(急性發作期和完全緩解期)、高尿酸血癥組和健康對照組血清中P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平,并記錄實驗結果。所有ELISA檢測試劑盒均購自北京索萊寶生物公司,操作嚴格按照說明書進行。
1.4 統計學處理 采用SAS 9.2統計軟件。計量資料采用表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析,兩兩比較采用SNK法。P2X7R與各項檢測指標的關系采用Pearson相關分析。
2 結果
2.1 3組間一般資料的比較 3組間年齡、性別構成的差異無統計學意義(P>0.05)。痛風急性發作期患者的血沉、C反應蛋白及血尿酸水平均高于完全緩解期(P<0.05),高尿酸血癥組患者血尿酸水平高于健康對照組(P<0.05),詳見表1。
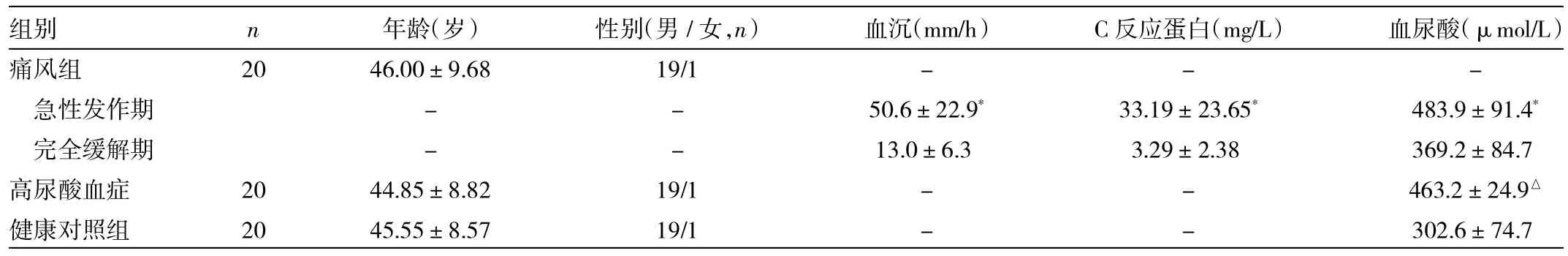
表1 3組間一般資料的比較
2.2 痛風組患者各項檢測指標結果的比較 痛風組患者急性發作期血清中P2X7R水平顯著高于完全緩解期,差異有統計學意義(P<0.01);痛風組患者急性發作期血清中IL-1β、TNF-α、IL-6、IL-8及IL-18等炎癥因子水平也均顯著高于完全緩解期,差異有統計學意義(P<0.05),詳見圖1。
2.3 3組各項檢測指標結果的比較 痛風組患者急性發作期血清中P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平均顯著高于高尿酸血癥組和健康對照組,差異均有統計學意義(均P<0.05);而痛風組患者完全緩解期血清中P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平與高尿酸血癥組及健康對照組比較,差異均無統計學意義(均P>0.05),詳見表2。
2.4 P2X7R與其他炎癥指標的相關性 相關性分析發現,各組P2X7R水平與血沉、C反應蛋白、IL-1β及IL-18水平呈正相關(r=0.58、0.671、0.451、0.796,均P<0.05),而與TNF-α、IL-6及IL-8水平均無明顯相關性(r= 0.305、0.373、0.420,均P>0.05)。
3 討論
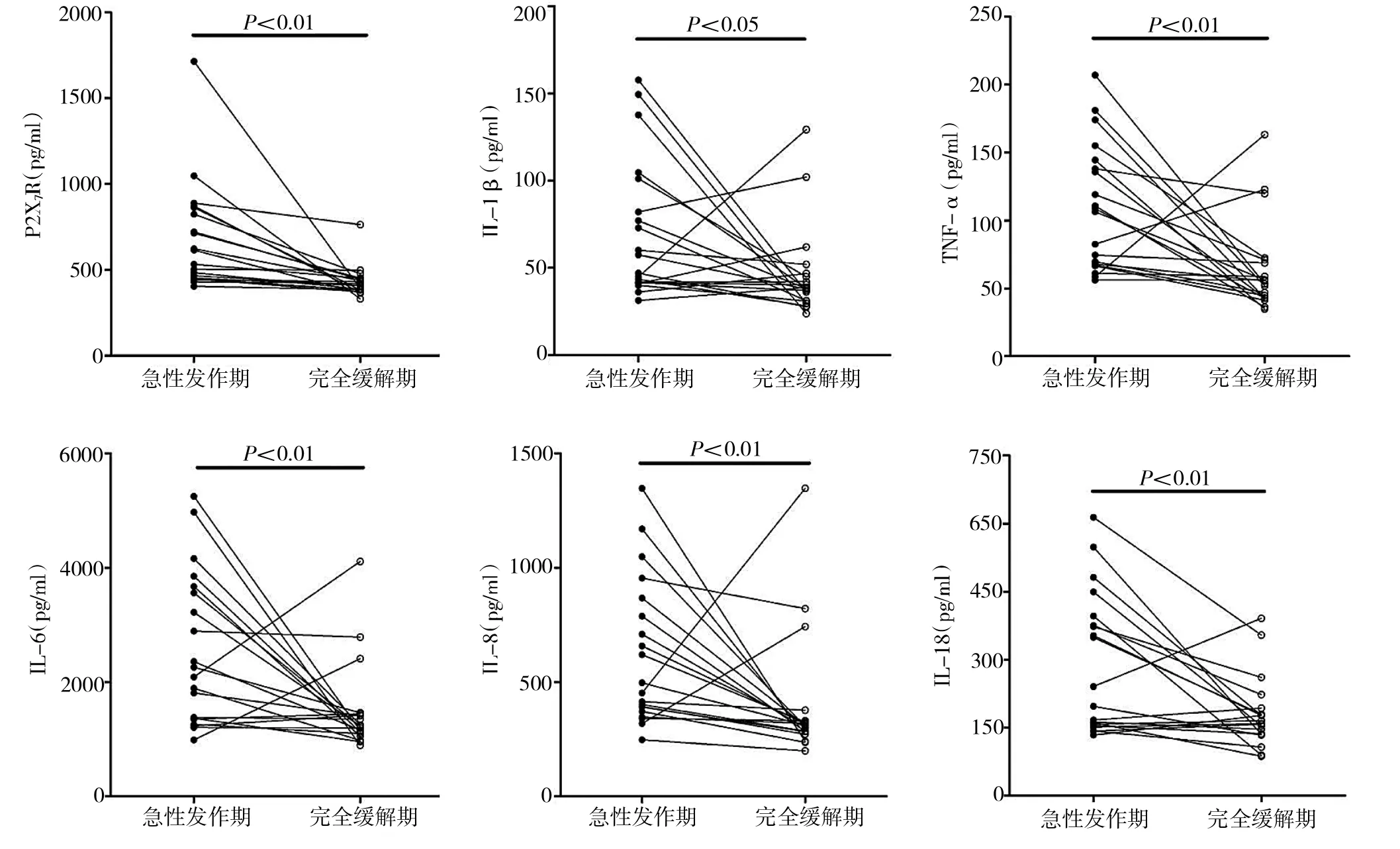
圖1 痛風組急性發作期與完全緩解期各項檢測指標結果的比較

表2 3組間各項檢測指標結果的比較(pg/ml)
早在20世紀60年代有學者發現在人和狗的關節內注射MSU晶體后,注射關節會出現類似于痛風急性發作的臨床表現,MSU晶體沉積也因此被認為是痛風的關鍵致病因素。目前的研究已證實長期血尿酸增高而引起的MSU晶體沉積可以被NALP3炎癥體識別,然后誘導體內IL-1β的轉錄、成熟及釋放從而誘發痛風;而IL-1β則被認為是痛風炎癥發生的核心因子[8]。但一項來自歐洲的流行病學調查顯示血尿酸水平>590μmol/L的高尿酸血癥患者痛風5年累積患病風險也僅為30.5%[9]。臨床上發現相當一部分高尿酸血癥患者甚至有MSU沉積的患者也并沒有發展為痛風,說明單一因素的MSU沉積還不足以誘導足夠數量的IL-1β釋放來誘發痛風的急性發作。因此,痛風急性發作可能還需要其他因素的共同參與。
目前普遍觀點認為劇烈運動、寒冷刺激、酗酒及暴飲暴食等誘因是通過引起血液中血尿酸水平升高而誘發痛風急性發作,但目前有學者提出這些誘因可能是通過引起體內ATP水平劇烈變化而參與痛風急性發作,而并非通過提高血尿酸水平[5]。ATP可以與其天然受體P2X7R結合促使通道開放引起K+外流,與NALP3炎癥體共同作用刺激IL-1β的大量成熟及釋放[10-11]。P2X7R作為一個配體門控離子通道受體,且大量表達于巨噬細胞及單核細胞等炎癥細胞。目前已經在多種疾病研究中發現P2X7R參與了包括IL-1β、TNF-α、IL-6及IL-18等炎癥因子的產生和釋放[12-14],而這些炎癥因子也參與痛風炎癥過程。
本次研究通過檢測痛風組(急性發作期和完全緩解期)、高尿酸血癥組和健康對照組血清中P2X7R水平發現,痛風患者初次急性發作期P2X7R水平顯著高于完全緩解期,同時也顯著高于高尿酸血癥組和健康對照組,推測P2X7R可能參與了痛風的急性發作。此外,對P2X7R與各個炎癥指標進行相關分析,分析結果表明P2X7R與血沉及C反應蛋白呈正相關,這進一步表明P2X7R可能參與痛風炎癥過程。同時,筆者還發現P2X7R水平與IL-1β及IL-18水平呈正相關,而與TNF-α、IL-6及IL-8則無明顯相關,推測P2X7R可能與IL-1β及IL-18的產生及釋放有關。
綜上所述,P2X7R在痛風急性發作期的表達升高且與痛風炎癥密切相關,還可能參與了IL-1β及IL-18等痛風相關炎癥因子的產生和釋放;因此,推測P2X7R可能在痛風發病過程起著關鍵的調節作用。本研究為進一步研究P2X7R在痛風發病過程中的意義提供了實驗和理論依據,也為急性痛風發作的臨床防治提供了一條可行的新策略。本文對P2X7R在痛風發病過程中的作用僅進行初步研究,且樣本量較小,故仍需進一步進行大樣本及機制方面的深入研究。
[1]Masters S L,Simon A,Aksentijevich I,et al.Horror autoinflammaticus:the molecular pathophysiology of autoinflammatory disease [J].Annu Rev Immunol,2009,27:621-668.
[2]Martinon F,Petrilli V,Mayor A,et al.Gout-associated uric acid crystals activate the NALP3 inflammasome[J].Nature,2006,440 (7081):237-241.
[3]Kingsbury S R,Conaghan P G,Mc Dermott M F.The role of the NLRP3 inflammasome in gout[J].J Inflamm Res,2011,4:39-49.
[4]Mitroulis I,Kambas K,Ritis K.Neutrophils,IL-1beta,and gout:is there a link[J]?Semin Immunopathol,2013,35(4):501-512.
[5]Tao J H,Zhang Y,Li X P.P2X7R:a potential key regulator of acute gouty arthritis[J].Semin Arthritis Rheum,2013,43(3):376-380.
[6]Eleftheriadis T,Pissas G,Karioti A,et al.Uric acid induces caspase-1 activation,IL-1beta secretion and P2X7receptor dependent proliferation in primary human lymphocytes[J].Hippokratia, 2013,17(2):141-145.
[7]Wallace S L,Robinson H,Masi A T,et al.Preliminary criteria for the classification of the acute arthritis of primary gout[J].Arthritis Rheum,1977,20(3):895-900.
[8]Mitroulis I,Kambas K,Chrysanthopoulou A,et al.Neutrophil extracellular trap formation is associated with IL-1beta and autophagy-relatedsignalingingout[J].PLoSOne,2011,6(12):e29318.[9]Annemans L,Spaepen E,Gaskin M,et al.Gout in the UK and Germany:prevalence,comorbidities and management in general practice 2000-2005[J].Ann Rheum Dis,2008,67(7):960-966.
[10]Kahlenberg J M,Dubyak G R.Mechanisms of caspase-1 activation by P2X7receptor-mediated K+release[J].Am J Physiol Cell Physiol,2004,286(5):C1100-1108.
[11]Petrilli V,Papin S,Dostert C,et al.Activation of the NALP3 inflammasome is triggered by low intracellular potassium concentration[J].Cell Death Differ,2007,14(9):1583-1589.
[12]Friedle S A,Brautigam V M,Nikodemova M,et al.The P2X7-Egr pathway regulates nucleotide-dependent inflammatory gene expression in microglia[J].Glia,2011,59(1):1-13.
[13]Gourine A V,Poputnikov D M,Zhernosek N,et al.P2 receptor blockade attenuates fever and cytokine responses induced by lipopolysaccharide in rats[J].Br J Pharmacol,2005,146(1):139-145.
[14]Kucher B M,Neary J T.Bi-functional effects of ATP/P2 receptor activationon tumornecrosisfactor-alpha release inlipopolysaccharide-stimulated astrocytes[J].J Neurochem,2005,92(3): 525-535.
Serum P2X7receptor levels and its correlation with inflammatory factors in gout patients
Objective To determine serum levels of P2X7receptor and inflammatory factors and to analyze their correlation in gout patients.Methods Serum levels of P2X7receptor,IL-1β,TNF-α,IL-6,IL-8 and IL-18 were detected by ELISA method in 20 patents with gout,20 patents with hyperuricemia and 20 healthy subjects,the correlations of serum P2X7receptor with inflammatory factors were analyzed.Results P2X7receptor,IL-1β,TNF-α,IL-6,IL-8 and IL-18 levels in gout patients of acute attack stage were significantly higher than those in complete remission period(P<0.05),and also higher than those in hyperuricemia group and healthy control group(P<0.05).There were no significant differences in P2X7receptor,IL-1β,TNF-α, IL-6,IL-8 and IL-18 among patients with complete remission period,hyperuricemia and healthy controls(P>0.05).The level of serum P2X7receptor was positively correlated with ESR,CRP,IL-1β and IL-18(P<0.05),but not correlated with TNF-α,IL-6 and IL-8(P>0.05). Conclusion The levels of P2X7receptor in gout patients of acute attack stage are elevated,and closely correlated with inflammatory factors,indicating that P2X7receptor may be a key factor in acute attack stage of gout,and may become a new target for prevention of acute attack in gout patients.
Gout P2X7receptor Hyperuricemia Interleukin
2014-08-26)
(本文編輯:嚴瑋雯)
(本文由浙江省醫學會風濕病學分會推薦)
315010 寧波市第二醫院風濕免疫科通信作者:陳勇,E-mail:nbdeyycy@163.com

