溫度及光照馴化對南方鲇線粒體代謝補償調節的影響
閆玉蓮 謝小軍
(西南大學生命科學學院, 水生生物及水環境研究所, 重慶 400715)
溫度及光照馴化對南方鲇線粒體代謝補償調節的影響
閆玉蓮 謝小軍
(西南大學生命科學學院, 水生生物及水環境研究所, 重慶 400715)
為了檢驗在季節馴化中溫度和光周期分別對南方鲇(Silurus meridionalis Chen)組織線粒體代謝補償效應的調節作用, 研究對實驗魚進行了 4個系列的馴化處理: (1)低溫等光周期[12.5℃, 12L∶12D, 體重: (186.36 ± 2.77) g]; (2)高溫等光周期[27.5℃, 12L∶12D, 體重: (202.80 ± 7.99) g]; (3)短光照中等溫[8L∶16D, 20℃, 體重: (284.80 ± 13.47) g]; (4)長光照中等溫度[16L∶8D, 20℃, 體重: (283.70 ± 15.60) g], 每組均為24尾魚。馴化8周后取樣, 測定了各馴化組魚體心臟、肝臟和腎臟的器官質量(器官指數), 以及這3種器官組織線粒體在測定溫度為12.5℃、20℃和27.5℃時的呼吸率和細胞色素C氧化酶(CCO)活性。結果顯示, 在等光周期條件下, 低溫馴化組(12.5℃, 12L∶12D)實驗魚的心臟、肝臟和腎臟的器官指數均顯著高于高溫馴化組(27.5℃, 12L∶12D); 在中等溫度條件下不同光照處理的實驗魚之間器官指數無顯著差異。在中等溫度條件下短光照馴化組(8L∶16D, 20℃)魚體的心臟、腎臟和肝臟組織線粒體呼吸率和CCO活性均顯著高于長光照組(16L∶8D, 20 ℃); 而在等光周期條件下的不同溫度馴化并沒引起這3種組織線粒體的呼吸率和CCO活性的明顯差異。綜合認為: 在季節馴化過程中, 光周期改變是引起線粒體代謝能力的主要因素, 溫度變化則是調整器官組織重量的主要因素, 光周期與溫度對南方鲇線粒體代謝機制的調整具有協同作用。
溫度馴化; 光周期; 線粒體; 南方鲇
將食物轉化為細胞可利用的能量是動物生存的首要條件, 線粒體為細胞內利用氧并產生能量(ATP)的主要場所, 機體生命活動所需能量的 80%以上來自線粒體[1,2]。為了維持細胞功能, ATP的生產必須要與能量消耗過程中ATP的利用相匹配, 才能維持機體的生存[3]。已有研究表明, 線粒體中的電子傳遞鏈及氧化磷酸化過程的代謝模式是高度保守的, 對于環境變化的任何適應性反應都應當是對其量值的調節, 而不是對代謝途徑或模式的更新[4,5]。當環境溫度條件發生改變時, 魚體線粒體生產ATP的速率將隨之調控以保持動物生理功能的相對穩定[5], 因此, 線粒體代謝途徑隨環境因子變化的調節能力就決定了該物種在環境變化中的適應性。代謝水平這種適應性的調整稱為代謝補償效應, 由環境因子的季節變動而誘導代謝補償效應產生的過程稱為季節馴化。
在自然條件下的季節轉換過程中, 溫度和光周期的改變緊密伴隨, 是調控動物代謝能力的兩個重要因素[6—8]。有關這兩個生態因子變化分別對動物代謝補償的馴化作用及其協同效應的報道多見小型哺乳動物[9,10], 而有關外溫動物的研究資料十分匱乏。魚類是外溫動物, 由于缺乏穩定體溫的調節機制, 魚體對影響ATP生產的任何一個環境因素都會尤其敏感, 魚類是研究脊椎動物線粒體代謝對環境因子的適應性特性以及形成這一特征的進化過程的模式種類[11]。
在以往有關溫度馴化對魚類線粒體代謝影響的研究中, 多采用兩條實驗技術路線: 一種是在實驗室條件下, 設定不同溫度對實驗動物進行一定時期(幾周或者幾個月)的馴化處理, 然后對處理后的動物組織取樣。在此期間, 溫度是唯一的控制變量, 光周期在溫度馴化組之間并無差異[12,13]。另一種則是將魚體置于自然環境溫度和光周期條件下, 在不同季節分別取樣。檢測并比較不同樣本的代謝能力及其相關的生理生化指標, 從而探討各類實驗條件所產生的馴化效應[14,15]。比較已有實驗研究的結果可以看出, 單一的溫度因子馴化所產生的代謝補償效應要小于季節馴化所產生補償效應的強度[16—18]。因此有必要探討光周期環境因子在季節馴化中的作用及其與溫度的協同效應, 為闡明魚體代謝補償調節機理提供基礎資料。
南方鲇(Silurus meridionalis Chen)是中國的特有魚類, 廣泛分布于長江流域及其以南地區, 該區域水體溫度季節波動的變幅達20℃以上。我們前期研究發現, 南方鲇在不同季節條件下, 其心臟、腎臟和肝臟線粒體在代謝能力或器官質量上均存在差異,表現出了代謝補償效應[19]。本實驗采用該種魚這3種器官的組織為實驗材料, 在人工控制光照和環境溫度條件下, 分別測定溫度和光周期因子馴化對南方鲇心臟、腎臟和肝臟線粒體的代謝補償效應的影響, 以檢驗溫度與光周期在該種魚線粒體代謝機制的調整中各自的馴化效應及其協同作用。
1 材料與方法
1.1 實驗魚來源與馴化處理
實驗在西南大學水生生物及水環境研究所試驗漁場進行, 采用人工繁殖獲得南方鲇幼魚作為實驗對象。馴化處理前飼養于的實驗養殖系統內, 以鮮活的泥鰍(Misgurnus anguillicaudatus)切成碎塊作為餌料, 每兩天投喂一次, 達飽足; 養殖期間水溫變幅為(12—20), ℃ 光周期變幅為10L∶14D—14L∶10D。實驗開始后將實驗魚分成4組分別移入室內水族箱, 進行了4個系列的實驗處理: (1)低溫等光周期(12.5℃, 12L∶12D)馴化組[體重: (186.36 ± 2.77) g,體長: (26.29 ± 0.18) cm, 24尾魚], 即光周期為L∶D = 12h∶12h, 瞬時開斷; 水溫控制在(12.5±0.5)℃。(2)高溫等光周期(27.5℃, 12L∶12D)馴化組[體重: (202.80 ± 7.99) g, 體長: (28.16 ± 0.38) cm, 24尾魚]。(3)短光照中等溫度(8L∶16D, 20℃)馴化組[體重: (284.80 ± 13.47) g, 體長: (32.45± 0.46) cm, 24尾魚]。(4)長光照中等溫度(16L∶8D, 20 )℃ 馴化組[體重: (283.70 ± 15.60) g, 體長: (32.09 ± 0.62) cm, 24尾魚]。以上4組分別簡稱為: 低溫組 (Cold group)、高溫組 (Warm group)、短照組 (Short day-length group)、長照組 (Long day-length group)。
各組馴化處理持續時間均為8周。實驗馴化期間,以鮮活的泥鰍切成碎塊作為餌料, 每兩天投喂一次,達飽足。實驗魚處死前禁食, 低溫馴化組實驗魚禁食7d, 中溫馴化組實驗魚禁食5d, 高溫馴化組實驗魚禁食3d, 使取樣時的試驗魚體剛進入空腹狀態[20]。
1.2 組織線粒體制備
1.3 組織線粒體呼吸率的測定
采用液相氧電極(Clarke-type, Oxygraph Electrode System; Hansatech公司)分別在12.5、20和27.5℃下測定肝臟組織線粒體呼吸率, 每個溫度梯度的樣本量為8。反應液總體積為2 mL。先往反應室中加入1.9 mL呼吸緩沖液D (225 mmol/L 蔗糖, 50 mmol/L Tris, 5 mmol/L MgCl2?6H2O, 1 mmol/L EDTA, 5 mmol/L 琥珀酸, 15 mmol/L KH2PO4, pH 7.4), 待基線平穩后, 加入100 μL的線粒體懸浮液, 此時測得的耗氧率為線粒體狀態2呼吸率。然后用微量注射器將5 μL的100 mmol/L ADP(終濃度0.25 mmol/L)加入反應室, 此后的耗氧率會明顯上升, 此時為線粒體狀態3呼吸率, 即線粒體的最大耗氧率。此狀態持續一段時間后, 耗氧率隨著ADP的消耗而逐漸下降, ADP耗盡后的耗氧率則為狀態4呼吸率[10]。狀態3與狀態4呼吸率的比值稱作線粒體呼吸控制率(RCR), 用于表征線粒體呼吸的偶聯程度。
1.4 組織線粒體細胞色素C氧化酶(CCO)活性測定
采用液相氧電極分別在12.5、20和27.5℃下測定CCO活性, 每個溫度梯度的樣本量為8。反應液總體積為2 mL。先往反應室中加入1.98 mL緩沖液(7.5 mmol/L KH2PO4, 3.75 mmol/L抗壞血酸, 0.3 mmol/L2HCl-四甲基對苯二胺, pH 7.4, 其中抗壞血酸為氧化底物), 待基線斜率穩定后, 用微量進樣器將 10 μL線粒體懸浮液和10 μL的30 μmol/L細胞色素C加入反應室, 此后的耗氧率會明顯上升, 測出穩定的最大耗氧率[10]。
1.5 線粒體蛋白含量測定
線粒體蛋白含量用福林酚法[21]測定, 以牛血清蛋白作標準, 以酶標儀(SPECTRA MAX190, Molecular devices)在500 nm波長下的吸光度(OD)值繪制標準曲線, 再根據標準曲線估算出樣本的線粒體蛋白的含量。
1.6 數據處理方法
2008年5月中旬,烏梁素海明水區域大量暴發黃藻,最盛時發生面積達 8萬余畝(0.533萬 hm2),超過明水面積的1/3。2009年5月下旬烏梁素海再次發生黃藻并迅速蔓延,最大面積達 1.6 萬畝(0.107 萬 hm2),對生態環境造成極大危害,引起國家有關部門高度重視。經調研監測分析,這是烏梁素海特殊氣候條件、湖區水體水質、人類生產生活活動等多方面原因共同導致的結果。其根本原因是特殊氣候條件下水體富營養化程度不斷增高所致。監測結果見表1。
每份線粒體提取液的呼吸率、CCO活性及蛋白含量的測定均重復 2次, 兩次所得數據偏差若超過2%, 則增加重復測定次數, 選擇偏差在 2%以內的兩個測量值取其平均數作為測定結果。采用單位線粒體蛋白重量的耗氧率[nmol O2/(min·mg)]表示線粒體呼吸率及CCO活性。利用公式: 器官指數=(器官重量/體重), 分別計算了南方鲇的心臟、腎臟和肝臟器官指數。采用 Excel(2003)、SPSS(11.5)軟件進行數據的整理及統計分析, 數據用(平均值 ± 標準誤差)表示。采用獨立樣本 t 檢驗比較相同測定溫度下兩溫度馴化組之間及兩光周期馴化組之間的數據差異, 以 P < 0.05作為數據均值差異達到顯著性的標準。
2 結果
2.1 各器官組織的相對重量
在等光周期條件下, 低溫馴化組實驗魚的心臟、腎臟和肝臟的器官指數(即: 器官重量占體重的百分比)分別為0.07、0.56和2.49, 高溫馴化組以上3種組織的器官指數則分別為0.06、0.37和0.86, 統計結果表明, 低溫馴化組的各種器官指數均顯著高于高溫馴化組(P < 0.05); 在中等溫度條件下, 不同光周期處理的實驗魚之間其器官指數無顯著差異(P>0.05)(表1)。
2.2 組織線粒體蛋白含量
實驗魚的心臟、腎臟和肝臟組織的線粒體蛋白含量在4個馴化組之間均無顯著性差異(表1)。
2.3 線粒體呼吸率
當測定溫度在12.5、20和27.5℃時, 低溫等照馴化組實驗魚的心臟、腎臟和肝臟組織線粒體狀態3呼吸率[nmol O2/ (min·mg)]均高于高溫等照馴化組在相同溫度條件下的測得值, 但只有心臟在12.5和27.5℃條件下, 該指標在兩個溫度馴化組之間的差異達到顯著(P<0.05)(表2); 在相同測定溫度條件下,這 3種的組織線粒體狀態 4呼吸率[nmol O2/ (min·mg)]在兩個不同溫度馴化組之間也無顯著性差異(表3)。在各測定溫度條件下, 短光照馴化組實驗魚的各組織線粒體狀態3呼吸率和狀態4呼吸率均分別高于長光照馴化組, 統計檢驗表明, 各個測定溫度的狀態3呼吸率在兩個不同光照馴化處理組之間的差異均達到顯著(P < 0.05)(表2和表3)。在各測定溫度條件下, 所有實驗魚以上 3種組織線粒體呼吸的RCR值均在4以上(表4)。
2.4 CCO活性
在12.5、20和27.5℃溫度條件下, 心臟、腎臟和肝臟臟組織線粒體CCO活性[nmol O2/ (min·mg)]在等光周期不同馴化溫度組之間的差異均不顯著;但短光照中溫馴化組實驗魚這種3種組織的CCO活性在各個測定溫度下則顯著高于長光照中溫組(P<0.05)(表5)。
3 討論
一些魚類經過季節或溫度馴化后會改變其組織線粒體的數量, 如低溫(5℃)下馴化的條紋狼鱸(Morone saxatili)氧化肌中線粒體數量增加了 50%[22], 經過冷馴化的歐洲鯽魚(Carassius carassius)肌肉線粒體的量也明顯提高[23]。一些研究者采用組織線粒體蛋白含量作為表征組織線粒體含量的指標[24,25], 本實驗也采用了這樣方法的進行比較, 結果發現南方鲇心臟、腎臟和肝臟組織中線粒體蛋白含量在不同溫度馴化組、不同光周期組之間均無顯著性差異(表1),表明溫度與光周期因子的分別馴化均不對該種魚組織線粒體數量的增殖產生誘導作用。結合已有文獻報道[22—25], 我們認為在季節馴化過程中, 誘導魚體組織線粒體數量補償效應的環境因子在不同魚類中可能存在種間差異。
在實驗室控制條件下, 單一溫度因子的低溫馴化可不同程度地增強魚體組織線粒體的氧化能力[12,18],有研究提出, 溫度在季節馴化過程中對魚類代謝能力的調節起著決定性的作用, 光周期對其影響甚微[26]。但也有研究發現, 高溫(夏季氣候特征)條件下的短光周期(冬季氣候特征)馴化依然會引起魚體肌肉線粒體氧化能力的增強[9,15], 因此Martin, et al.[15]提出光周期對魚體組織線粒體代謝能力的補償調控起到了主導作用。本實驗結果顯示, 在恒定光周期條件下, 低溫馴化引起南方鲇魚體的腎臟和肝臟組織線粒體代謝能力(狀態3呼吸率及CCO活性)的增強效應卻并不顯著(表 2和表 5); 但不同光照時間的馴化對該種魚組織線粒體的氧化能力的調整作用反而十分明顯。經短光照馴化后魚體的心臟、腎臟和肝臟組織線粒體代謝能力均顯著增強。我們有關南方鲇的觀察結果支持Martin, et al.[15]的觀點。

表1 不同馴化條件對南方鲇不同組織的器官指數和線粒體蛋白含量的影響Tab.1 Effects of acclimation condition on organ index and mitochondrial protein contents in various tissues of Silurus meridionalis
也有研究發現, 一些魚體在經過長時間的溫度馴化或季節馴化過程后, 會調整某些器官組織的相對重量, 即在低溫馴化或冬季條件下魚體器官指數增加, 使其器官組織中總體的線粒體數量增多, 從而提高整個器官的線粒體總耗氧率[24,28]。我們的實驗結果表明, 在季節馴化過程中, 溫度馴化是南方鲇器官重量變化的主要誘導因素, 而不同光周期處理并沒有引起該種魚各器官指數的變化。這一現象與內溫動物的研究結果并不一致, 已有報道發現光周期是誘導其器官重量季節性變化的主要因素, 短光照成為啟動器官重量增加的調節信號。如: 短光照可提高棉鼠(Sigmodon hispidus)[28]、高原鼠兔(Ochotona curzoniae)和根田鼠(Microtus oeconomus)[29]等物種的褐色脂肪組織和肝臟的重量; 短光照馴化組白頭鵯(Pycnontus sinensis)的肝臟重量顯著高于長光照組個體[30]。這表明, 季節馴化過程中啟動外溫動物和 內溫動物器官重量調節的誘導因子可能存在差異, 而引起這種差異的機理則有待于進一步的研究予以驗證。
對相同魚種在不同馴化處理條件下的結果進行比較發現, 經季節馴化的魚體代謝補償效應比單一因子(溫度或者光周期)馴化所產生的補償效應更明顯[16,18]。器官水平的代謝補償調節主要有3條途徑: (1)改變單位組織所含線粒體的數量; (2)改變單個線粒體的氧化能力; (3)改變器官組織的總質量, 從而改變器官組織所含線粒體的總量[24,31]。本研究的結果表明, 溫度因子馴化主要對器官的質量進行調整,光周期因子的馴化主要改變線粒體代謝能力。在夏季向冬季漸進變化的自然環境中, 溫度因子和光周期因子是由夏季的高溫長光照向冬季的低溫短光照改變, 即向著增加器官總質量并提高線粒體氧化能力的趨勢協同調整, 從而提高器官的線粒體總耗氧率, 因此器官水平上所產生的代謝補償效應就更為顯著。

表2 不同馴化條件對南方鲇不同組織線粒體狀態3[nmol O2/(min·mg)]呼吸率的影響Tab.2 Effects of acclimation condition on state 3 respiration rates [nmol O2/(min·mg)] of mitochondria isolated from various tissues of Silurus meridionalis

表3 不同馴化條件對南方鲇不同組織線粒體狀態4[nmol O2/ (min?mg)]呼吸率的影響Tab.3 Effects of acclimation condition on state 4 respiration rates [nmol O2/ (min?mg)] of mitochondria isolated from various tissues of Silurus meridionalis
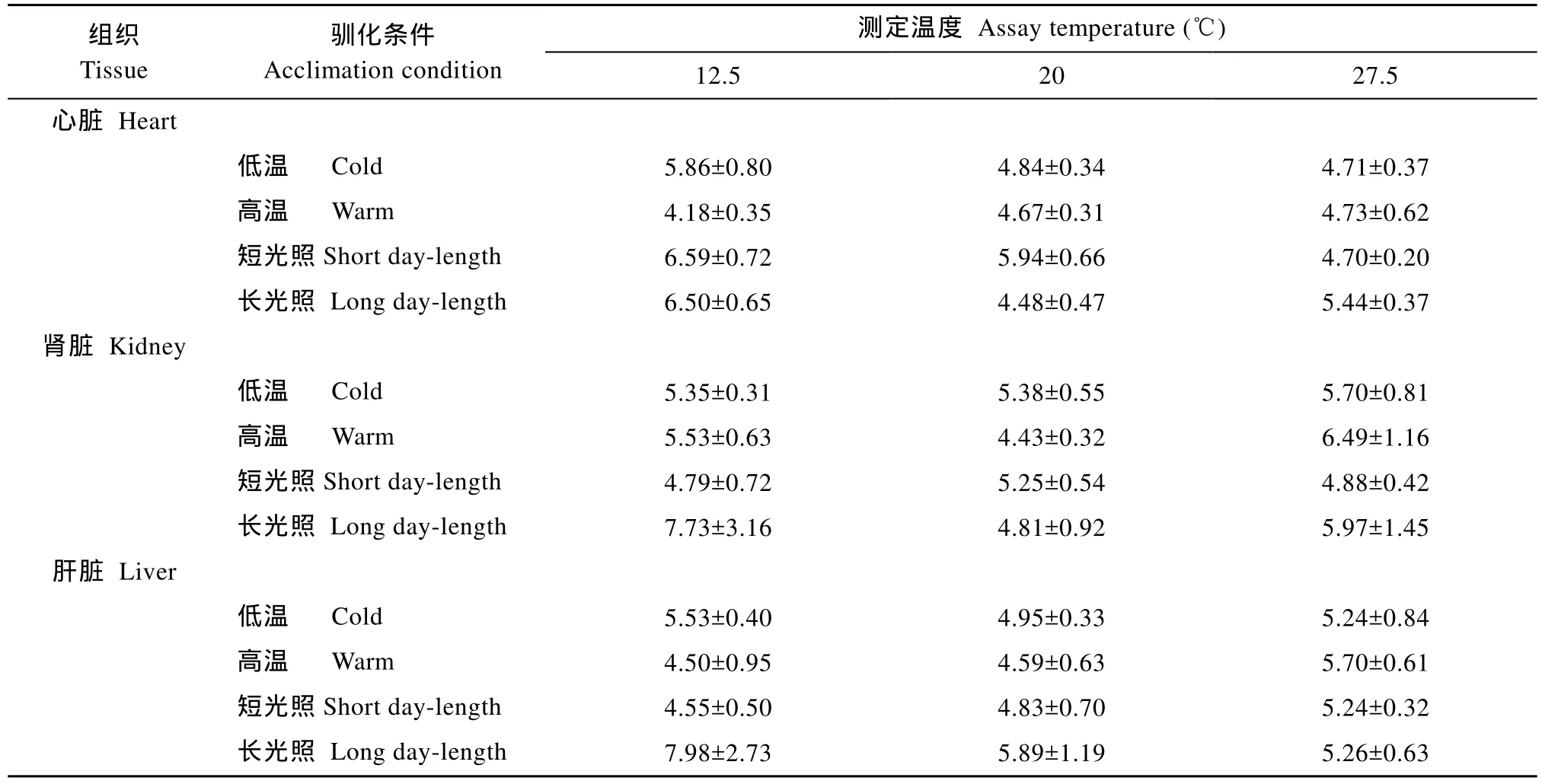
表4 不同馴化條件對南方鲇各組織線粒體呼吸RCR值的影響Tab.4 Effects of acclimation condition on the value of RCR for mitochondrial respiration in various tissues of Silurus meridionalis

表5 不同馴化條件對南方鲇不同組織線粒細胞色素C氧化酶(CCO)活性[nmol O2/ (min·mg)]的影響Tab.5 Effects of acclimation condition on enzymatic activity of cytochrome c oxidase [nmol O2/ (min·mg)] for various tissues from Silurus meridionalis
綜上所述, 在季節馴化過程中, 光周期改變是啟動南方鲇組織線粒體代謝能力調整的主要因素,溫度變化則是影響該種魚器官組織重量(器官指數)的主要因素。在魚體經由夏季的高溫且長光照的自然條件向冬季的低溫且短光照條件的馴化過程中,靶器官的組織總量及其線粒體代謝能力會同步提升, 從而增強器官總體代謝補償的效應。因此, 光周期與溫度對南方鲇線粒體代謝機制的調整具有協同作用。
[1] Guderley H, St-Pierre J. Going with the flow or life in the fast lane: contrasting mitochondrial responses to thermal change [J]. Journal of Experimental Biology, 2002, 205: 2237—2249
[2] Moyes C D, Hood D A. Origins and consequences of mitochondrial variation [J]. Annual Review of Physiology, 2003, 65: 177—201
[3] Hulbert A J, Else P L, Membranes as possible pacemakers of metabolism[J]. Journal of Theoretical Biology, 2000, 199: 257—274
[4] Koch L G, Britton S L. Aerobic metabolism underlies complexity and capacity [J]. Journal of Physiology, 2008, 586: 83—95
[5] Seebacher F, Murrau S A, Eles P L. Thermal acclimation and regulation of metabolism in a retile (Crocodylus porosus): the importance of transcriptional mechanisms and membrane composition [J]. Physiological and Biochemical Zoology, 2010, 82: 766—775
[6] Day N, Butler P J. The effects of acclimation to reversed seasonal temperature on the swimming performance of adult brown trout Salmo trutta [J]. Journal of Experimental Biology, 2005, 208: 2683—2692
[7] Bradshaw W E, Holzapfel C M. Evolution of animal photoperiodism [J]. Annual Reviews of Ecology, Evolution and Systematics, 2008, 38: 1—35
[8] Auld J R, Agrawal A A, Relyea R A. Re-evaluating the costs and limits of adaptive phenotypic plasticity [J]. Proceedings of the Royal Society of London Series B -Biological Sciences, 2009, 277: 503—511
[9] Peacock W L, Kr l E, Moar K M, et al. Photoperiodic effects on body mass, energy balance and hypothalamic gene expression in the bank vole [J]. Journal of Experimental Biology, 2004, 207: 165—177
[10] Zhao Z J, Wang D H. Short photoperiod enhances thermogenic capacity in Brandt’s voles [J]. Physiology & Behavior, 2005, 85: l43—l49
[11] Guderley H. Metabolic responses to low temperature in fish muscle [J]. Biological Reviews, 2004, 79: 409—427
[12] Kraffe E, Marty Y, Guderley H. Changes in mitochondrial oxidative capacities during thermal acclimation of rainbow trout, Oncorhynchus mykiss: roles of membrane proteins, phospholipids and their fatty acid compositions [J]. Journal of Experimental Biology, 2007, 210: 149—165
[13] Fangue N A, Richards J G, Schulte P M. Do mitochondrial properties explain intraspecific variation in thermal tolerance?[J] Journal of Experimental Biology, 2009, 212: 514—522
[14] Guderley H, St-Pierre J, Couture P, et al. Plasticity of the properties of mitochondria from rainbow trout red muscle with seasonal acclimatization [J]. Fish Physiology and Biochemistry, 1997, 16: 531—541
[15] Martin N, Kraffe E, Guderley H. Effect of day length on oxidative capacities of mitochondria from red muscle of rainbow trout (Oncorhynchus mykiss) [J]. Comparative Biochemistry and Physiology-Part A, 2009, 152: 599—603
[16] St-Pierre J, Charest P M, Guderley H Relative contribution of quantitative and qualitative changes in mitochondria to metabolic compensation during seasonal acclimatisation of rainbow trout, Oncorhynchus mykiss [J]. Journal of Experimental Biology, 1998, 201: 2961—2970
[17] Guderley H, St-Pierre J. Seasonal cycles of mitochondrial ADP sensitivity and oxidative capacities [J]. Journal of Comparative Physiology B, 1999, 169: 474—480
[18] Bouchard P, Guderley H. Time course of the response of mitochondria from oxidativemuscle during thermal acclimation of rainbowtrout, Oncorhynchus mykiss [J]. Journal of Experimental Biology, 2003, 206: 3455—3465
[19] Yan Y L. The metabolic compensation in the southern catfish (Silurus meridionalis Chen) during seasonal acclimatization [D]. Thesis for Doctor of Science. Southwest University, Chongqing. 2011 [閆玉蓮. 南方鲇適應季節溫度變化的代謝補償的研究. 博士學位論文,西南大學, 重慶. 2011]
[20] Xie X J, Sun R Y. The bioenergetics of southern catfish (Silurus meridionalis Chen): I Resting metabolic rate as a function of body weight and temperature [J]. Physiological Zoology, 1990, 63: 1181—1195
[21] Lowry H, Rosbrough J, Farr A L, et al. Protein measurement with the Folin phenol reagents [J]. Journal of Biological Chemistry, 1951, 193: 265—275
[22] Egginton S, Sidell B D. Thermal acclimation induces adaptive changes in subcellular structure of fish skeletal muscle [J]. American Journal of Physiology, 1989, 256: R1 – R9
[23] Londraville R L, Sidell B D. Cold acclimation increases fatty acid binding protein concentration in aerobic muscle of striped bass, Morone saxatilis [J]. Journal of Experimental Zoology, 1996, 275: 36—44
[24] Lannig G, Storch D, P?rtner H O. Aerobic mitochondrial capacities in Antarctic and temperate eelpout (Zoarcidae) subjected to warm versus cold acclimation [J]. Polar Biology, 2005, 28: 575—584
[25] Guderley H, Seebacher F. Thermal acclimation, mitochondrial capacities and organ metabolic profiles in a reptile (Alligator mississippiensis) [J]. Journal of Comparative Physiology B, 2011, 181: 53—64
[26] Condon C H, Chenoweth S F, Wilson R S. Zebrafish take their cue from temperature but not photoperiod for the seasonal plasticity of thermal performance [J]. Journal of Experimental Biology, 2010, 213: 3705—3709
[27] Dean J M. The metabolism of tissues of thermally acclimated trout (Salmo gairdneri) [J]. Comparative Biochemistry and Physiology, 1969, 29: 185—196
[28] Tomasi T E, Mitchell D A. Temperature and photoperiod effects on thyroid function and metabolism in cotton rats (Sigmodon hispidus) [J]. Comparative Biochemistry and Physiology Part A, 1996, 113(3): 267
[29] Wang D, Sun R, Wang Z, et al. Effects of temperature and photoperiod on thermogenesis in plateau pikas Ochotonacurzoniae and root voles Microtus oeconomus [J]. Journal of Comparative Physiology B, 1999, 1691: 77—83
[30] Ni X Y, Lin L, Zhou F F, et al. Effects of photoperiod on body mass, organ masses and energy metabolism in Chinese bulbul (Pycnonotus sinensis) [J]. Acta Ecologica Sinica, 2011, 31(6): 1703—1713 [倪小英, 林琳, 周菲菲, 等. 光周期對白頭鵯(Pycnonotus sinensis)體重、器官重量和能量代謝的影響. 生態學報, 2011, 31(6): 1703—1713]
[31] Yan Y L, Xie X J. Metabolic compensation based on regulating mechanism in mitochondrion of fish in response to environmental temperature. Acta Hydrobiologica Sinica, 2012, 36(3): 532—540 [閆玉蓮, 謝小軍. 魚類適應環境溫度的代謝補償及其線粒體水平的調節機制. 水生生物學報, 2012, 36(3): 532—540]
MITOCHONDRIAL METABOLIC COMPENSATION OF THE SOUTHERN CATFISH, SILURUS MERIDIONALIS CHEN, IN RESPONSE TO ACCLIMATION OF TEMPERATURE AND PHOTOPERIOD
YAN Yu-Lian and XIE Xiao-Jun
(Institute of Hydrobiology and Water Environment, School of Life Sciences, Southwest University, Chongqing 400715, China)
To evaluate the effects of ambient temperature and day-length respectively in setting metabolic compensation of mitochondria in juvenile of the southern catfish (Silurus meridionalis Chen), the organ index of the heart, kidney and liver and their state 3 rates of mitochondria and cytochrome C oxidase activity (CCO) were measured in the tested fishes at different acclimations. Two experimental groups were acclimated to high temperature (27.5℃) and low temperature (12.5℃) at equivalent photoperiod (12L∶12D), and other two groups were kept at long day-length (16L∶8D) and short day-length (8L∶16D) condition at same moderate temperature (20℃). There were 24 individuals in each group. Fish were maintained at these acclimation conditions for 8 weeks before sampling. In condition of the equivalent photoperiod, the organ index of the heart, kidney, and liver in the cold-acclimatized group (12.5℃, 12L∶12D) were all significantly higher than that in the warm group (12L∶12D, 27.5℃) (P < 0.05). The acclimation of day-length did not cause any change in organ mass at same moderate temperature. At assay temperature of 12.5, 20, and 27.5℃, both state 3 rates of mitochondria and activity of CCO in the heart, kidney, and liver in the short day-length group (8L∶16D, 20℃) were significantly higher than those in long day-length group (16L∶8D, 20℃). State 3 rates of mitochondria and activity of CCO in the three tissues were not influenced by thermal acclimation. The results showed that day-length initiates changes in the mitochondrial oxidative capacity and the temperature was the major ambient factor to alter the organ mass. It is suggested that during seasonal acclimatization photoperiod signal and thermal condition might have a cooperative effect on the adjustment for metabolic compensation in the southern catfish.
Thermal acclimation; Photoperiod; Mitochondrion; Silurus meridionalis
S965.1
A
1000-3207(2014)03-0422-08
10.7541/2014.60
2014-01-27;
2014-03-10
國家自然科學基金(31300338); 重慶市科委自然科學基金計劃(cstc2012jjA20017); 中央高校基本業務專項資金項目(XDJK2013CO56)資助
閆玉蓮(1983—), 女, 安徽省碭山縣人; 博士, 講師; 主要從事魚類生理生態學研究。E-mail: yanyul@swu.edu.cn
謝小軍, E-mail: xjxie@swu.edu.cn

