單寧酸與胰α-淀粉酶作用特性研究
,
(四川大學輕紡與食品學院,四川成都 610065)
近年來,隨著人們生活水平不斷提高,糖尿病、高血壓、肥胖等已成為常見的高發病,嚴重危害了人類健康[1]。眾多研究表明,某些植物成分(如存在于多種果蔬中的多酚類化合物)可有效影響消化酶活性,據此有望建立糖尿病和肥胖等疾病新的預防和控制方法[2]。單寧酸又稱鞣酸,廣泛存在于茶葉及多種中草藥和果蔬食品中[3]。文獻表明,單寧酸具有抗炎、抗氧化、降血糖、調整脂代謝等多種功效[4],如Tikoo[5]發現單寧酸可改善糖尿病大鼠的一般狀況及腎功能,而沈忠明[4]證明虎杖單寧酸對小鼠具有明顯的降血糖作用。胰α-淀粉酶是一種糖類代謝酶,對動物體內淀粉和肝糖的降解起重要作用[6]。單寧酸可影響胰α-淀粉酶活性,但對于單寧酸與胰α-淀粉酶相互作用機制國內外尚未見報道。基于此,本文首先研究了單寧酸對胰α-淀粉酶的抑制作用,并借助紫外和熒光光譜手段探討了作用機理,擬為單寧酸在相關功能性食品和藥品中的應用奠定基礎。
1 材料與方法
1.1 材料與儀器
豬胰α-淀粉酶(PPA,分子量50ku)、蘆丁、槲皮素 美國Sigma公司。單寧酸(TA)、沒食子酸、茶多酚 成都市長征化玻有限公司;其他試劑均為分析純。
2501PC紫外分光光度儀 日本島津公司;F-4000熒光光譜儀 日本日立公司。
1.2 實驗方法
1.2.1 單寧酸對PPA的抑制作用 采用改進的分光光度法[7]研究了單寧酸對PPA的抑制作用。首先將2.5g可溶性淀粉溶于磷酸鹽緩沖液(pH6.9),煮沸,冷卻后定容至250mL,作為底物溶液備用。以磷酸鹽緩沖液配制不同濃度PPA溶液,避光冷藏。將0.5mL底物溶液于310K水浴1min后,依次加入0.25mL單寧酸溶液(單寧酸最終濃度為0.05、0.1、0.2、0.4、0.6、0.8、1.0、1.5、2mg/mL)、0.25mL酶溶液。310K下震蕩反應5min后,加入1mL DNS顯色液[8],置于沸水浴中8min。取出,冷至室溫,加蒸餾水10mL稀釋,于540nm測定吸光值。實驗中以空白液為參比,計算單寧酸對PPA的抑制率,并基于單寧酸濃度與抑制率的回歸方程計算其半抑制濃度IC50。實驗中對比研究了蘆丁、茶多酚、槲皮素、沒食子酸(最終濃度2mg/mL)對PPA的抑制率。
抑制率(%)=[(T1-T2)/T1]×100
式(1)
式(1)中T1和T2分別代表無抑制劑和有抑制劑時的酶活。
研究中固定酶濃度(0.08mg/mL)和單寧酸濃度(0.05mg/mL),在不同底物濃度下(0.25%、0.5%、0.75%、1%)進行酶活分析,方法同上[7],通過雙倒數作圖法判斷單寧酸對PPA的抑制類型。
1.2.2 單寧酸與PPA作用的紫外差譜分析 于3.0mL PPA溶液(0.5mg/mL)中,加入0.2mL單寧酸溶液,于室溫震蕩反應一定時間后,在200~300nm范圍內掃描,以相同濃度的PPA溶液作空白,記錄PPA溶液的紫外吸收差譜。實驗中改變單寧酸濃度(0.025、0.05、0.1、0.2、0.4、0.8mg/mL)和作用時間(2、10、30min、1、2h),通過PPA紫外吸收差譜研究單寧酸與PPA的作用特性。
1.2.3 單寧酸與PPA作用的熒光光譜分析 取3.0mL濃度為0.5mg/mL的PPA溶液,將其與0.2mL單寧酸溶液于熒光比色皿中混勻(單寧酸最終濃度為0.025、0.05、0.1、0.2、0.4、0.8mg/mL),在不同溫度下(293、303、310K)靜置作用5min后測試。熒光激發波長278nm和295nm,熒光發射掃描范圍300~400nm。在上述實驗條件下,以同步波長Δλ=15nm及Δλ=60nm分別進行同步熒光掃描。
1.2.4 數據處理 每次測定均平行測定三次,采用Excel和SPSS16.0軟件進行數據處理,測定結果以平均值±標準偏差(mean±SD)表示,顯著性臨界值α=0.05。采用Origin8.0軟件對采集的紫外和熒光數據進行分析和作圖。
2 結果與討論
2.1 單寧酸對胰α-淀粉酶的抑制特性
單寧酸對PPA的抑制如圖1A所示,隨著單寧酸濃度升高,其對PPA的抑制率逐漸增大,當單寧酸濃度達2mg/mL時,94.8%的PPA酶活受到抑制,基于數據擬合求解可知單寧酸對PPA的半抑制濃度IC50為0.87mg/mL。實驗中將單寧酸與幾種典型植物多酚進行比較,發現在2mg/mL時,蘆丁、茶多酚、槲皮素、沒食子酸對PPA的抑制率分別為40.2%、67.4%、41.5%和13.9%,單寧酸表現了相對更強的PPA抑制能力。
1.3.4 福山區政府政策優勢。福山區政府確立了以特色櫻桃產業帶動經濟發展、以優秀電商模式推動特色櫻桃產業的雙驅動模式,不斷提升櫻桃特色產業的水平,使大櫻桃的電商模式駛入“快車道”。自2006年以來,在面對其他大櫻桃地區的快速發展時,福山政府推動了櫻桃品牌的創立,大櫻桃產業發展需要品牌意識,以實現利益與品牌價值的捆綁提升,在提高水果質量的同時,也提升了品牌認證的力度,不斷地鞏固福山區大櫻桃的優勢地位[1]。
由Lineweaver-Burk圖可見,當單寧酸存在時,酶反應米氏常數(Km)不變,但最大反應速率(Vmax)減小(圖1B),單寧酸對PPA的作用表現為非競爭性抑制。說明單寧酸能與PPA活性中心外的必需基團結合,與酶-底物結合互不影響,但酶-底物-抑制劑三元復合物不能進一步分解為產物[9]。
2.2 單寧酸對胰α-淀粉酶紫外光譜的影響
單寧酸與胰α-淀粉酶(PPA)作用后,可使得酶的空間結構發生一定程度變化,如導致酶二級結構改變,這種改變可通過PPA的紫外吸收差譜得以反映[10]。不同濃度單寧酸與PPA作用后,其紫外吸收變化如圖2A所示。可見,PPA在270nm附近的吸收變化隨單寧酸濃度增大而逐漸增大,并且發生紅移,當單寧酸濃度增至0.4mg/mL時,紅移近10nm。隨著單寧酸濃度進一步增大(>0.8mg/mL),PPA吸收差譜無明顯變化(圖略),這可能源于單寧酸與PPA作用趨于穩定,PPA空間結構不再改變所致。實驗中考察了不同作用時間后,單寧酸對PPA紫外吸收的影響,結果發現PPA的紫外差譜無本質變化(圖2B),說明單寧酸與PPA結合迅速,短時間可達到一個穩定的狀態。

圖1 單寧酸對PPA的抑制特性 Fig.1 Inhibition characteristics of tannic acid on PPA

圖2 單寧酸作用后PPA紫外吸收差譜 Fig.2 The UV differential spectra of PPA in the presence of tannic acid at pH 6.9 and 310
2.3 單寧酸對胰α-淀粉酶熒光光譜的影響
蛋白質分子中有多種氨基酸具有熒光特性,其所需激發波長不同。278nm可激發色氨酸(Trp)和酪氨酸(Tyr)殘基,而295nm只可激發Trp殘基[11]。由圖3可見,隨著單寧酸濃度增大,PPA的內源熒光強度有規律降低。在不同激發波長下,PPA激發峰的峰位與峰形略有改變,但都隨單寧酸濃度增大發生了一定程度紅移。單寧酸與PPA結合后PPA肽鏈發生伸展,可能使得Trp和Tyr殘基暴露于極性環境中,從而導致最大熒光發射峰紅移[12]。

圖3 單寧酸對PPA熒光光譜的影響 Fig.3 Effect of tannic acid on fluorescence spectrum of PPA at pH 6.9 and 310K
2.4 胰α-淀粉酶的同步熒光光譜
同步熒光可以提供發色基團微環境的變化信息,在同步熒光波長Δλ=15nm和Δλ=60nm所測得的光譜可分別反映酪氨酸(Tyr)和色氨酸(Trp)殘基的光譜特性[13],判斷其微環境的改變,進而推斷蛋白質構象的變化。研究發現,增加單寧酸濃度,酪氨酸殘基的最大發射波長沒有明顯移動(圖4A),表明在單寧酸和PPA結合過程中Tyr殘基附近的微環境沒有明顯改變,而Trp殘基的最大發射波長發生了明顯的紅移(移動了7nm,圖4B),說明單寧酸與PPA的結合使得Trp殘基附近微環境的極性增大、疏水性降低。
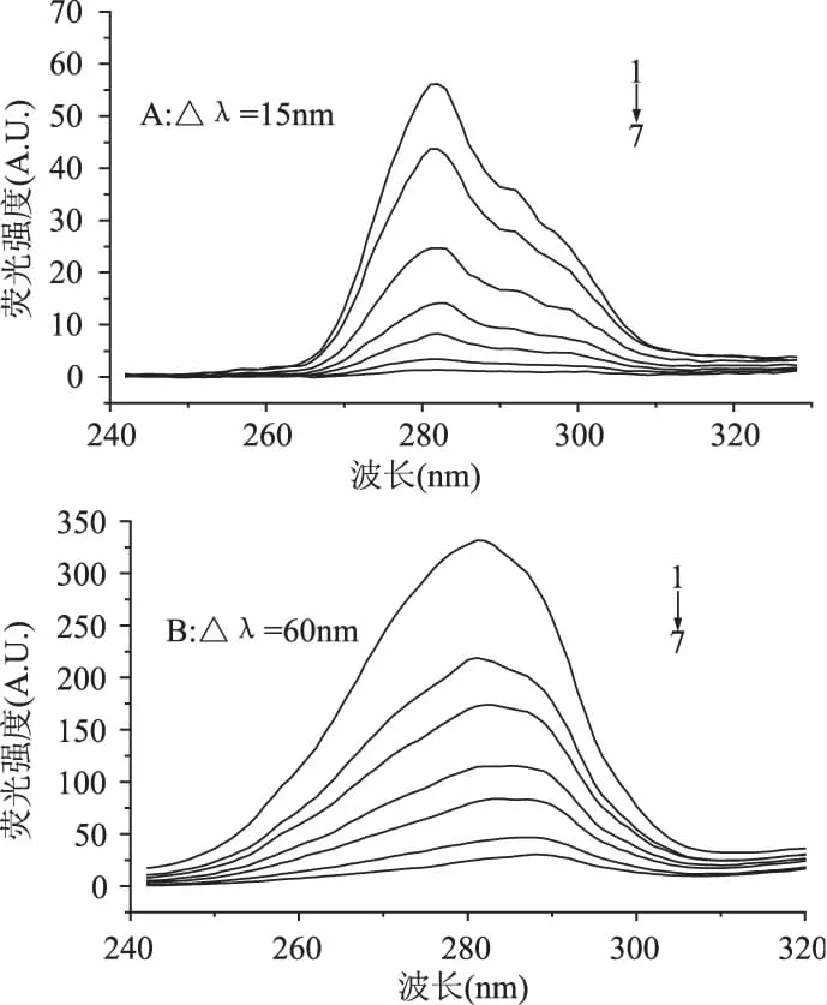
圖4 PPA的同步熒光光譜 Fig.4 Synchronous fluorescence spectra of TA-PPA system at pH 6.9 and 310K
2.5 單寧酸對胰α-淀粉酶的熒光猝滅特性
蛋白質熒光猝滅通常分為靜態和動態過程,動態猝滅是因分子熱運動碰撞引起,其作用過程遵循Stern-Volmer方程[14]:F0/F=1+Kqτ0[Q]=1+Ksv[Q]。式中F0和F分別為加入猝滅劑前后的熒光強度,Kq為猝滅常數(該值越大猝滅效應越明顯),τ0為熒光分子的初始平均壽命(生物大分子約為10-8s),K是動態猝滅常數,[Q]為猝滅劑濃度。
在單寧酸濃度小于0.12×10-3mol/L(0.2mg/mL)時,F0/F與[Q]具有良好的線性關系。由Stern-Volmer方程可知在293、303、310K條件下單寧酸對PPA的猝滅常數Ksv分別為1.44×104L/mol(F0/F=14.4[Q]+0.9829,R2=0.9813)、1.38×104L/mol(F0/F=13.8[Q]+1.0221,R2=0.9886)和1.24×104L/mol(F0/F=12.4[Q]+0.9814,R2=0.9962),進一步可求得猝滅常數Kq分別為1.44×1012、1.38×1012、1.24×1012L·mol-1·s-1。文獻[15]表明各類猝滅劑對生物大分子的最大動態猝滅常數約2.0×1010L·mol-1·s-1,顯然本實驗所得Kq遠高于該值,這表明在低濃度時,單寧酸對PPA的熒光猝滅不是因碰撞造成的,而是靜態猝滅,即單寧酸與PPL結合生成了不發射光子的配合物。動態猝滅中,溫度升高將增加有效碰撞和加劇電子轉移過程,使得猝滅常數增大,但在靜態猝滅中,溫度升高將降低配合物的穩定性,減小猝滅常數[16]。本實驗中猝滅常數Kq隨著溫度的升高而降低,這也進一步說明動態碰撞不是單寧酸引起PPA熒光猝滅的主要原因。實驗發現隨著單寧酸濃度繼續增大,F0/F-[Q]曲線向上彎曲(圖5),這可能因為單寧酸對PPA同時產生了靜態和動態猝滅效應[17]。

圖5 單寧酸對PPA的熒光猝滅Stern-Volmer曲線(λex=278nm) Fig.5 Stem-Volmer curves for the fluorescence quenching of PPA by tannic acid(λex=278nm)
2.6 單寧酸與胰α-淀粉酶作用力類型
ΔG=ΔH-TΔS=-RT lnK
式(2)
式(3)
式中,ΔG為吉布斯自由能,R是氣體常數,K1和K2分別是溫度T1和T2下的結合常數。

表1 單寧酸與PPA結合的熱力學參數Table 1 Thermodynamic parameters of interaction between PPA and TA
計算發現在不同溫度下反應的ΔH值相近,研究中取其均值作為后續計算的依據。單寧酸與PPA結合反應的熱力學參數ΔS>0,ΔG<0,表明二者的結合不但能發生,而且可以自發進行,其主要結合力應源于疏水作用[19]。考慮到蛋白質結構的復雜性,小分子和酶蛋白之間往往同時存在幾種作用力。基于分子結構分析,單寧酸為多羥基化合物,羥基與蛋白分子氨基酸殘基之間有可能形成氫鍵,因此推斷單寧酸與PPA之間還可能存在氫鍵作用力。
3 結論
單寧酸對胰α-淀粉酶(PPA)顯示了明顯的抑制作用,其抑制類型為非競爭性抑制。紫外光譜表明單寧酸可引起PPA構象變化,使酶的吸收峰發生紅移。熒光光譜表明單寧酸與PPA之間能自發進行反應,通過疏水作用形成單寧酸-PPA復合物,并引起PPA內源熒光猝滅。同步熒光光譜顯示單寧酸與PPA的結合位點靠近其色氨酸殘基區域。對單寧酸-PPA作用特性的認識,可為單寧酸在相關功能性食品和藥品中的應用提供參考。
[1]張冬英,余霜,黃業偉,等.普洱茶對α-淀粉酶抑制作用的影響研究[J].食品工業科技,2009,30(2):77-79.
[2]King-Thom Chung,Tit Yee Wong,etal.Tannins and Human Health:A Review[J].Critical Reviews in Food Science and Nutrition,1998,38(6):421-464.
[3]魏海峰,李才,魏雁虹,等.單寧酸對高糖及AGES引起腎小球系膜細胞增殖和W型膠原生成的影響[J].中國實驗診斷學,2010,14(4):496-498.
[4]沈忠明,殷建偉,袁海波,等.虎杖鞣質的降血糖作用研究[J].天然產物研究與開發,2004,16(3):220.
[5]Chandak PG,Gaikwad AB,Tikoo K,etal.Gallotannin ameliorates the development of streptozotocin induced diabetic nephropathy by preventing the Activation of PARP[J].Phytother Res,2009,23(1):72.
[6]裘曉丹,劉雯,雷芳,等.可可堿對胰α-淀粉酶的抑制類型及光譜性質的影響[J].天然產物研究與開發,2008,20:99-102.
[7]B.施特爾巴赫著,錢喜淵譯.酶的測定方法[M].中國輕工業出版社,1992:37-41.
[8]張永軍,黃惠華.茶多酚對胰α-淀粉酶的抑制動力學研究[J].食品工業,2010,1:7-9.
[9]石碧,狄瑩.植物多酚[M].北京:科學出版社,2000:115-116.
[10]楊頻,高飛,馬貴斌.生物無機化學導論[M].西安:西安交通大學出版社,1991:163.
[11]王守業,徐小龍,劉清亮,等.熒光光譜在蛋白質分子構象研究中的應用[J].化學進展,2001,13(4):1887-1891.
[12]Burstein E A,Vedenkina N S,Ivkova M N.Fluorescene and the location of tryptophan residues in protein molecules[J]. Photochem Photobiol,1973,18:267-279.
[13]Lakowicz J R,Weber G.Quenching of protein fluorescence by oxygen,detection of structural fluctuations in proteins on the nanosecond time scale[J].Biochemistry,1973,12:4171-4179.
[14]Lakowicz J R.Principles of Fluorescence Spectroscopy(Seconded.)[M].New York:Plenum Press,1999,237.
[15]范志飛,戴吉領,何強,等.表沒食子兒茶素沒食子酸酯與豬胰脂肪酶的相互作用[J].食品科學,2013,34(7):20-23.
[16]童俊,韓鳳梅,陳勇.熒光猝滅法研究馬錢子堿、士的寧與人血清白蛋白的相互作用[J].中草藥,2010,41(9):1453-1456.
[17]林鋒,姚江武,陶濤.紅茶和綠茶多酚與豬胰腺α-淀粉酶的熒光猝滅反應[J].口腔醫學研究,2009,25(2):156-160.
[18]Keishi Yamasaki,Toru Maruyama,Otagiri M,etal.Interactive binding to the two principal ligand binding sites of human serum albumin:effect of the neutral-to-base transition[J].Bioch Biophys Acta,1999,1432:313-323.
[19]楊冉,屈凌波,陳曉嵐,等.柚皮素、柚皮苷與溶菌酶相互作用的熒光光譜法研究[J].化學學報,2005,64(13):1349-1354.

