高等植物赤霉素生物合成及其信號轉導途徑
李強吳建明梁和黃杏丘立杭
(1.廣西大學農學院,南寧 530004;2. 中國農業科學院甘蔗研究中心 農業部廣西甘蔗生物技術與遺傳改良重點實驗室,南寧 530007)
高等植物赤霉素生物合成及其信號轉導途徑
李強1,2吳建明2梁和1黃杏2丘立杭2
(1.廣西大學農學院,南寧 530004;2. 中國農業科學院甘蔗研究中心 農業部廣西甘蔗生物技術與遺傳改良重點實驗室,南寧 530007)
赤霉素是一種重要的植物激素,調節植物生長和發育的各個階段,如促進種子萌發、莖桿伸長、葉片展開、花的發生及果實與種子的發育。綜述了赤霉素合成、信號轉導途徑、與其他植物激素間的相互作用、對環境信號的響應以及DELLA泛素化降解過程的研究進展,這將有助于人們對赤霉素生理作用和分子調節機制的了解,有利于對赤霉素各方面的機理進行深入地研究。
赤霉素 信號轉導 植物激素 調控機理
赤霉素(Gibberellins,GAs)屬于一種四環雙萜類植物激素,廣泛分布于被子植物、裸子植物、蕨類植物、褐藻、綠藻、真菌和細菌中。目前已知有136種天然赤霉素[1],但在植物體內只有少數GA分子(如GA1、GA3、GA4和GA7等)具有生物活性,它們可調節和控制生物體生長發育的各個階段,例如促進種子萌發、莖桿伸長、葉片展開、花的發生以及果實與種子的發育[2-6]。自20世紀60年代起,由于水稻sd1基因和小麥Rht1基因在育種中的大規模推廣應用使世界主要糧食作物產量極大幅度地提高,這一歷程即為眾所周知的“綠色革命”。研究表明主要農作物的“綠色革命”都與赤霉素密切相關[7]。赤霉素參與調節植物生物發育中一個突出的特點是促使莖的伸長和植株增高,其效應包括:(1)GA能增加一些植物(如蓮座天仙子)的細胞分裂,它能促進細胞分裂是因為縮短了細胞周期G1期和S期的時間。(2)GA可通過提高木葡聚糖內轉糖基酶(XET)相關基因的轉錄水平,增加細胞壁組成成分木葡聚糖,促使細胞伸長。(3)GA促使微管的排列方向與生長著的細胞的長軸垂直。在緩慢生長的節間中,其居間分生組織以上的細胞內微管方向發生傾斜,因而有利于細胞伸長[8]。赤霉素合成途徑
中的關鍵酶在擬南芥、水稻、南瓜、小麥、木薯和甘蔗等植物已經被克隆并進行表達及功能分析[9-15]。但是赤霉素生物合成過程極其復雜,參與的酶和影響其合成的因素很多,要深入了解GA信號傳導途徑尚需更深入的研究。
1 赤霉素的生物合成
赤霉素主要在高等植物的頂端幼嫩部位合成,如莖尖和根尖,以及生長中的種子和果實中。成熟的葉片也可以合成赤霉素,但很少輸出。赤霉素在細胞中的合成部位是質體、內質網和細胞質基質等處[1,16,17]。科學家經過幾十年的研究,現已基本確定高等植物赤霉素的生物合成途徑(圖1)。
根據赤霉素在細胞內不同的合成部位,其途徑大致分為3個階段:第1階段在質體中進行:由牻牛兒牻牛兒基焦磷酸(Geranylgeranyl diphosphate,GGDP)為赤霉素生物合成的前體,經古巴焦磷酸合成酶(Ent-copalyl diphosphate synthase,CPS)和內根-貝殼杉烯合成酶(Ent-kaurene synthase,KS)催化下環化為赤霉素的前身內根-貝殼杉烯(Entkaurene);第2階段在內質網中進行:內根-貝殼杉烯的C-19的甲基在內根-貝殼杉烯氧化酶(Ent-kaurene oxidase,KO)催化下不斷被氧化,分別形成內根-貝殼杉烯醇(Ent-kaurenol)、內根-貝殼杉烯醛(Entkaurenal)和內根-貝殼杉烯酸(Ent-kaurenoic acid,KA)。KA在內根-貝殼杉烯酸氧化酶(Ent-kaurenoic acid oxidase,KAO)的催化作用下,在C-7α位上進行3步脫氫氧化反應,逐步形成內根-7α-羥基貝殼杉烯酸和GA12-醛,它是GA的最初產物,進一步轉化成GA12,而在GA13氧化酶的作用下還可轉變為GA53;第3階段在細胞質基質中進行:由內質網合成的GA12和GA53運輸至細胞質基質中,在其C20處經GA20氧化酶、GA3氧化酶和GA2氧化酶進行一系列氧化作用下轉變為其他種類GAs。
2 赤霉素生物合成途徑的調控
赤霉素的生物合成與代謝是多種酶參與的多步驟酶促反應過程,植物細胞通過對這些基因表達的精確調控來調節赤霉素合成與代謝速率[19]。GA作為調控植物生長發育的重要激素之一,它的合成在時間和空間上都受到嚴格的控制,許多因素都直接或間接參與GA合成調控。在植物體內GA可以通過前饋或反饋來調節GA合成途徑的許多關鍵酶,控制赤霉素代謝[7]。赤霉素生物合成調節主要發生在轉導途徑后期,催化GA12轉變為GA4相關的酶有GA20-oxidase和GA3-oxidase。GA2-oxidase能將有生物活性赤霉素催化為無活性,擬南芥有5個GA2-oxidase能鈍化C19赤霉素的生物活性[20]。
到目前為止,科學家們對植物GA生物合成和代謝途經的調控領域研究相對成熟,主要集中于逆境、發育階段、光、溫度、活性GAs水平和其他激素對基因表達調節的研究(圖2)。
2.1 逆境對GA生物合成的調節
非生物脅迫可改變植物GA的代謝途徑。DDF1基因的超量表達導致擬南芥活性GA4含量減少和植株矮化,由DDF1基因編碼一個AP2與逆境應答緊密相關的干旱應答元件結合轉錄因子(DREBs)和DDF1在高鹽脅迫條件下表達強烈。在高鹽條件下,轉基因植物DDF1的超量表達和GA缺陷型ga1-3突變體的存活率較高,而施用活性GA處理的存活率降低[18]。通過檢測鹽脅迫GA相關突變體發現,DELLA蛋白在GA缺陷型ga1突變體中積累,在GA不敏感型gai-1突變體中趨于穩定水平。但在低鹽脅迫誘導生長條件下DELLA功能缺失型突變體的存活率降低,不能正常響應對鹽脅迫誘導生長的抑制。
張新蕊[22]在生長素和赤霉素參與調節低磷脅迫下玉米根系形態改變的研究中發現,低磷脅迫下,赤霉素受體的基因GID1a和GIDlb表達顯著上調,說明赤霉素信號轉導途徑處于較活躍狀態。對玉米進行GA3處理或低磷和GA3處理結果表明,在赤霉素合成過程中抑制控制早期步驟基因的表達,導致玉米根系GA20ox1和GA20ox的表達豐度顯著下降,卻促進GA2ox1和GA2ox2的表達。其分析GA3處理對GA20ox1、GA20ox2、GA2ox1和GA2ox2表達的影響,得出GA3處理拮抗低磷脅迫產生的效應。
2.2 光對GA生物合成的調節
光調節控制植物一生的生長和發育過程,以適應外界環境的變化。自然環境下,植物需要經過一定時間適宜的光周期誘導才能開花。經過誘導后的植物,內源性GA含量升高。光周期通過影響GA
水平和GA代謝調節植物的生長發育[1]。隱花色素能通過介導藍光調節GA代謝和代謝基因,影響GA水平和抑制下胚軸伸長,控制部分去黃化表型。擬南芥野生型對照或生長在黑暗或連續的藍光下的
cry1cry2(cryptochrome1/cryptochrome2)突變體幼苗,其體內的GA4含量沒有變化,這表明隱花色素也可以調節GA響應性和觸發細胞或者特定組織生物活性GA水平的變化[23]。

圖1 高等植物赤霉素生物合成途徑[18]
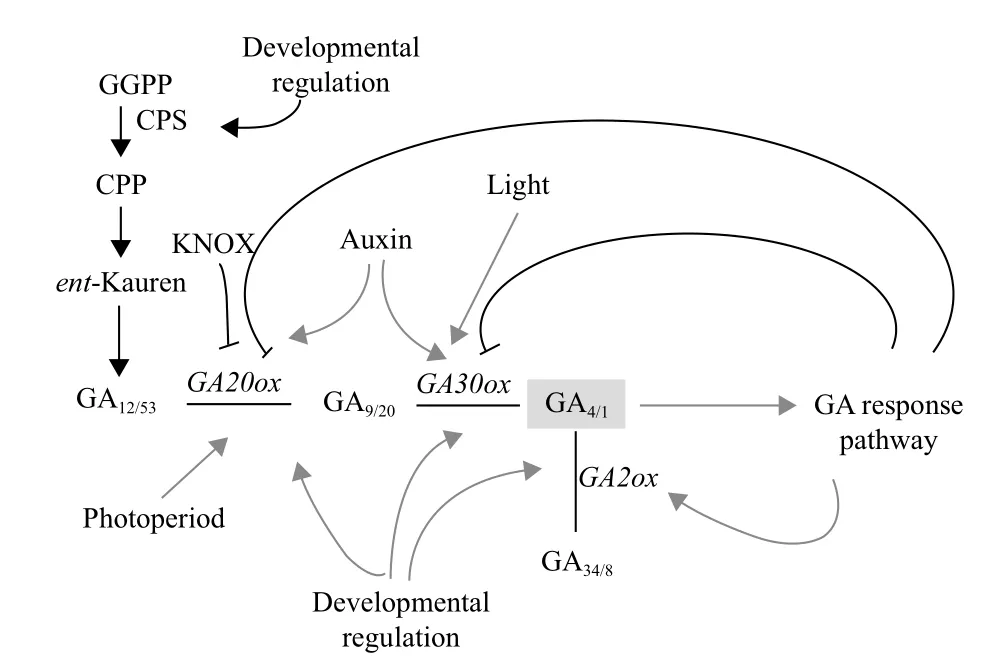
圖2 赤霉素合成和代謝酶基因的調控[21]
萵苣和擬南芥種子萌發取決于紅光照射,從而提高GA3ox的表達,導致活性GA含量增加。豌豆幼苗的去黃化改變GA20ox和GA3ox基因的表達,誘導GA1含量急速減少。綠色植物莖的伸長也受到不同的光輻照特性的影響。低輻光照能促進豌豆和油菜莖的伸長和活性GA含量的增加。光周期通過長日植物(如天仙子、金光菊和黑眼菊)和木本植物(如楊柳和雜交白楊)GA生物合成的不同階段調節活性GA的含量,主要是GA20ox和GA3ox基因的轉錄水平。光通過光敏色素改變GA生物合成和代謝及GA響應,調節需光植物莖的伸長[1,24]。
GA缺乏時,位于核內的DELLA蛋白累積在較高水平,并與光敏色素作用因子PIF3相互作用,阻止PIF3與靶基因啟動子結合和調節基因表達,從而消除PIF3介導光調節下胚軸伸長。GA充足時,GA受體GID1蛋白與核內DELLA蛋白相互作用得到提高,引發DELLA蛋白的泛素化和酶體介導降解,從而釋放出PIF3[25]。
2.3 溫度對GA生物合成的調節
植物種子的春化作用可調節內源GA的水平。經過低溫處理,擬南芥種子GA生物合成基因,如AtGA3ox1和AtGA20ox2,能夠通過適當地調節表達,導致體內GA水平升高,打破休眠,促進種子萌發。李波[26]在杜鵑花芽形態分化初期低溫GA對花期的影響結果顯示,隨著低溫處理時間的延長,其內源激素GA變化呈現先上升后下降的趨勢。在擬南芥中,低溫處理可提高AtGA20ox1和AtGA20ox2的表達,進而提高活性GA的水平。通過GC-MS分析表明,種子在4℃下的活性GA水平明顯高于22℃下的活性[1]。
2.4 生長階段對GA生物合成的調節
GA生物合成途徑早期是由單拷貝或小基因家族調控的。古巴焦磷酸合成酶(CPS)、內根-貝殼杉烯合成酶(KS)和氧化酶(KO)以及內根-貝殼杉烯酸氧化酶(KAO)主要促進GA早期的生物合成,多個CytP450單加氧酶催化內根-貝殼杉烯轉化為GA12。
CPS是GA生物合成途徑早期的主要限速酶之一。Silverstone等[27,28]研究發現在擬南芥各器官AtCPS轉錄水平極低,而當AtCPS過表達時,內源性內根-貝殼杉烯水平大增,這說明CPS可能限制擬南芥內根-貝殼杉烯的合成。在向日葵生長和發育階段GA生物合成早期,HaCPS1L、HaKS2L、HaKS3L基因受到高度調控表達。并且這3個基因的mRNA水平在快速生長的組織中極為豐富。HaKS2L的表達水平比HaCPS1L和HaKS3L較低。在種子發育過程中,胚快速生長期,HaCPS1L和HaKS3L基因的轉錄水平較高。而且這3個基因不受赤霉素活性的反饋調節[29]。HaKAO1在向日葵各個器官都有表達,而HaKAO2主要在根部表達[30]。
2.5 活性GA水平對GA生物合成的調節
通過外施活性GA可對植物內源活性GA起到調節作用。楊艷華等[31]對幾個水稻品種施用活性GA3的研究表明,GA3能夠促進水稻地上部分伸長生長,抑制根伸長生長;GA3誘導GA20ox2和GA3ox2基因表達,使內源性GA含量增加。吳建明等[15]采用實時熒光定量PCR研究施用活性GA誘導甘蔗GA20ox的表達情況,結果表明未經過GA處理的甘蔗GA20ox表達量最高,GA處理后GA20ox表達量持續下降,在6 h達到最低值,12 h后有所回升,但低于未處理的,到48 h又呈現明顯下降的情況。這說明外施高濃度的活性GA抑制植物內源活性GA生物合成,導致內源活性GA的含量下降。
2.6 其他激素對GA生物合成的調節
植物生長激素(如IAA)至少在一定程度上通過上調GA生物合成基因(如GA3ox和GA20ox)和下調GA分解代謝基因GA2ox的表達,導致生物活性GA1的水平升高,從而影響GA的新陳代謝,調節植物的生長[32]。
Wolbang和Ross等[33,34]采用14C同位素示蹤法在去除煙草頂芽IAA促進GA生物合成的研究發現,在去除煙草頂芽切口以下的節間組織中,內源性IAA、GA20和GA1的水平下降,GA生物合成途徑:由GA19轉變為GA20,再轉變為活性GA1的途徑降低,并出現由GA20轉變為GA29,再轉變為GA29代謝物的失活途徑;施用IAA后,GA1和GA20的含量增加,其GA20的水平是完整植株的3倍,但GA生物合成途徑由GA20轉變為GA1不能恢復到完整植株的水平。這表明IAA能夠促進GA的生物合成,具有協同作用。
GA與ABA、GA與PP333通常表現為拮抗作用。
GA能夠打破種子休眠,促進種子萌發,主要是GA刺激誘導糊粉層α-淀粉酶合成引起。而ABA能通過誘導生成一種脫落酸誘導蛋白激酶(PKABA)阻斷GA信號傳遞,抑制轉錄因子GAMyb的形成,從而抑制GA的生物合成和種子萌發,促進種子休眠[35]。楊艷華等[31]對幾個水稻品種施用10 mg/L ABA的研究表明,ABA處理嚴重抑制種子萌發和地上部伸長生長;ABA抑制GA20ox2和GA3ox2基因表達,使植物減少體內活性GA的含量。
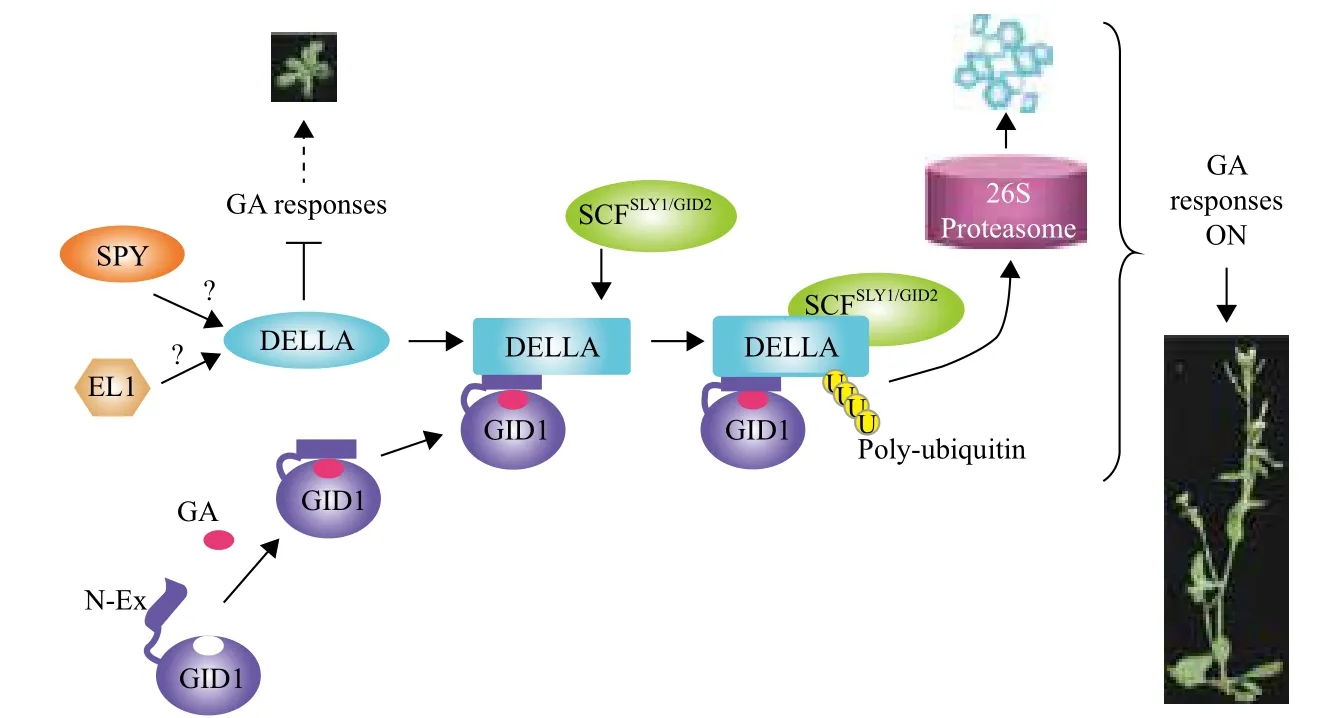
圖3 GA信號轉導模式[39]
劉芳等[36]在采用外源GA3和PP333對甜櫻桃新梢生長及赤霉素代謝關鍵基因表達的影響試驗結果表明,GA3可明顯促進新梢生長,GA3處理14 d后可使其內源GA3含量高于對照的1.2倍,隨后迅速下降,抑制GA20ox和GA3ox基因的轉錄表達;而PP333能顯著抑制新梢的生長,PP333處理后內源GA3含量呈持續下降趨勢,提高GA20ox和GA3ox基因的轉錄水平。PP333對水稻葉片衰老過程中游離GA4含量的影響中發現,PP333處理并不改變葉片內源游離GA4含量變化的進程,但降低了游離GA4的含量水平。這說明PP333對葉片內GA4的生成有抑制作用[37]。
3 赤霉素信號轉導模式
GA信號轉導通路中的組分主要包括受體、起到關鍵調控作用的DELLA蛋白以及介導DELLA蛋白降解的其他調控因子。GA信號轉導途徑已經基本被確定,根據這一模型(圖3)可知,當GA水平較低時,受體GID1不和GA結合,阻遏蛋白DELLA處于高水平,并與靶基因結合,抑制靶基因的轉錄,進而抑制植物的生長。翻譯后修飾,如糖基化和磷酸化也可能影響DELLA的活性。SPINDLY(SPY)是一個含有34個氨基酸重復序列的氧連N-乙酰氨葡萄糖[O-linked GlcNAc(O-GlcNAc)]轉移酶(OGT),主要起阻遏GA信號作用。在動物體內,O-GlcNAc定位于核和細胞質內,SPY可通過O-GluNAc修飾激活DELLA,而DELLA的磷酸化是以SPY同靶蛋白質的Ser/Thr位點的O-磷酸化競爭,去除O-磷酸
化而實現O-GluNAc修飾;SPY也能將GluNAc(N-乙酞氨基葡萄糖)轉移到含有Ser/Thr的靶蛋白上并對Ser/Thr基團進行糖基化而起到修飾作用。而水稻FLOWERING1(EL1)基因編碼的酪蛋白激酶,可使DELLA磷酸化活性保持穩定,因此它也具有阻遏GA信號的功能[7,38-41]。
GA受體GID1的N端具有一個N-Ex的靈活結構,當GA處于較高水平時,GID1可感知GA信號并與之結合,引發GID1的C端結構域的構象改變,從而使N端的N-Ex結構將GA封在GID1的結合位點上,形成GA-GID1復合體。進一步促進了與DELLA相互作用結合,形成較為穩定的GA-GID1-DELLA復合體。在由Skp1、cullin、F-box蛋白質和RING-H2域組成的E3連接酶復合物—SCF復合物的參與下,通過在靶蛋白上添加一個多聚泛素鏈,由此誘發通過26S蛋白酶復合體途徑降解DELLA,從而激活GA活性[39,42]。
4 結語
隨著生物技術的高速發展,人們對GA生物合成與代謝,以及信號轉導途徑有了更深入的了解,闡明了GA合成過程中一些關鍵基因的調節機制,信號轉導途徑中相關組分(GA、GID1和DELLA等)間的相互作用。但DELLA蛋白功能的分子機制方面還有許多問題有待解決。而在植物生長發育各個階段,GA與其他植物激素的水平是如何維持相對平衡的;在GA信號轉導途徑中,GA受體GID1的結構與功能存在什么樣的聯系;它們是如何進行識別與結合的;DELLA蛋白通過泛素化降解后,其代謝物的去向如何;這些問題都需要進一步深入地研究才能夠解答。SPY和EL1可能是GA信號傳導途徑中的反向作用因子,但SPY和EL1與DELLA蛋白的相互作用以及修飾反應的遺傳調控、分子生物學機制也有待進一步研究[8]。隨著GA合成與信號轉導分子機制的深入研究,將有助于GA廣泛應用于農業生產,加快種質創新與良種繁育。
[1]潘瑞熾. 植物生理學[M].第6版. 北京:高等教育出版社, 2008:167-280.
[2]左圓圓, 周楊楊, 李小平, 等. 植物激素-赤霉素(GA)細胞信號轉導機制[J]. 淮北師范大學學報:自然科學版, 2011, 32(2):49-54.
[3]王彥波, 鮮開梅, 張永華, 等. 赤霉素的應用研究進展[J].北方園藝, 2007(6):74-75.
[4]李保珠, 趙翔, 安國勇, 等. 赤霉素的研究進展[J].中國農學通報, 2011, 27(1):1-5.
[5]王洪梅, 周顯昌, 周志軍, 等. 赤霉素促進針葉樹開花結實技術的研究進展[J].林業科技, 2011, 36(3):11-15.
[6]Eriksson S, Bohlenius H, Moritz T, et al. GA4 is the active gibberellin in the regulation of LEAFY transcription and Arabidopsis floral initiation[J]. Plant Cell, 2006, 18(9):2172-2181.
[7]黃先忠, 蔣才富, 廖立力, 等. 赤霉素作用機理的分子基礎與調控模式研究進展[J].植物學通報, 2006, 23(5):499-510.
[8]談心, 馬欣榮. 赤霉素生物合成途徑及其相關研究進展[J].應用與環境生物學報, 2008, 14(4):571-577.
[9]Rieu I, Ruiz-Rivero O, Fernandez-Garcia N, et al. The gibberellin biosynthetic genes AtGA20ox1 and AtGA20ox2 act, partially redundantly, to promote growth and development throughout the Arabidopsis life cycle[J]. The Plant Journal, 2008, 53(3):488-504.
[10]Grennan AK. Gibberellin metabolism enzymes in rice[J]. Plant Physiology, 2006, 141(2):524-526.
[11]Lange T, Kappler J, Fischer A, et al. Gibberellin biosynthesis in developing pumpkin seedlings[J]. Plant Physiology, 2005, 139(1):213-223.
[12]Appleford NEJ, Evans DJ, Lenton JR, et al. Function and transcript analysis of gibberellin-biosynthetic enzymes in wheat[J]. Planta, 2006, 223(3):568-582.
[13]Bomke I, Rojas MC, Gong F, et al. Isolation and Characterization of the gibberellin biosynthetic gene cluster in Sphaceloma manihoticola[J]. Applied and Environmental Microbiology, 2008, 74(17):5325-5339.
[14]吳建明, 李楊瑞, 王愛勤, 等. 甘蔗GA20氧化酶基因片段克隆及序列分析[J].熱帶作物學報, 2009, 30(6):817-821.
[15]吳建明, 李楊瑞, 王愛勤, 等. 赤霉素誘導甘蔗GA20-Oxidase基因實時熒光定量PCR分析[J].分子植物育種, 2009, 7(5):922-927.
[16]岳川, 曾建明, 曹紅利, 等. 高等植物赤霉素代謝及其信號轉導通路[J].植物生理學報, 2012, 48(2):118-128.
[17]吳建明, 李楊瑞, 董偉清, 等. 赤霉素的生物合成及其在甘蔗上的應用研究[J]. 作物雜志, 2007, (6):23-30.
[18]Yamaguchi S. Gibberellin metabolism and its regulation[J]. Annual Review of Plant Biology, 2008, 59:225-251.
[19]張迎迎, 何祖華. 高等植物赤霉素的代謝與信號轉導[J].植物生理學通訊, 2010, 46(7):623-630.
[20]Middleton AM, úbeda-Tomás S, Griffiths J, et al. Mathematical modeling elucidates the role of transcriptional feedback in gibberellin signaling[J]. Proc Natl Acacl Sci USA, 2012, 109(19):7571-7576.
[21]Hedden P, Phillips AL. Gibberellin metabolism:new insights revealed by the genes[J]. Trends in Plant Science, 2000, 5(12):523-530.
[22]張新蕊.生長素和赤霉素參與調節低磷脅迫下玉米根系形態的改變[D]. 濟南:山東大學, 2011.
[23]Zhao XY, Yu XH, Foo E, et al. A study of gibberellin homeostasis and cryptochrome-mediated blue light inhibition of hypocotyl elongation[J]. Plant Physiology, 2007, 145(1):106-118.
[24]García-Martinez JL, Gil J. Light regulation of gibberellin biosynthesis and mode of action[J]. Journal of Plant Growth Regulation, 2001, 20(4):354-368.
[25]Feng SH, Martinez C, Gusmaroli G, et al. Coordinated regulation of Arabidopsis thaliana development by light and gibberellins[J]. Nature, 2008, 451(7177):475-479.
[26]李波. 生長調節劑與光溫處理對西洋杜鵑花期及內源激素的調控作用[D].杭州:浙江大學, 2012.
[27]Silverstone AL, Chang CW, Krol E, et al. Developmental regulation of the gibberellin biosynthetic genes GA1in Arabidopsis thaliana[J]. Plant J, 1997, 12(1):9-19.
[28]Yamaguchi S. Gibberellin biosynthesis in Arabidopsis[J]. Phytochemistry Reviews, 2006, 5(1):39-47.
[29]Pugliesi C, Fambrini M, Salvini M. Molecular cloning and expression profile analysis of three sunflower(Helianthus annuus)diterpene synthase genes[J]. Biochem Genet, 2011, 49(1-2):46-62.
[30]Fambrini M, Mariotti L, Parlanti S, et al. The extreme dwarf phenotype of the GA-sensitive mutant of sunflower, dwarf2, is generated by a deletion in the ent-kaurenoic acid oxidase1(HaKAO1)gene sequence[J]. Plant Mol Biol, 2011, 75(4-5):431-450.
[31]楊艷華, 張亞東, 朱鎮, 等. 赤霉素(GA3)和脫落酸(ABA)對不同水稻品種生長和生理特性及GA20ox2、GA3ox2基因表達的影響[J].中國水稻科學, 2010, 24(4):433-437.
[32]Reid JB, Davidson SE, Ross JJ. Auxin acts independently of DELLA proteins in regulating gibberellin levels[J]. Landes Bioscience Plant Signaling & Behavior, 2011, 6(3):406-408.
[33]Wolbang CM, Ross JJ. Auxin promotes gibberellin biosynthesis in decapitated tobacco plants[J]. Planta, 2001, 214(1):153-157.
[34]Ross JJ, O’Neill DP, Wolbang CM, et al. Auxin-gibberellin interactions and their role in plant growth[J]. Journal of Plant Growth Regulation, 2002, 20(4):346-353.
[35]石海燕, 郭靖, 周穎, 等. 赤霉素和脫落酸在植物生長發育中相互關系的研究進展[J].華中師范大學研究生學報, 2007, 14(1):138-142.
[36]劉芳, 袁華招, 沈欣杰, 等. 外源GA3和PP333對甜櫻桃新梢生長及赤霉素代謝關鍵基因表達的影響[J].核農學報, 2013, 27(3):272-278.
[37]俞炳呆, 嚴景華. PP333對水稻葉片衰老過程中內源GA4和ABA含量的調節作用[J].南京農業大學學報, 1995, 18(1):101-103.
[38]肖景華. 番茄GA20-氧化酶和GA2-氧化酶基因的克隆與功能分析[D].武漢:華中農業大學, 2006.
[39]Sun TP. Gibberellin-GID1-DELLA:a pivotal regulatory module for plant growth and development[J]. Plant Physiology, 2010, 154(2):567-570.
[40]王榮, 張根發.赤霉素信號轉導的中間組分研究[J].生物學雜志, 2007, 24(2):5-8.
[41]Wang YJ, Deng DX. Molecular basis and evolutionary pattern of GA-GID1-DELLA regulatory module[J]. Mol Genet Genomics, 2014, 289(1):1-9.
[42]Hirano K, Ueguchi-Tanaka M, Matsuoka M. GID1-mediated gibberellin signaling in plants[J]. Trends in Plant Science, 2008, 13(4):192-199.
(責任編輯 狄艷紅)
Gibberellins Biosynthesis and Signaling Transduction Pathway in Higher Plant
Li Qiang1,2Wu Jianming2Liang He1Huang Xing2Qiu Lihang2
(1. Agricultural College of Guangxi University,Nanning 530004;2. Key Laboratory of Sugarcane Biotechnology and Genetic Improvement(Guangxi),Ministry of Agriculture,P. R. China,Sugarcane Research Center,Chinese Academy of Agricultural Sciences,Nanning 530007)
The hormone gibberellins(GA)plays an essential role in many aspects of plant growth and development, such as promoting seed germination, stem elongation, occurrence of flower, fruit and seed development. This review elaborated the GA biosynthesis and signaling transduction pathway, as well as interactions with other hormones, response to the environment signals, and the recent advances in understanding of degradation of DELLA proteins by polyubiquitination of the DELLAs via the E3 ubiquitin-ligase SCFSLY1/GID2in the 26S proteasome. This helps not only people understanding of gibberellin physiology and its molecular regulating mechanism, but also to every aspect of gibberellin mechanism are studied deeply.
Gibberellins Signal transduction Plant hormones Regulation mechanism
2014-03-17
國家自然科學基金項目(31360312),國家科技支撐計劃子課題(2012BAD40B04-3)
李強,男,碩士研究生,研究方向:作物生理與調控;E-mail:274228904@163.com
吳建明,男,博士,副研究員,研究方向:甘蔗栽培及分子生物學;E-mail:wujianming2004@126.com

