2013年中日友好醫院臨床分離細菌耐藥性分析
邵 茁,賈紅兵,王 靖,楊 輝,部小霞
(中日友好醫院 檢驗科,北京 100029)
近年來隨著臨床廣泛應用抗菌藥物,細菌的耐藥性日益突出,已經成為公共衛生領域的嚴重問題。為了正確及時掌握醫院細菌耐藥性的變遷,為臨床提供合理用藥的參考,現將醫院2013年分離病原菌株分布和耐藥性進行分析總結,結果如下。
1 材料與方法
1.1 菌株來源
菌株為2013年1月~12月中日友好醫院臨床送檢的28123份標本。
1.2 主要試劑及儀器
中國蘭瓊脂、M-H瓊脂、木糖-賴氨酸-脫氧膽 酸 瓊 脂 (xylose-lysine-desoxycholate agar,XLD)、環絲氨酸-頭孢甲氧霉素-果糖培養基(cycloserine-cefoxitin-fructose agar,CCFA)均購自英國Oxoid公司;血平板、加萬古霉素巧克力平板培養基購自北京賽默飛公司;BacT/Alert3D全自動血培養儀和VITRK-2全自動細菌鑒定藥敏儀及其試劑(法國生物梅里埃公司)。
1.3 質控菌株
大腸埃希菌ATCC25922、銅綠假單胞菌ATCC27853、金黃色葡萄球菌ATCC29213來自衛生部臨床檢驗中心;肺炎鏈球菌ATCC49619、陰溝腸桿菌ATCC700323、鉛黃腸球菌ATCC700327由法國生物梅里埃公司提供。
1.4 方法
1.4.1 細菌培養和傳代培養
疑似血流感染患者血液標本注入需氧和厭氧血培養瓶,成人為8~10ml/瓶,兒童為4~5ml/瓶(僅做需氧血培養),使用BacT/Alert3D全自動血培養儀進行動態監測。血液標本經血培養儀培養陽性后轉種平板,革蘭氏染色鏡檢。
疑似呼吸系統感染患者痰液等標本培養,接種于血平板、中國蘭平板和加萬古霉素巧克力平板培養基,放置于含5%二氧化碳、35℃培養箱中培養。
疑似泌尿系統感染患者尿液標本培養,接種于血平板(取1μl標本密涂,用于菌量計數)和中國蘭平板,放置于普通環境、35℃培養箱中培養。
疑似消化系統感染患者便標本培養,依據檢驗申請單目標細菌培養分別選擇血平板、中國蘭平板、XLD平板、CCFA平板等一種或幾種培養基,放置于普通環境或厭氧環境、35℃培養箱中培養。
疑似生殖系統感染或其他無菌部位感染患者標本培養,選擇血平板、中國蘭平板或淋病奈瑟菌選擇平板或巧克力平板,放置于含5%二氧化碳、35℃培養箱中培養。
1.4.2 鑒定及藥敏試驗
VITRK-2全自動細菌鑒定藥敏儀進行菌種鑒定和藥物敏感試驗,革蘭氏陽性球菌選用GP鑒定卡、P67或P68藥敏卡;革蘭氏陰性桿菌選用GN鑒定卡、N09或N16藥敏卡。結果判斷參考CLSI 2013 M100-S23[1]。

表1 主要分離菌株及患者標本分布(按分離菌株數量排序)

表2 大腸埃希菌不同分離部位的體外藥敏結果抗菌藥物 (%)
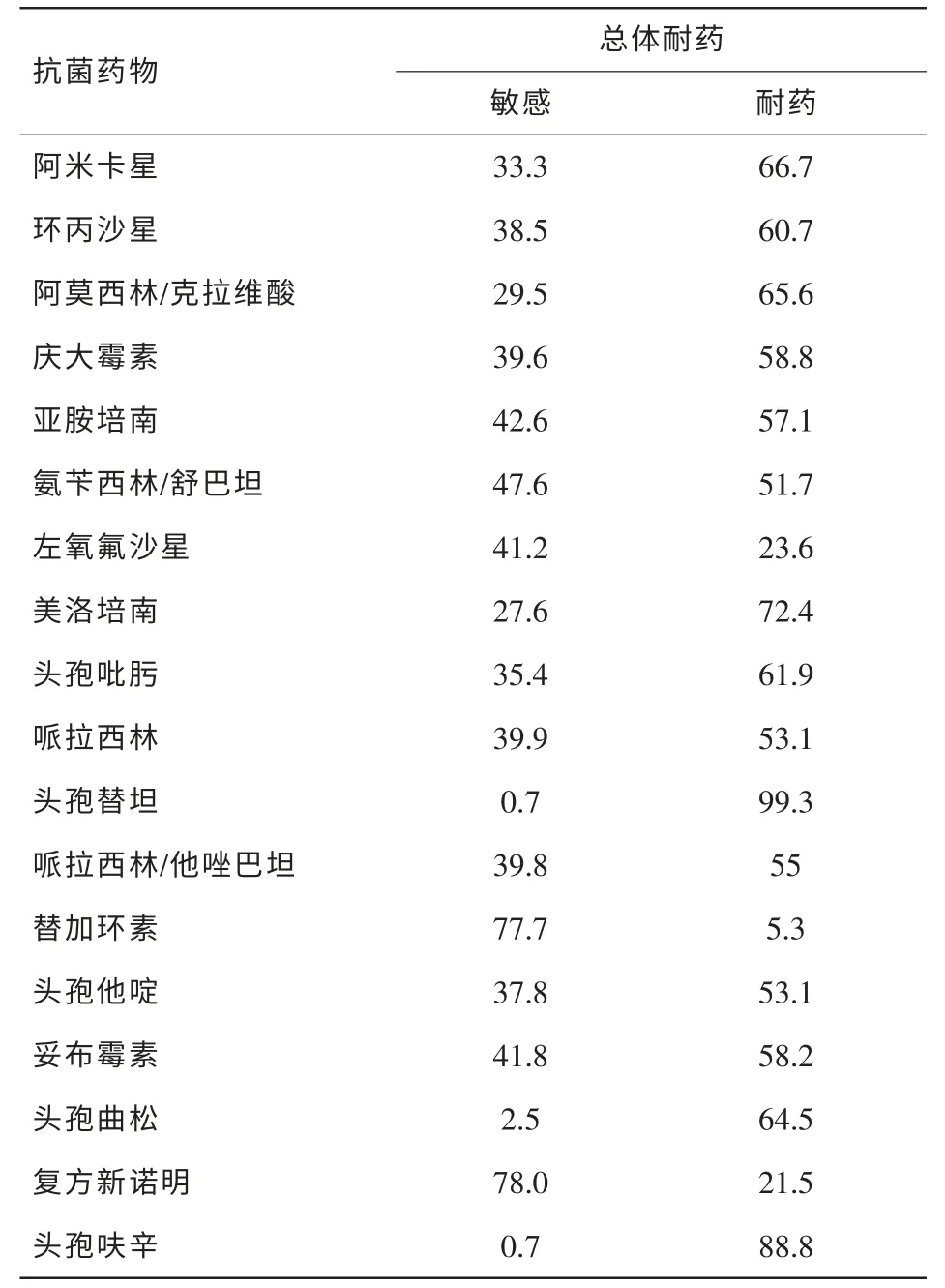
表3 鮑曼不動桿菌的體外藥敏結果 (%)
1.4.3 頭孢西丁篩選試驗
VITRK-2全自動細菌鑒定藥敏儀配套藥敏卡P67可進行頭孢西丁篩選試驗,檢測MRSA和MRCNS,結果判斷參考CLSI 2013 M100-S23[1]。
1.5 統計學方法
數據采用WHONET 5.6軟件進行統計分析。
2 結果
2.1 主要分離菌株及患者標本分布
按患者首次分離非重復菌株統計,2013年1月~12月醫院總共分離3977株菌,主要分離菌株及其排名前4位的分離部位見表1。
2.2 主要分離菌株的耐藥率
2.2.1 大腸埃希菌藥敏分析
(患者首次分離非重復菌株為統計對象)具體見表2。其中分離到5株碳青霉烯酶類藥物耐藥的大腸埃希菌(0.9%,5/567),3株分離自痰,1株分離自尿、1株分離自胸水。
2.2.2 鮑曼不動桿菌藥敏分析
由于鮑曼不動桿菌主要分離于痰標本(86.3%,315/365),其他標本來源的菌株所占比例小,因此采用總體耐藥率進行分析,具體見表3。
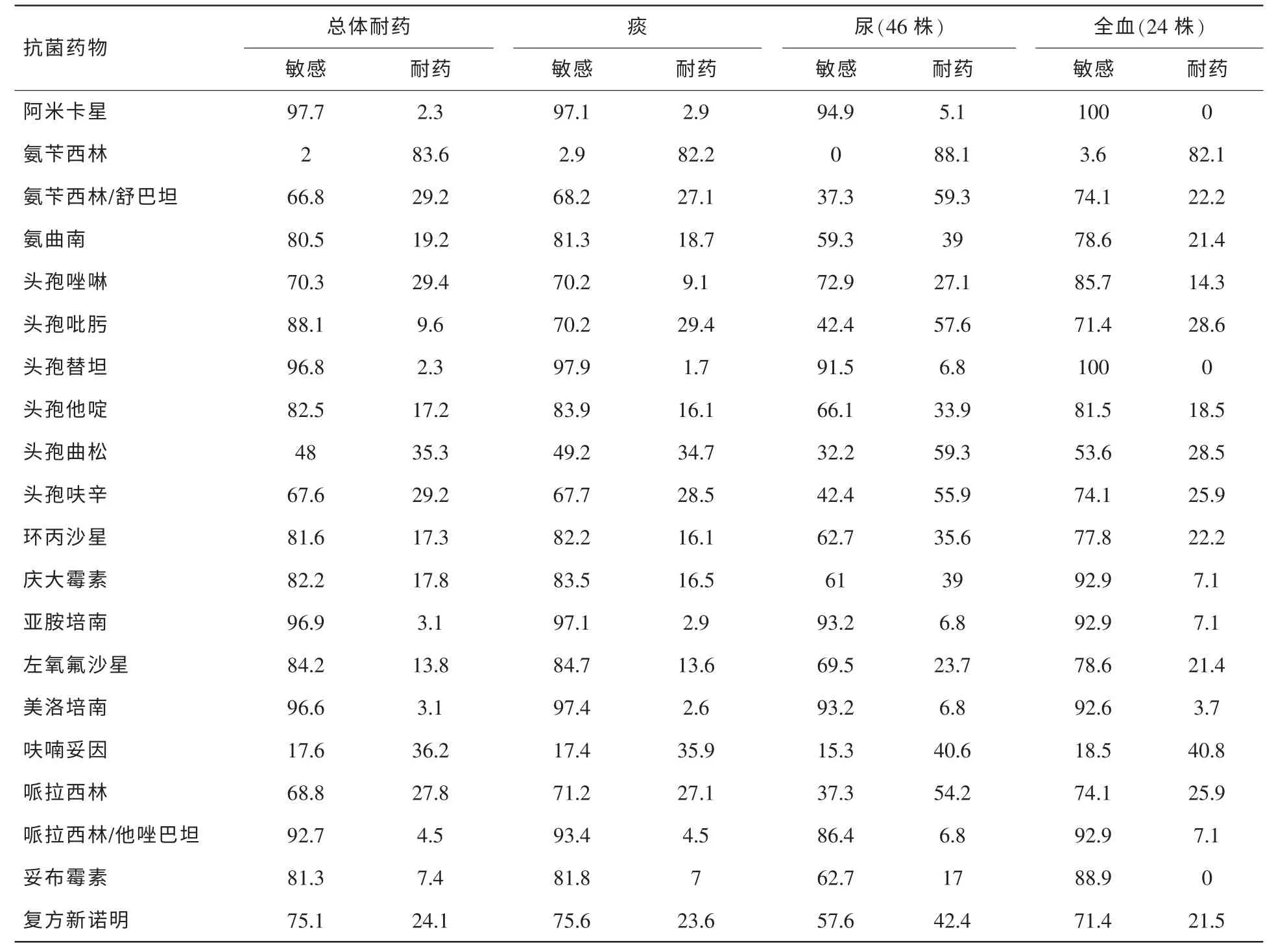
表4 肺炎克雷伯菌不同分離部位的體外藥敏結果 (%)
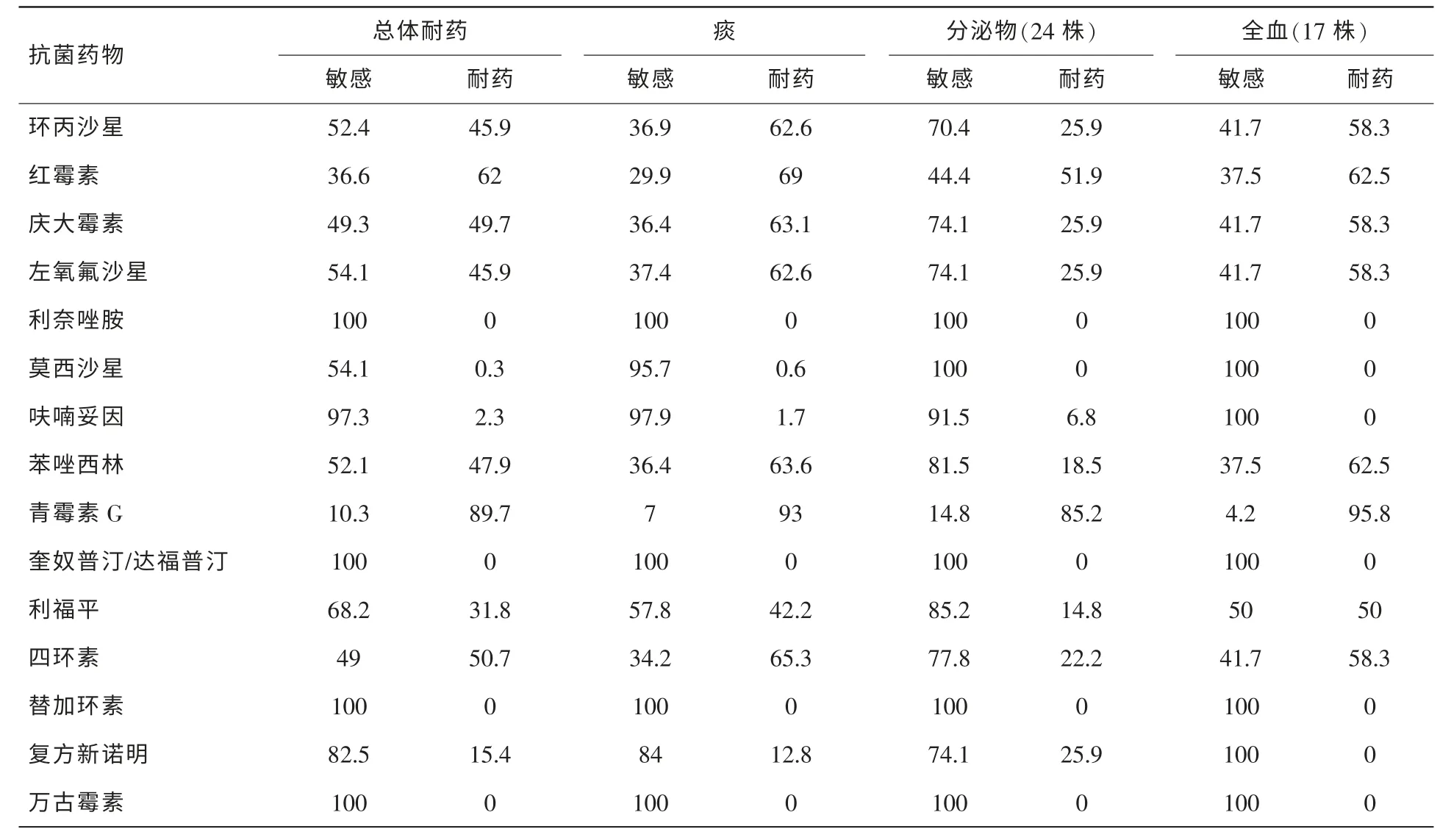
表5 金黃色葡萄球菌不同分離部位的體外藥敏結果 (%)
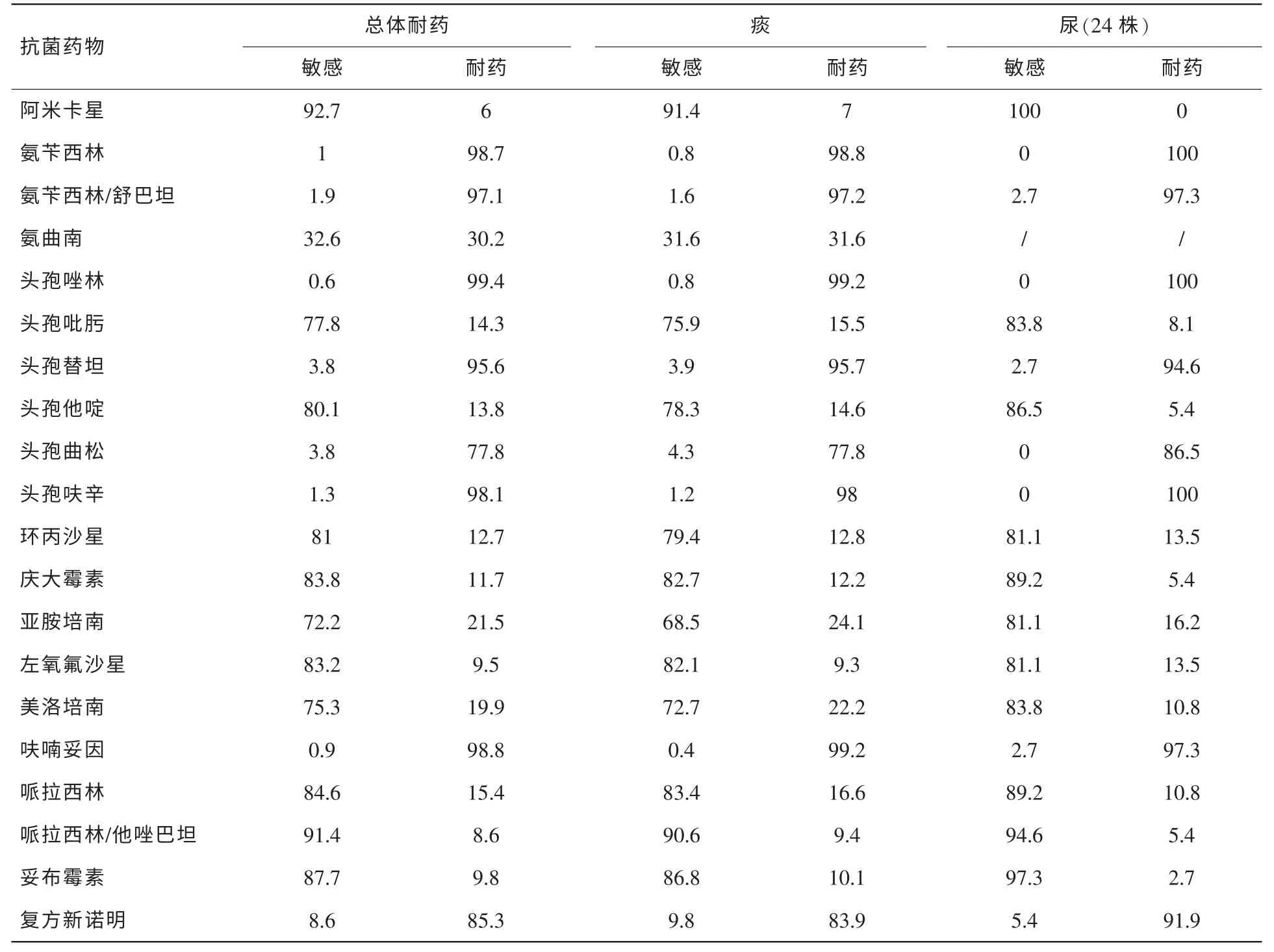
表6 銅綠假單胞菌不同分離部位的體外藥敏結果 (%)
2.2.3 肺炎克雷伯菌藥敏分析
具體見表4。其中分離到11株碳青霉烯酶類藥物耐藥的肺炎克雷伯菌(3.1%,11/354),5株分離自痰,3株分離自尿、另外3株分別分離自全血、胸水和傷口分泌物。
2.2.4 金黃色葡萄球菌藥敏分析
表5示,金黃色葡萄球菌共分離292株,其中MARS為146株(50.0%);凝固酶陰性葡萄球菌共分離301株,其中MRCNS為237株(78.7%)。未發現耐萬古霉素的葡萄球菌。
2.2.5 腸球菌屬藥敏分析
糞腸球菌共分離到183株,其中耐萬古霉素糞腸球菌1株(0.6%,1/183),分離自尿;屎腸球菌共分離到140株,其中耐萬古霉素屎腸球菌29株(20.7%,29/140),8株分離自尿,8株分離自痰、5株分離自全血,11株分離自其他部位。
2.2.6 銅綠假單胞菌藥敏分析(見表6)
3 討論
本研究對醫院2013年所分離3977株細菌分析表明,鮑曼不動桿菌、銅綠假單胞菌、大腸埃希菌、肺炎克雷伯菌和金黃色葡萄球菌是目前主要院內感染致病菌。分離自痰標本的主要病原菌依次為鮑曼不動桿菌、銅綠假單胞菌、肺炎克雷伯菌、金黃色葡萄球菌、嗜麥芽窄食單胞菌、大腸埃希菌、陰溝腸桿菌,約占所有痰分離菌株量的80%,其是呼吸道感染主要的定植菌或致病菌;分離自尿標本的主要病原菌依次為大腸埃希菌、糞腸球菌、屎腸球菌、肺炎克雷伯菌、銅綠假單胞菌、奇異變形桿菌,其中大腸埃希菌約占所有尿分離菌株量的40%;分離自血液標本的主要病原菌依次為凝固酶陰性葡萄球菌、大腸埃希菌、肺炎克雷伯菌、金黃色葡萄球菌、屎腸球菌、鮑曼不動桿菌、糞腸球菌,其中凝固酶陰性葡萄球菌分離率高多源于醫護人員醫療操作污染,大腸埃希菌是引起醫院血流感染的第一位病原菌。本研究提示,臨床醫生可根據各種細菌標本分布部位的不同,針對患者的感染部位更及時合理的經驗性選取抗生素治療。
2013年醫院分離的金黃色葡萄球菌中MRSA的檢出率為50.0%,凝固酶陰性葡萄球菌中MRCNS檢出率78.7%,均與CHINET2012報告結果接近[2]。金黃色葡萄球菌中未發現萬古霉素耐藥株,腸球菌屬中耐萬古霉素腸屎腸球菌占20.7%;耐萬古霉素糞腸球菌占0.6%,發現少量利奈唑胺耐藥屎腸球菌(0.7%)。
近年來由于頭孢菌素的不規范使用及超廣譜β-內酰胺酶的產生,腸桿菌科細菌的耐藥性逐年上升,對一代、二代頭孢菌素耐藥性高,第三代頭孢菌素越來越多的被醫生所選擇,而醫院大腸埃希菌、肺炎克雷伯菌對三代頭孢菌素類抗生素頭孢曲松的耐藥率由2007年的49.2%、21.7%上升至2013年的78.5%、35.3%,這又導致醫生選擇抗菌藥物的壓力越來越大。監測結果顯示,耐碳青霉烯類腸桿菌科細菌(carbapenemase-resistant Enterobacteriaceae,CRE)已在我院出現且發生率逐年增高,其中碳青霉烯類耐藥肺炎克雷伯菌比2012年(共分離5株)增長了120%。本年度發現的CRE菌株主要分離自痰 (47.1%)、尿液(29.4%)、胸水(11.8%)等部位,多出現在重癥監護病房(47.1%),普通外科(17.6%)及急診(11.8%),且多集中在病情危重或手術創傷患者。引起碳青霉烯類耐藥的主要原因包括產碳青霉烯酶、膜孔蛋白缺失或突變合并AmpC酶或ESBLs酶的高表達以及外排泵[3]。其中產碳青霉烯酶是CRE最主要的耐藥機制。隨著碳氫霉烯類抗菌藥物廣泛使用,碳青霉烯酶耐藥基因在腸桿菌科細菌中呈現出蔓延趨勢。CRE在醫院可能導致患者臨床治療無效、延長住院時間及死亡率增高等一系列嚴重后果。研究表明,多黏菌素B、替加環素、磷霉素等對CRE菌株有良好抗菌活性[4],推薦聯合療法用于治療CRE感染。目前上述藥物并未列入醫院革蘭氏陰性菌常規耐藥性監測范疇,因此對于CRE有必要加做上述藥物的藥敏試驗,指導臨床更合理用藥。
2013年度醫院鮑曼不動桿菌對亞胺培南和美洛培南的耐藥率分別57.2%和72.4%,與2012年度監測結果基本相同,亦與CHINET2012報告結果接近[2]。多重耐藥或全耐藥鮑曼不動桿菌給臨床感染的治療帶來嚴峻的挑戰。替加環素治療多重耐藥革蘭陰性菌感染特別是鮑曼不動桿菌療效較好,本研究為77.7%敏感,17%中介,5.3%耐藥,說明鮑曼不動桿菌已經開始出現部分替加環素的耐藥株。研究表明鮑曼不動桿菌對替加環素耐藥與AdeABC外排泵系統有關[5]。有學者指出臨床上多重耐藥鮑曼不動桿菌引起的嚴重感染應使用替加環素聯合用藥[6,7]。
2013年度醫院共分離出23株艱難梭菌(分離率14.3%,23/161),主要分離自中醫呼吸科(43.5%),急診科(17.4%)等。艱難梭菌感染是導致醫院內抗生素相關性腹瀉的最重要因素之一,隨著抗生素的廣泛使用,艱難梭菌感染的發生率和病死率日漸升高。診斷艱難梭菌感染除了結合患者腹瀉的臨床癥狀,在艱難梭菌培養陽性的同時應配合檢測艱難梭菌毒素[8]。進一步研究表明,醫院2013年艱難梭菌在中醫呼吸科存在小范圍的院內感染流行,因此對于艱難梭菌感染的控制除了要合理應用抗生素,還要注重環境消毒及醫護人員的手衛生。
[1] CLSI.Performance standards for antimicrobial susceptibility testing;twentieth informational supplement[S].M100-S23,2013.
[2] 汪復,朱德妹.2012年中國CHINET細菌耐藥性監測[J].中國感染與化療雜志,2013,13(5):321-330.
[3] 吳森泉,邱晨.碳青霉烯類耐藥腸桿菌科細菌研究現狀[J].廣東醫學,2013,34(17):2718-2721.
[4] Van DuinDV,Kaye RS,Neuner EA,et al.Carbapenem resistant Entero-bacteriaceae:a review of treatment and outcomes[J].Diagn Microbiol Infect Dis,2013,75(2):115-120.
[5] Coyne S,Guigon G,Courvalin P,et al.Screening and quantification of the expression of antibiotic resistance genes in Acinetobacter baumannii with a microarray[J].Antimicrob Agents Chemother,2010,54(1):333-340.
[6] Lee K,Yong D,Jeong SH,et al.Multidrug-resistant Acinetobacter spp:increasingly problematic nosocomial pathogens[J].Yonsei Med J,2011,52(6):879-891.
[7] 沈丹,薛婧,張蕊,等.某三甲醫院鮑曼不動桿菌耐藥性分析[J].武警醫學,2013,24(10):869-871.
[8] Cohen SH,Gerding DN,Johnson S,et al.Clinical practice guidelines for Clostridium difficile infection in adults:2010 update by the society for healthcare epidemiology of America(SHEA)and the infectious diseases society of America(IDSA)[J].Infect Control Hosp Epidemiol,2010,31(5):431-455.

