高活性甲殼素脫乙酰基酶產生菌種篩選
活 潑,梅 瑜,饒桂維,王 楠,李成平,林榮業
(1.浙江樹人大學生物與環境工程學院,浙江杭州 310015;2.浙江金殼生物化學有限公司,浙江臺州 317602)
高活性甲殼素脫乙酰基酶產生菌種篩選
活 潑1,梅 瑜1,饒桂維1,王 楠1,李成平1,林榮業2
(1.浙江樹人大學生物與環境工程學院,浙江杭州 310015;2.浙江金殼生物化學有限公司,浙江臺州 317602)
從新疆極端氣候土壤樣品中篩選到一組高產脫乙酰基酶活性的嗜熱芽孢桿菌ctn C8-1,、ctn C8-1、ctn×5-3、ctn×10、ctn C8-3-2a。試驗結果表明,其中菌株C8-3-2a的產酶活性最高,可在50℃以上的高溫下生長;在甲殼素平板中培養48 h后,其透明圈與菌落直徑比高。以甲殼素為主要碳源發酵96 h后,甲殼素全部降解成可溶性的低聚物。發酵液經微孔過濾除去菌體細胞后,以甲殼素為底物,37℃作用120 h后,甲殼素完全降解,并生成較多的乙酸,說明有較高的甲殼素降解酶和甲殼素脫乙酰基酶活性。
嗜熱芽孢桿菌;甲殼素脫乙酰基酶;甲殼素降解酶
甲殼素(chitin)是僅次于纖維素的第2大類天然高分子化合物,廣泛存在于蝦、蟹等甲殼類水產動物中。浙江省是海洋大省,水產業在經濟發展中占有重要地位,每年海水養殖的蝦蟹類產量超過6萬t,遠洋捕撈的蝦蟹類超過80萬t。甲殼素是水產加工中產量較大的副產物,每年的產量約5萬t以上。甲殼素的加工主要是通過甲殼素脫乙酰基生產殼聚糖,然后水解殼聚糖得到各類甲殼素低聚糖。目前甲殼素脫乙酰基過程中主要采用高溫強堿脫去乙酰基生產殼聚糖,然后殼聚糖再用強酸水解成各類低聚糖,這種方法存在耗能大、產物純化難、產品脫乙酰度不均一等缺點,同時帶來嚴重的環境污染問題。如以酶法進行生物轉化甲殼素制備殼寡糖等甲殼素衍生物則能耗低,基本無污染,可以達到清潔生產。因此得到高活性胞外甲殼素脫乙酰基酶及降解酶的微生物是開發甲殼素資源一個亟待解決的課題。本研究從新疆極端氣候地區土壤中分離得到一組嗜熱芽孢桿菌能產生高活性的胞外甲殼素脫乙酰基酶和甲殼素降解酶,在脫乙酰基的同時高效降解甲殼素,同一株微生物在其生長過程中既能合成高活性的胞外脫乙酰酶,又能合成高活性的甲殼素降解酶,在國內外均未見有相關報道[1-5]。
1 材料與方法
1.1 樣品
土壤樣品采集于新疆極端氣候地區。甲殼素樣品源于魷魚殼,將其粉碎過60目篩備用。
1.2 培養基
1.2.1 平板培養基
以甲殼素為主要碳源,每100 m L培養基添加酵母提取物,KH2PO4,MgSO4,CaCl2,NaCl和NH4Cl分別為0.14,0.5,0.4,0.05,0.2和0.5 g,瓊脂2 g,水100 m L,調節pH值至7.0~7.2。
1.2.2 液體培養基
平板培養基不加瓊脂,其他同。
1.3 酶活性測定
甲克素降解酶采用DNS方法。甲殼素脫乙酰酶催化脫去一個乙酰基,產生一分子乙酸。試驗通過測定反應液中乙酸濃度的變化,測定甲殼素脫乙酰基酶的活性。
酶活單位定義(U)。在最適條件下,1 min催化產生相當于1μmol的乙酸所需的酶量。
測定方法。稱取粉碎過60目篩的甲殼素100 mg,置于30 m L三角瓶中,121℃滅菌后,加入過濾除菌的發酵液10 m L,在37℃搖床71 r·min-1反應168 h,取樣檢測反應液乙酸含量。
2 結果與分析
2.1 甲殼素脫乙酰基酶菌種
采用雙層平板法篩選,取土樣1 g梯度稀釋后涂布平板,置于46℃培養箱中培養96 h,挑去透明圈較大的單菌落,進一步培養研究。試驗由土壤樣品中篩選獲得5株產酶活性較高的菌種,ctn C8-1,、ctn C8-1、ctn×5-3、ctn×10、ctn C8-3-2a,其中以ctn C8-3-2a為最好(圖1)。
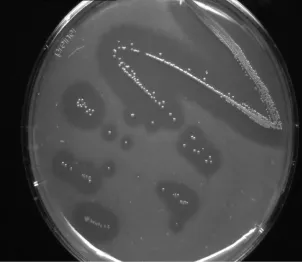
圖1 菌種ctn C8-3-2a
經初步的生化特性及形態學鑒定結果表明,分泌甲殼素脫乙酰酶的ctn C8-1,、ctn C8-1、ctn×5-3、ctn×10、ctn C8-3-2a菌株為革蘭氏陽性菌,好氧,短桿狀,芽孢柱形中生,孢囊不膨大,菌落乳白色,半透明,表面光滑,邊緣整齊,大小為1~2 mm。生長溫度范圍40~57℃,最適生長溫度46℃,生長pH值6~10,最適pH值7~8。可利用甲殼素作為唯一碳源,根據以上特征與《伯杰氏系統細菌手冊》對照,初步表明這5個菌株為芽孢桿菌屬成員。
2.2 液體培養基
由圖2可以看出,ctn C8-3-2a菌種的降解效果較其他菌種為好。
2.3 菌株甲殼素脫乙酰氨基酶活性
由圖3可見,居中的瓶中甲殼素基本被降解,效果顯著。
從圖4可以看出,隨著反應時間的增長,菌株C8-3-2a的反應液中的乙酸含量不斷增加,菌株ctn×5-3雖也有相同趨勢,但不及C8-3-2a在較短的時間內達到較高乙酸含量。結合圖3可見,C8-3-2a降解甲殼素的能力比其他菌株要高,說明C8-3-2a具有較高的甲殼素降解酶和脫乙酰氨基酶活性,故選擇菌株C8-3-2a做進一步研究。
2.4 脫乙酰氨基酶

圖2 ctn C8-1,、ctn C8-1、ctn×5-3、ctn×10、ctn C8-3-2a對甲殼素的降解影響

圖3 菌株發酵液過濾除菌后酶液降解甲殼素情況

圖4 菌株酶液反應后乙酸含量的測定結果
將培養基中的甲殼素以葡萄糖替代進行發酵試驗,結果(圖5)發現,菌株可利用葡萄糖生長良好,但不產生脫乙酰氨基酶。由此可見,甲殼素是這些菌株產生脫乙酰氨基酶的必須的誘導因子,所以這些菌株產生的脫乙酰氨基酶為誘導酶。
3 小結和討論

圖5 培養基中葡萄糖替代甲殼素的發酵酶液乙酸含量檢測
甲殼素脫乙酰酶來源廣泛,包括一些真菌、植物病原體和昆蟲等,目前產甲殼素脫乙酰酶的菌種篩選主要為真菌類,如來自真菌的多種脫乙酰酶已被純化,少量編碼基因被克隆,包括魯氏毛霉、菜豆炭疽病菌、布拉克須霉、裂褶菇、白粉病菌、構巢曲霉、藍色犁頭霉和釀酒酵母。其中以構巢曲霉和藍色犁頭霉的脫乙酰基酶活性較高,來自細菌的脫乙酰酶報道很少。本研究從新疆極端氣候地區土壤中分離得到這些嗜熱芽孢桿菌(野生菌),能合成高活性的胞外脫乙酰酶,同時具有甲殼素降解能力。其中菌株C8-3-2a的產酶活性高,初步的研究結果表明,其可在50℃以上的高溫下生長,在甲殼素平板中,培養48 h后,其透明圈與菌落直徑比高。以甲殼素為主要碳源發酵96 h后,甲殼素全部降解成可溶性的低聚物。發酵液經微孔過濾除去菌體細胞后,以甲殼素為底物,37℃作用120 h后,甲殼素完全降解,并生成較多的乙酸,這說明有較高的甲殼素降解酶和甲殼素脫乙酰基酶活性。這些試驗結果說明,菌株C8-3-2a既分泌甲殼素脫乙酰基酶又分泌甲殼素降解酶,且活性較高。同一株微生物在其生長過程中既能合成高活性的胞外脫乙酰酶又能合成高活性的甲殼素降解酶,在國內外均未見有相關報道。因此,有必要對該菌進行進一步甲殼素生物轉化的研究,以期應用于甲殼素衍生物的工業化生產[6-15]。
[1] 蔣挺大.甲殼素[M].北京:化學工業出版社, 2003:1-55.
[2] 代養勇,曹健,王中太.甲殼素傳統法與微波法制備殼聚糖的比較[J].食品工業科技,2006,27(6):54-57.
[3] Souza R F,Gomes R C,Coelho R R R,et al.Purification and characterization of an endochitinase produced by Colletrichum gloeosporioides[J].FEMS M icrobiology Letters,2002,222(1):45-50.
[4] M ing M,Kuroiwa T,Ichikawa S,et al.Production of chitosan oligosaccharides by chitosanase directly immobilized on an agar gel-coated multidisk impeller[J].Biochemical Engineering Journal,2006,28(3):289-294.
[5] Heredia A,Aguilar-Franco M,Magaαa C.Structure and interactions of calcite spherulites withα-chitin in the brown shrimp(Penaeus aztecus)shell[J].Materials Science and Engineering:C,2007,27(1):8-13.
[6] Jeraj N,Kuni?c B,Lenasi H.Purification and molecular characterization of chitin deacetylase from Rhizopus nigricans[J].Enzyme and Microbial Technology,2006,39(6):1294-1299.
[7] Cai J,Yang J,Du Y.Enzymatic preparation of chitosan from the waste Aspergillus niger mycelium of citric acid production plant[J].Carbohydrate Polymers,2006,64:151-157.
[8] Dahiya N,Tewari R,Hoondal G S.Biotechnological aspects of chitinolytic enzymes:a review[J].Appllied M icrobioogy and Biotechnology,2006,71(6):773-782.
[9] Fukamizo T,Brzezinski R.Chitosanase from Streptomyces sp. strain N174:a comparative review of its structure and function[M].Biochemistry and Cell Biology,1997,75(6):687-696.
[10] Shresthaa B,Blondeaub K,Stevens W,et al.Hegaratb Expression of chitin deacetylase from Colletotrichum lindemuthianum in Pichia pastoris:pu rification and characterization[J].Protein Expression and Purification, 2004,38(2):196-204.
[11] Kim SK,Rajapakse N.Enzymatic production and biological activities of chitosan oligosaccharides(COS):A review[J]. Carbohydrate Polymers,2005,62(4):357-368.
[12] 蔣霞云,周培根,李燕.幾種霉菌產甲殼素脫乙酰酶活力比較及部分酶學性質[J].上海水產大學學報,2006,15(2):211-215.
[13] 蔡俊,杜予民,楊建紅,等.甲殼素脫乙酰酶產生菌的篩選及產酶條件[J].武漢大學學報:理學版,2005,51(4):485-488.
[14] Aye K N,Karuppuswamy R,Ahamed T,et al.Peripheral enzymatic deacetylation of chitin and reprecipitated chitin particles[J].Bioresource Technology,2006,97(4):577-582.
[15] Cai J,Yang J,Du Y,et al.Purification and characterization of chitin deacetylase from Scopulariopsis breυicaulis[J]. Carbohydrate Polymers,2006,65(2):211-217.
(責任編輯:張瑞麟)
TS 254.9
B
0528-9017(2014)03-0390-03
文獻著錄格式:活潑,梅瑜,饒桂維,等.高活性甲殼素脫乙酰基酶產生菌種篩選[J].浙江農業科學,2014(3):390-392.
2013-10-12
浙江省玉環縣科技局科技計劃項目(201113)
活 潑(1962-),女,新疆伊犁人,研究員,博士,主要從事食品生物技術研究工作。E-mail:xka-8@163.com。
李成平。E-mail:hzlicp@163.com。

