阿膠中馬和驢成分的實時熒光PCR檢測
吳亞君,王 斌,劉鳴暢,韓建勛,李新實,陳 穎
阿膠中馬和驢成分的實時熒光PCR檢測
吳亞君,王 斌,劉鳴暢,韓建勛,李新實,陳 穎*
(中國檢驗檢疫科學研究院農產品安全研究中心,北京 100123)
建立阿膠中馬和驢成分高特異、高靈敏的實時熒光聚合酶鏈式反應(polymerase chain reaction,PCR)檢測方法。選擇馬和驢線粒體基因tRNA-Thr及D-loop區為靶序列,設計合成特異引物,通過普通PCR和實時熒光PCR檢測,結果表明,這兩對引物能夠準確檢測阿膠或動物膠中馬和驢成分。
阿膠;馬;驢;實時熒光PCR
1 材料與方法
1.1 材料
1.1.1 樣品
馬血清、驢血清來自山東出入境檢驗檢疫局;駱駝肉、豬肉、牛肉、貂肉、狗肉、雞肉、鹿茸、貓肉、狍子肉、鼠肉、兔肉、鴨肉、羊肉、魚肉、大豆、大米、玉米、黃瓜、胡蘿卜為本實驗室收集樣品。正品阿膠塊、未知來源的阿膠樣品(1~6)。
1.1.2 試劑
DNeasy Mericon Food Kit(50)試劑盒(貨號:69514)德國Qiagen公司;Wizard Magnetic DNA Purification System for Food試劑盒(貨號:FF3751) 美國Promega公司;Nucleospin Food試劑盒(貨號:74094550) 德國MN公司;十六烷基三甲基溴化銨(cetyl trimethyl ammonium bromide,CTAB)提取液(54.9 mmol/L CTAB、1.4 mol/L NaCl、0.1 mol/L Tris-HCl、0.02 mol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),pH 8.0)、CTAB沉淀液(13.7 mmol/L CTAB、40 mmol/L NaCl)、無水乙醇、PCR預混液(TaqManGene Expression Master Mix,貨號:4369016) 美國ABI公司;蛋白酶K(20 mg/mL,貨號:P6556-100MG)美國Sigma公司;DNA 1000 LabChip(貨號:5067-1504) 美國Agilent公司;滅菌水。
1.1.3 儀器與設備
Reriti 96Well Thermal Cycler PCR儀、7500 Real Time PCR System實時熒光PCR儀 美國ABI公司;2100 Bioanalyzer毛細管芯片電泳儀 美 國Agilent公司。
細胞按前述分組處理后,移除內培養基(用于后續LDH酶活性測定)并加入100 μL的MTT試劑(終質量濃度:0.5 mg/mL)繼續培養24 h。培養結束后棄上清液,每孔加入DMSO (100 μL)避光振蕩30 min,測定OD490 nm后按公式:細胞生存率(%)=OD樣品組/OD正常組×100來計算細胞生存率。LDH脫氫酶水平采用比色試劑盒按照說明書操作要求進行測定。
1.2 方法
1.2.1 D NA提取
血清、肌肉、植物樣品采用CTAB法[10-11]:取1 g樣品粉末到50 mL離心管中,加入5 mL CTAB提取緩沖液和20 μL蛋白酶K,渦旋混勻65 ℃孵育過夜,將樣品管12 000×g離心10 min。吸取1 mL上清液到新的2 mL離心管中,加入700 μL三氯甲烷振蕩混勻,14 500×g離心10 min,吸取600 μL上清到新的2 mL離心管中,加入1 200 μL CTAB沉淀緩沖液,混勻室溫孵育60 min,14 500×g離心10 min棄去水相,加入350 μL 1.2 mol/L NaCl溶液溶解沉淀,加入350 μL三氯甲烷振蕩混勻,14 500×g離心10 min,吸取200 μL上清液到新的1.5 mL離心管中,加入160 μL 異丙醇混勻后室溫孵育20 min,14 500×g離心10 min,棄去水相,加入500 μL 70%乙醇混合沖洗沉淀,14 500×g離心10 min,棄去水相室溫晾干,加入100 μL 0.1×TE緩沖液65 ℃、10 min溶解DNA。
阿膠樣品采用試劑盒法,起始樣品量200 mg,DNA溶于100 μL無菌雙蒸水。
1.2.2 常規PCR
PCR反應體系:DNA模板5 μL;10×PCR反應緩沖液2.5 μL;dNTPs 2.0 μL;上下游引物(10 pmol/L)各0.5 μL;Taq酶1 U,用無菌水補至總體積為25 μL。
PCR擴增程序:94 ℃預變性5 min;94 ℃變性30s,60 ℃退火30s,72 ℃延伸1 min,35個循環;72 ℃延伸5 min。
1.2.3 毛細管芯片電泳
電泳操作按照DNA 1000 LabChip 試劑盒所提供的說明進行。凝膠-染料混合物的準備:將試劑盒中DNA Dye Concentrate及DNA Gel Matrix試劑室溫放置30 min,渦旋振蕩DNA Dye Concentrate試劑,取25 μL DNA Dye Concentrate至DNA Gel Matrix試劑中,混勻充分后,用離心過濾器過濾(1 500×g、10 min)。將凝膠-染料混合物注入分離芯片中,將5 μL Marker加入各個樣品孔中。取上述PCR產物各1 μL分別加入12個樣品孔中,將1 μL Ladder加入指定的Ladder孔中,最后將芯片渦旋混勻后放入毛細管芯片電泳儀中進行自動檢測分析。
1.2.4 實時熒光PCR[6,12-13]
25 μL PCR體系:12.5 μL Master Mix、6.0 μL ddH2O、0.5 μL 10 μmol/L引物、0.5 μL 10 μmol/L探針、5 μL模板,引物探針序列見表1。
PCR程序:50 ℃去除RNA 2 min,95 ℃預變性10 min,95 ℃變性15 s,60 ℃退火1 min,50個循環。

表1 檢測用引物和探針Table 1 Specific primers and probes of real-time PCR amplification
2 結果與分析
對馬和驢線粒體基因組進行序列比對后挑選的靶序列(NC_001788.1、KC203030.1),為tRNA-thr和D-loop區,見圖1。馬和驢的探針長度為28 個堿基,其中8 個為差異堿基。正向引物23 個堿基,其中在5’端有1 個差異堿基,反向引物22 個堿基,靠近3’端有3 個差異堿基。
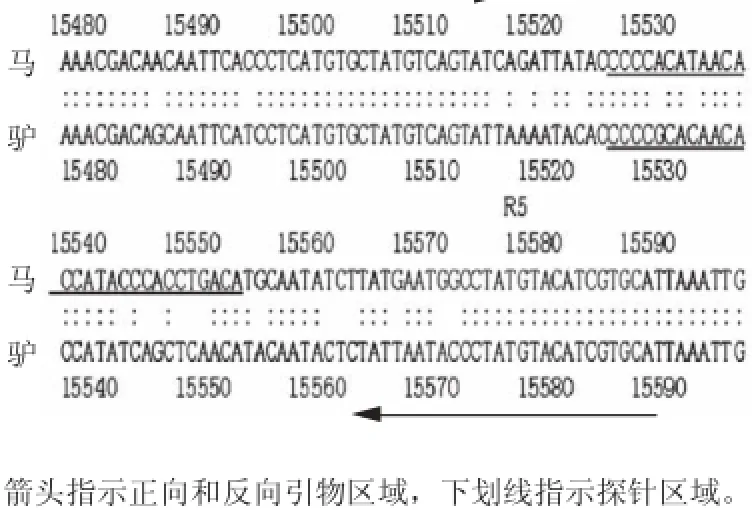
圖1 馬和驢線粒體靶序列比對結果Fig.1 Sequence alignment of mitochondrial target genes for horse and donkey
采用常規PCR法對馬和驢等11種動物基因組的擴增結果見圖2。兩對引物對的PCR產物長度108 bp,與電泳結果一致。馬特異性引物僅對馬DNA有擴增,驢特異性引物僅對驢DNA有擴增,說明兩對引物特異性良好。
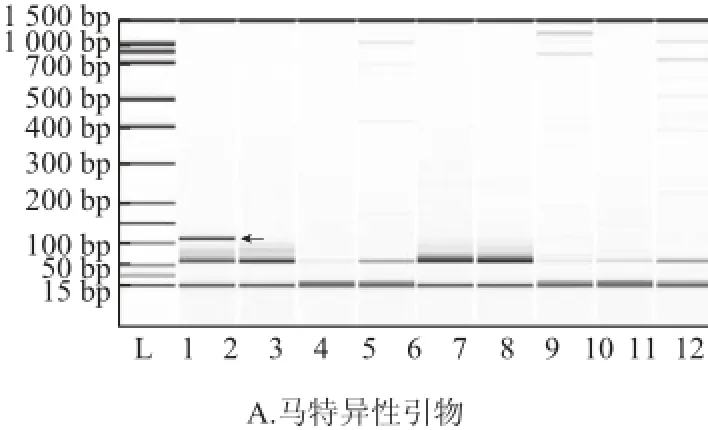
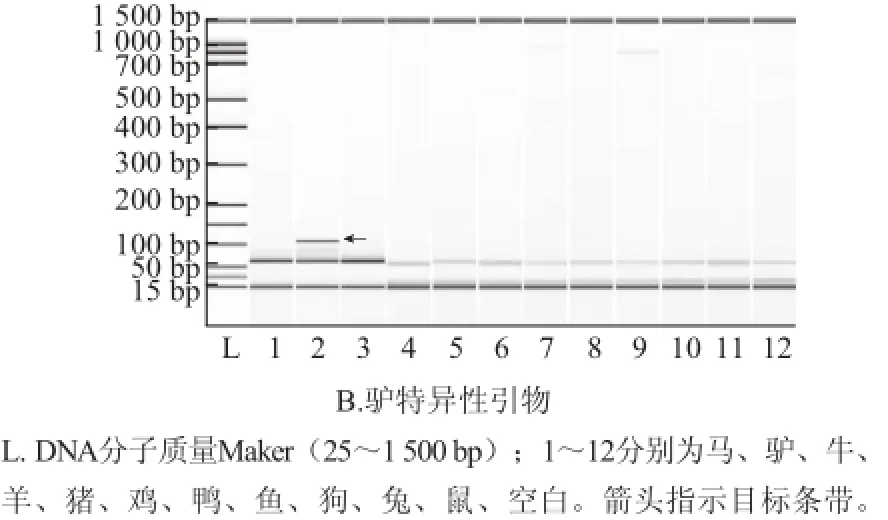
圖2 馬(A)和驢(B)特異性引物常規PCR產物毛細管芯片電泳結果Fig.2 Microchip capillary electrophoresis by using horse and donkey specific primers for routine PCR amplification
增加探針后馬和驢特異性體系的擴增結果見圖3。實驗對象包括馬和驢等16 種動物以及5 種植物。其中馬特異性體系僅對馬DNA樣本有擴增,驢特異性體系僅對驢DAN樣本有擴增,擴增曲線呈典型S型,所有樣本3 次平行實驗重復良好。說明設計的馬和驢特異性實時熒光PCR體系特異性良好。
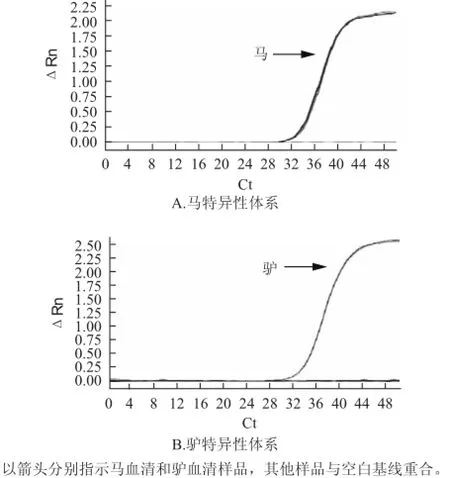
圖3 馬和驢實時熒光PCR特異性結果Fig.3 Specificity for horse and donkey ingredients by real-time PCR
將馬和驢DNA質量濃度分別調整至0.1 ng/?L后,按比例混合,使馬和驢的體積百分比分別為100%、90%、50%、10%、1%、0.1%。混合DNA的實時熒光PCR結果見圖4,馬特異性體系的相對靈敏度達到0.1%,即500 pg模板DNA中檢測到0.5 pg馬DNA。驢特異性體系的相對靈敏度達到1%,即500 pg模板DNA中檢測到5 pg驢DNA。
為了了解不同DNA提取方法對阿膠的適用性,分別采用DNeasy Mericon Food Kit(50)試劑盒、Wizard Magnetic DNA Purification System for Food試劑盒、Nucleospin Food試劑盒,以及CTAB法對阿膠進行DNA提取,每份DNA重復擴增8 次,上述方法的擴增率分別為4/8、2/8、8/8和1/8(結果未示),Nucleospin Food的擴增率明顯高于其他方法,適合阿膠樣品的檢測。
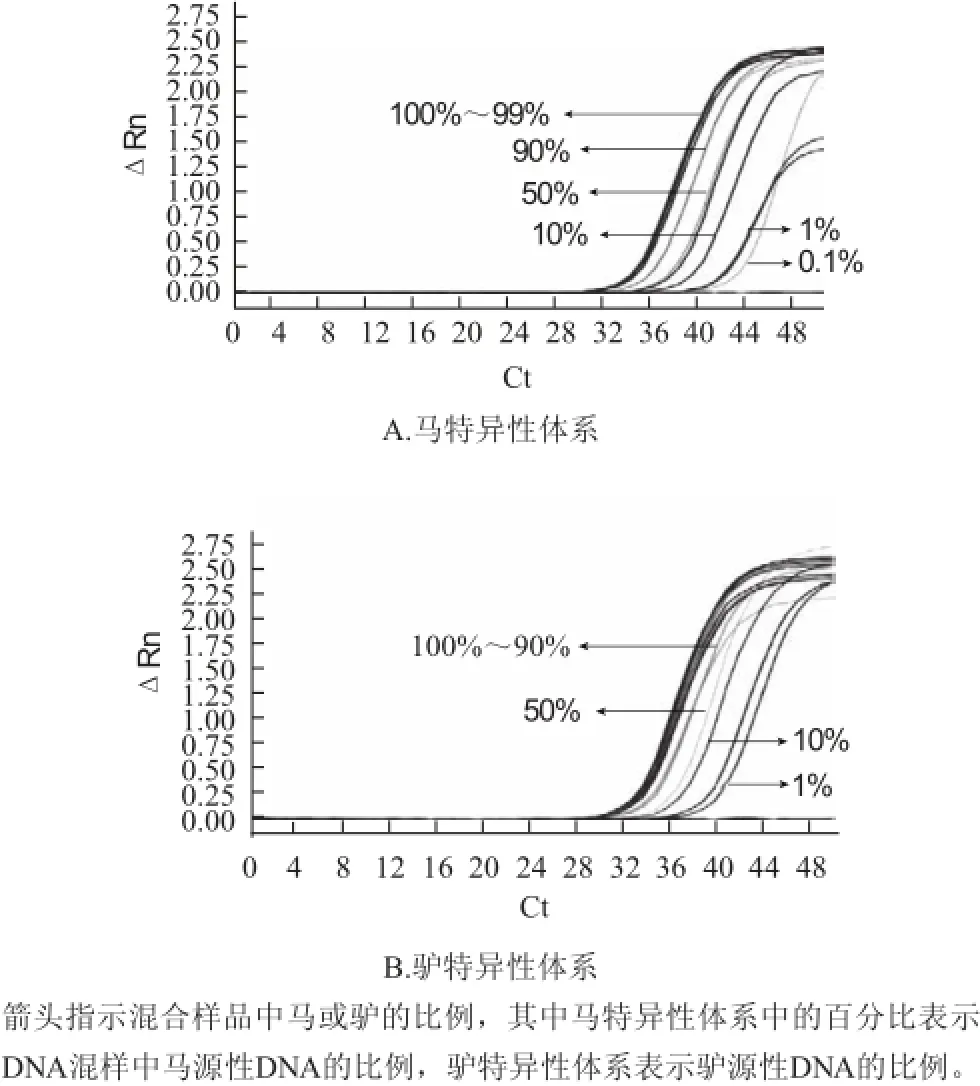
圖4 馬和驢特異性體系相對靈敏度Fig.4 Relative response of horse and donkey specific systems
采用建立的實時熒光PCR體系對正品阿膠及某公司送檢的6 批阿膠樣品的檢測,結果見表2。正品阿膠樣品只檢出驢成分,未知來源的6 個阿膠樣品存在不同程度的摻雜情況,其中4 個樣品未檢出驢成分。
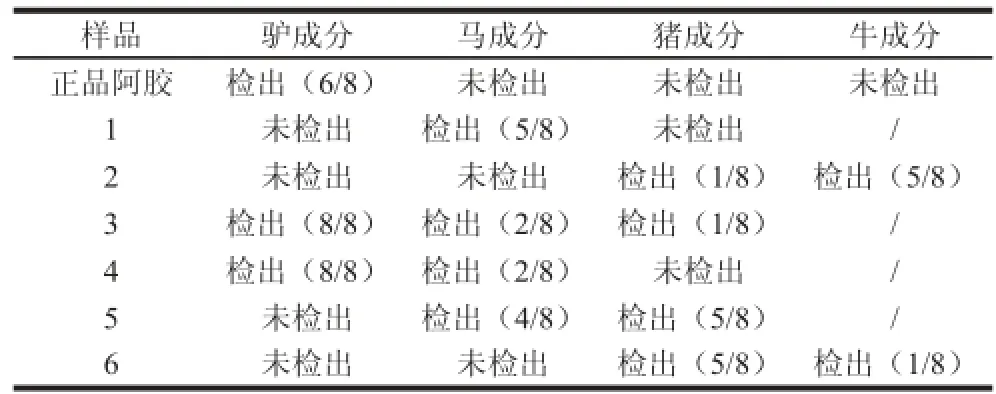
表2 未知來源阿膠樣品檢測結果Table 2 Results obtained by real-time PCR for the detection of unknown donkey glue samples
3 討論與結論
阿膠的傳統加工工藝很復雜,包括晾皮、刮皮、泡皮、鍘皮、化皮、打沫、濃縮、凝膠、切膠、晾膠、擦膠[1-15]。對阿膠進一步加工成口服液和顆粒沖劑的過程中需要進一步酶解、純化、干燥等,因此從新鮮的動物皮張到最終的產品需要經過高強度的加工,對DNA的破壞尤為嚴重。硅膠膜類試劑盒經過許多研究者的驗證[16-17],在深加工食品核酸的提取方面性能很好。其核心是硅樹脂,通常為親水、多孔的硅膠珠,硅膠珠表面包被堿性基團,在酸性條件下可以產生高密度的正電荷,使DNA骨架上帶負電荷的磷酸基團高特異性地結合在硅膠珠上,獲得的核酸純度很高,對碎片核酸的富集也很有效,這對于成分復雜的加工食品樣品尤為有利。本實驗對不同來源阿膠塊樣品的成功檢測說明該類試劑盒的適用性。
此外,由于食品加工過程中高溫高壓對DNA造成很大破壞,因此檢測體系通常選擇高拷貝的短序列作為目標物。動物成分檢測中線粒體是優先選擇的對象,因為拷貝數多(1 000~2 000 個/細胞,每個線粒體基因組數百個拷貝),進化適中(能很好地反映物種特征)[18]。由于馬和驢物種非常相近,對其線粒體序列的比對結果顯示兩者相似度92.4%,因此采用了線粒體全序列比對,尋找適合引物探針設計的差異集中區域的方式,找到了覆蓋tRNA-Thr和D-loop區的一段序列,成功設計了滿足要求的馬特異性引物探針體系和驢特異性引物探針體系。
近年在食品真偽和質量評價領域有許多新型的技術得到應用。瞿海斌等[3]采用近紅外光譜技術對阿膠真品和偽品進行快速區分。近紅外等快速無損技術最大的優點是快速和無損,但是由于真品和偽品之間往往缺乏特征性指標,容易對未知樣品造成誤判,而且加工工藝、原料來源、樣品顆粒均一性等也可能影響樣品數據,造成聚類的偏差。而且很多偽品在熬制過程中會加入少量阿膠,將對光譜數據造成干擾。DNA檢測技術對食品原料物種來源的判別具有唯一性、不受加工和混雜影響等特點,能夠準確判定食品真偽。
阿膠作為我國“中藥三寶”之一,在我國保健食品市場占據重要地位[19]。近年來阿膠也開始進入國外市場[20],例如2006年9月26日首次獲準加拿大衛生部的中藥產品藥品生產質量管理規范證書注冊,進入了加拿大的藥品市場。在阿膠的質量監管中,對原料的控制尤為重要,雖然目前對阿膠的藥理仍在研究中,但上千年的實踐已證實驢皮作為阿膠原料所具有的獨特效果,同時出于消費者知情權和利益的保護,也應當保證阿膠原料的真實性。對送檢樣品的檢測發現普遍存在的摻雜甚至假冒現象,說明對阿膠原料監管十分必要和緊迫。
本實驗針對線粒體tRNA-Thr和D-loop區序列,建立了阿膠中馬和驢成分的實時熒光PCR檢測方法,此法特異性高、靈敏度高,能準確檢測阿膠中的馬和驢成分,為市售商品的監管及食品化妝品藥品生產企業的原料質控提供快速準確的技術手段。
[1] 朱建梅. 淺談阿膠的現代應用[J]. 內蒙古中醫藥, 2013, 32(5): 50-51. [2] 郭健, 孫佳明, 張志頡, 等. 阿膠化學成分及藥理作用研究進展[J].吉林中醫藥, 2013, 33(4): 17-73.
[3] 瞿海斌, 楊海雷, 程翼宇. 近紅外漫反射光譜法快速無損鑒別阿膠真偽[J]. 光譜學與光譜分析, 2006, 26(1): 60-62.
[4] 陳穎, 吳亞君. 基因檢測技術在食品物種鑒定中的應用[J]. 色譜, 2011, 29(7): 594-600.
[5] HIRD H, LLOYD J, GOODIER R, et al. Detection of peanut using real-time polymerase chain reaction[J]. European Food Research and Technology, 2003, 217(3): 265-268.
[6] SN/T 2557—2011 畜肉食品中牛成分含量檢測方法: 熒光定量PCR方法[S]. 北京: 中國標準出版社, 2011.
[7] LI Hongwei, XU Haiyue, ZHAO Chunjiang, et al. A PCR amplification method without DNA extraction[J]. Electrophoresis, 2011, 32(3/4): 394-397.
[8] DEMMEL A, HUPFER C, ILG HAMPE E, et al. Development of a real-time PCR for the detection of lupine DNA (Lupinus species) in foods[J]. Journal of Agricultural and Food Chemistry, 2008, 56(12): 4328-4332.
[9] GB/T 25165—2010 明膠中牛羊豬源性成分檢測方法: 實時熒光PCR法[S]. 北京: 中國標準出版社, 2010.
[10] 劉欣, 祝長青, 王毅謙, 等. 大豆轉基因檢測中DNA提取方法的比較研究[J]. 食品科學, 2013, 34(4): 199-203.
[11] 馬曉婷, 劉芳, 陳亞麗, 等. 從不同材料中提取馬DNA方法的比較研究[J]. 安徽農業科學, 2012, 40(26): 12787-12788.
[12] 敖金霞, 高學軍, 仇有文, 等. 實時熒光定量PCR技術在轉基因檢測中的應用[J]. 東北農業大學學報, 2009, 40(6): 141-144.
[13] 陳旭, 齊鳳坤, 康立功, 等. 實時熒光定量PCR技術研究進展及其應用[J]. 東北農業大學學報, 2010(8): 148-155.
[14] 趙興波, 李寧, 吳常信. 動物線粒體核質基因互作的研究進展[J]. 遺傳, 2001, 23(1): 81-85.
[15] 崔金玉. 阿膠炮制工藝及質量控制研究[D]. 沈陽: 遼寧中醫藥大學, 2008.
[16] 李克新. 傳統“阿膠”走向世界[J]. 企業文化, 2007(6): 77-78.
[17] MAFRA I, SILVA S A, MOREIRA E J M O, et al. Comparative study of DNA extraction methods for soybean derived food products[J]. Food Control, 2008, 19(12): 1183-1190.
[18] WU Yajun, CHEN Ying, WANG Bin, et al. Application of SYBRgreen PCR and 2DGE methods to authenticate edible bird’s ne st food[J]. Food Research International, 2010, 43(8): 2020-2026.
[19] 佟艷霞. 淺議中藥阿膠的臨床應用及藥理作用[J]. 中國衛生產業, 2013, 10(3): 178-178.
[20] 吳長虹, 王若光. 阿膠的歷史沿革, 研究現狀及相關思考[J]. 湖南中醫藥大學學報, 2009, 28(6): 77-79.
A Real-Time PCR to Detect Horse and Donkey Ingredients in Donkey Hide Glue
WU Ya-jun, WANG Bin, LIU Ming-chang, HAN Jian-xun, LI Xin-shi, CHEN Ying*
(Agro-product Research Center, Chinese Academy of Inspection and Quarantine, Beijing 100123, China)
In this study, we established a highly specific and sensitive real-time polymerase chain reaction (PCR) method to detect horse and donkey components in donkey hide glue. The mitochondrial tRNA-Thr gene of horse and the mitochondrial D-loop region of donkey were selected as target sequences for the designing of specific primers. In conventional and realtime PCR assays, horse and donkey ingredients could be specifically detected using both primer pairs.
donkey hide glue; horse; donkey; real-time polymerase chain reaction (PCR)
R282.5
A
1002-6630(2014)08-0085-04
10.7506/spkx1002-6630-201408016
2013-07-23
國家高技術研究發展計劃(863計劃)項目(2011AA100807)
吳亞君(1975—),女,副研究員,博士,研究方向為食品物種鑒定技術。E-mail:wuyajuncaiq@163.com*
陳穎(1972—),女,研究員,博士,研究方向為食品物種鑒定技術。E-mail:chenyingcaiq@163.com

