腺病毒介導(dǎo)血管內(nèi)皮生長因子轉(zhuǎn)染臍帶間充質(zhì)干細(xì)胞的實驗研究
李曉玲,朱旅云,宋光耀,邢邯英,劉素蕊,王 超
腺病毒介導(dǎo)血管內(nèi)皮生長因子轉(zhuǎn)染臍帶間充質(zhì)干細(xì)胞的實驗研究
李曉玲,朱旅云,宋光耀,邢邯英,劉素蕊,王 超
目的探討腺病毒載體介導(dǎo)血管內(nèi)皮生長因子(VEGF)轉(zhuǎn)染臍帶間充質(zhì)干細(xì)胞(UCMSCs)的可行性,以及VEGF轉(zhuǎn)染對UCMSCs功能的影響。方法 構(gòu)建VEGF165-EGFP基因重組腺病毒載體,分離和培養(yǎng)UCMSCs,攜增強型綠色熒光蛋白(EGFP)的腺病毒載體轉(zhuǎn)染UCMSCs,倒置熒光顯微鏡下觀察細(xì)胞轉(zhuǎn)染效果,流式細(xì)胞儀檢測細(xì)胞轉(zhuǎn)染率,確定最佳病毒感染復(fù)數(shù)(MOI)。將細(xì)胞分為VEGF-EGFP轉(zhuǎn)染組、EGFP空載組及對照組3組,依據(jù)最佳MOI值轉(zhuǎn)染并收集細(xì)胞,采用蛋白印跡法(Western blotting)檢測VEGF及Akt表達(dá)變化;酶聯(lián)免疫吸附試驗(ELISA)檢測VEGF蛋白表達(dá)情況。采用CCK-8法評價轉(zhuǎn)染對UCMSCs增殖的影響。結(jié)果 腺病毒介導(dǎo)的VEGF165-EGFP基因能夠成功轉(zhuǎn)染UCMSCs,且VEGF基因在細(xì)胞內(nèi)能夠轉(zhuǎn)錄和表達(dá),并能分泌到細(xì)胞外。轉(zhuǎn)染后48 h VEGF-EGFP轉(zhuǎn)染組VEGF、Akt水平顯著高于EGFP空載組和對照組(P<0.05);轉(zhuǎn)染后48 h采用ELISA法在VEGF-EGFP轉(zhuǎn)染組細(xì)胞培養(yǎng)上清中即檢測到VEGF的表達(dá)和分泌,在轉(zhuǎn)染后第4天達(dá)到高峰,且VEGF表達(dá)顯著高于EGFP空載組及對照組(P<0.01),以后逐漸下降,并穩(wěn)定表達(dá)一定時間。CCK-8法檢測結(jié)果顯示,介導(dǎo)VEGF基因轉(zhuǎn)染的腺病毒對UCMSCs增殖無明顯影響。結(jié)論 腺病毒介導(dǎo)VEGF基因能夠成功轉(zhuǎn)染UCMSCs,保持其原有生物學(xué)特性,并能持續(xù)高效表達(dá)VEGF,為通過VEGF基因聯(lián)合UCMSCs治療獲得糖尿病下肢血液循環(huán)重建的可行性提供理論依據(jù)。
血管內(nèi)皮生長因子類;臍帶間質(zhì)干細(xì)胞;腺病毒載體;轉(zhuǎn)染
研究發(fā)現(xiàn)血管內(nèi)皮細(xì)胞生長因子(vascular endothelial growth factor,VEGF)能加速側(cè)支循環(huán)的建立,在血管新生中起關(guān)鍵作用,但由于VEGF屬多肽類生長因子,在體內(nèi)半衰期短,提純較為困難,不適合作為藥物直接用于臨床。高增殖潛能和定向歸巢特性使臍帶間充質(zhì)干細(xì)胞(umbilical cord mesenchymal stem cell,UCMSCs)成為促進血管新生和基因治療缺血性疾病的理想靶細(xì)胞和種子細(xì)胞,在體細(xì)胞轉(zhuǎn)染目的基因治療中的作用越來越受到關(guān)注。本研究利用基因工程擬選擇分泌型hVEGF-165作為轉(zhuǎn)入基因,攜增強型綠色熒光蛋白(enhanced green fluores centprotein,EGFP)構(gòu)建質(zhì)粒,通過腺病毒轉(zhuǎn)染到UCMSCs細(xì)胞中,觀察轉(zhuǎn)染后UCMSCs理化特性、VEGF基因表達(dá)及對生長增殖的影響,為下一步研究UCMSCs聯(lián)合VEGF基因治療下肢缺血性病變的可行性及作用機制提供理論依據(jù)。
1 材料與方法
1.1 材料 EGFP及VEGF165基因重組腺病毒(病毒滴度1.57×1010pfu/ml)由廣州賽生生物公司提供;DMEM/F12培養(yǎng)基購自美國HYClone公司;胎牛血清購自美國Gibco公司;胰蛋白酶/EDTA消化液購自美國HYClone公司;CCK-8試劑盒購自日本同仁公司,DMSO購自德國WAK-CHEMIE公司;ELISA VEGF試劑盒(上海依科賽生物制品有限公司,批號:ZDZIBZAB01),蛋白激酶B(Akt)多克隆抗體購自Abcam公司。酶標(biāo)儀(Rayto RT-6100);Epics XL流式細(xì)胞儀購自美國BECKMAN公司。
1.2 實驗方法
1.2.1 分離和培養(yǎng)UCMSCs:無菌條件下取足月妊娠分娩胎兒的臍帶(家屬簽署知情同意書),用生理鹽水洗滌去除血液。將臍帶剪切成1~2 cm大小的片段,剔除血管(1條臍靜脈、2條臍動脈)避免內(nèi)皮細(xì)胞污染。取出其中的華通膠剪碎,大小約1 mm3,將組織塊置于培養(yǎng)瓶中,加入含有10%胎牛血清、100 U/m l青霉素、100 U/L鏈霉素的DMEM/F12培養(yǎng)基,放置在37℃、5%CO2培養(yǎng)箱中培養(yǎng)。1周后首次換液,此后3~4 d換液1次。待細(xì)胞長至80%~90%融合時用胰蛋白酶/EDTA消化液消化傳代,顯微鏡下控制消化時間。
1.2.2 EGFP轉(zhuǎn)染UCMSCs轉(zhuǎn)染率測定:選取第3代UCMSCs接種于6孔培養(yǎng)板,單層培養(yǎng)達(dá)80%融合時,將培養(yǎng)液更換為α-MEM無血清培養(yǎng)基,按病毒感染復(fù)數(shù)(multiplicities of infection,MOI)分別為0、100、200、300、400、500,每個MOI值條件設(shè)3 個復(fù)孔,轉(zhuǎn)染6 h后,將培養(yǎng)液更換為DMEM培養(yǎng)基(含10%FBS),置入5%CO2培養(yǎng)箱37℃條件下培養(yǎng)。轉(zhuǎn)染后24、48 h在熒光倒置顯微鏡下觀察細(xì)胞EGFP的表達(dá)情況。以0.25%胰蛋白酶-乙二胺四乙酸(EDTA)消化收集細(xì)胞,用DMEM培養(yǎng)基洗滌細(xì)胞1次(PBS離心洗滌3次),重懸于20 g/L多聚甲醛中,流式細(xì)胞儀檢測轉(zhuǎn)染細(xì)胞比例,確定最佳MOI值。
1.2.3 UCMSCs轉(zhuǎn)染后VEGF基因及其下游基因表達(dá)情況的檢測:將細(xì)胞分為VEGF-EGFP轉(zhuǎn)染組、EGFP空載組和對照組3組。單層培養(yǎng)達(dá)80%融合時,依次加入純化的VEGF-EGFP和EGFP基因重組腺病毒液,對照組以不含血清的DMEM培養(yǎng)基代替腺病毒液。①蛋白印跡法(Western blotting)鑒定VEGF、Akt的表達(dá):最佳MOI值及過表達(dá)效果最好的時間點確定后,按條件轉(zhuǎn)染并收集細(xì)胞。分別提取細(xì)胞的RNA和總蛋白,用實時聚合酶鏈反應(yīng)(PCR)和Western blotting檢測VEGF的表達(dá)量及下游靶基因AktmRNA水平變化。②ELISA法測定培養(yǎng)上清中VEGF的含量:分別在VEGF-EGFP基因轉(zhuǎn)染 UCMSCs后第2、4、7、10、13 天提取細(xì)胞培養(yǎng)上清液進行VEGF的ELISA檢測(按照試劑盒說明書操作),在檢測波長為450 nm、校正波長570 nm酶聯(lián)儀上讀取吸光度值,根據(jù)標(biāo)準(zhǔn)品測定結(jié)果,計算被檢測細(xì)胞培養(yǎng)上清液內(nèi)VEGF含量。
1.3 采用CCK-8法檢測VEGF轉(zhuǎn)染后對UCMSCs細(xì)胞增殖的影響 按上述最佳MOI轉(zhuǎn)染細(xì)胞后24、48、96 h消化并收集細(xì)胞。接種于96孔板中,每組均設(shè)6個復(fù)孔。孵育過夜,按照CCK-8試劑盒流程處理細(xì)胞。選擇570 nm波長,在酶聯(lián)免疫檢測儀上讀取吸光度值。
1.4 統(tǒng)計學(xué)處理 應(yīng)用SPSS 18.0軟件進行統(tǒng)計學(xué)分析,所有數(shù)據(jù)采用均數(shù)±標(biāo)準(zhǔn)差(±s)表示,采用方差分析,α=0.05為檢驗水準(zhǔn)。
2 結(jié)果
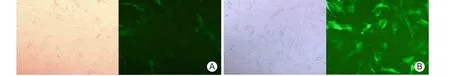
圖1 腺病毒介導(dǎo)增強型綠色熒光蛋白基因轉(zhuǎn)染臍帶間充質(zhì)干細(xì)胞后24、48 h倒置熒光顯微鏡下細(xì)胞形態(tài)(×100)
2.1 EGFP轉(zhuǎn)染UCMSCs轉(zhuǎn)染率測定 細(xì)胞在轉(zhuǎn)染后24 h,熒光顯微鏡下不能很明顯地看到綠色熒光,轉(zhuǎn)染48 h后則可在熒光顯微鏡下觀察到強烈的綠色熒光,見圖1。
流式細(xì)胞儀檢測結(jié)果:在MOI為100、200、400、500 條件下,轉(zhuǎn)染率分別為 48.2%、69.0%、76.1%、91.7%、94.0%,在 MOI為 400時,轉(zhuǎn)染率趨于穩(wěn)定,并保持在90%以上,當(dāng)MOI>400時,轉(zhuǎn)染率不再增加,細(xì)胞出現(xiàn)變圓、脫落,熒光碎片數(shù)量增多。故確定最佳MOI值為400。見圖2。
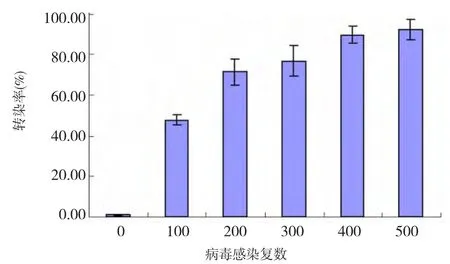
圖2 不同病毒感染復(fù)數(shù)條件下腺病毒介導(dǎo)增強型綠色熒光蛋白基因轉(zhuǎn)染臍帶間充質(zhì)干細(xì)胞后轉(zhuǎn)染率
2.2 轉(zhuǎn)染UCMSCs后VEGF基因及其下游基因表達(dá)情況
2.2.1 Western blotting檢測 VEGF、Akt的表達(dá):腺病毒介導(dǎo)VEGF轉(zhuǎn)染UCMSCs 48 h,VEGF、Akt在各組中均有表達(dá),但表達(dá)量不同。VEGF-EGFP轉(zhuǎn)染組VEGF表達(dá)(1.71±0.13)顯著高于 EGFP 空載組(1.02 ±0.11)及對照組(0.96 ±0.08),差異有統(tǒng)計學(xué)意義(P<0.05);VEGF-EGFP轉(zhuǎn)染組Akt表達(dá)(1.64 ±0.12)顯著高于 EGFP 空載組(1.07 ±0.09)及對照組(0.89±0.07),差異有統(tǒng)計學(xué)意義(P<0.05);而EGFP空載組與對照組VEGF、Akt表達(dá)差異無統(tǒng)計學(xué)意義(P>0.05)。見圖3。
2.2.2 ELISA法檢測VEGF的表達(dá):在轉(zhuǎn)染后第2、4、7、10、13天采用ELISA法檢測培養(yǎng)上清中VEGF含量,隨著時間延長VEGF-EGFP轉(zhuǎn)染組的含量均顯著高于對照組和 EGFP空載組(P<0.01)。VEGF轉(zhuǎn)染2 d后UCMSCs培養(yǎng)上清液中VEGF水平顯著增加,并在轉(zhuǎn)染后第4天達(dá)到頂峰,持續(xù)到第13天仍有較高水平表達(dá)。見表1。

圖3 蛋白印跡法檢測轉(zhuǎn)染臍帶間充質(zhì)干細(xì)胞后3組VEGF、Akt表達(dá)
表1 ELISA檢測3組轉(zhuǎn)染UCMSCs后VEGF表達(dá)(±s)
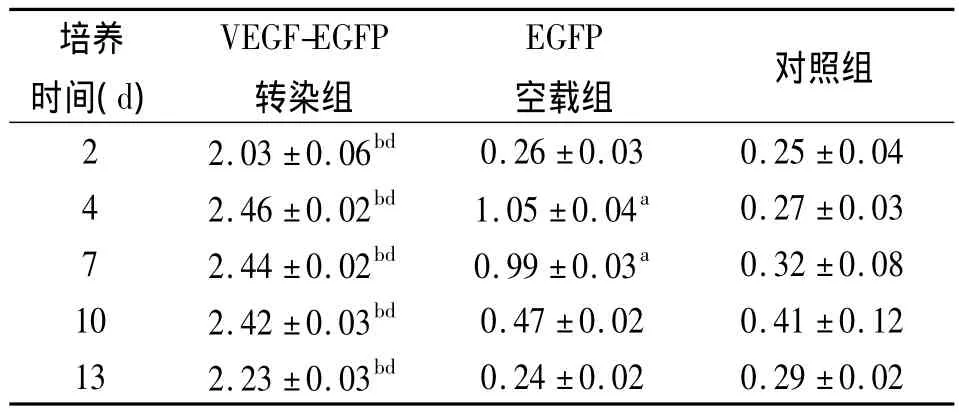
表1 ELISA檢測3組轉(zhuǎn)染UCMSCs后VEGF表達(dá)(±s)
注:ELISA:酶聯(lián)免疫吸附試驗,VEGF:血管內(nèi)皮生長因子,EGFP:增強型綠色熒光蛋白;VEGF-EGFP轉(zhuǎn)染組、EGFP空載組加入VEGFEGFP和EGFP基因重組腺病毒液,對照組加入不含血清的DMEM培養(yǎng)基;與 EGFP空載組比較,b P<0.01;與對照組比較,a P<0.05,d P <0.01
培養(yǎng)時間(d)VEGF-EGFP轉(zhuǎn)染組EGFP空載組 對照組2 2.03 ±0.06bd 0.24 ±0.02 0.29 ±0.02 0.26 ±0.03 0.25 ±0.04 4 2.46 ±0.02bd 1.05 ±0.04a 0.27 ±0.03 7 2.44 ±0.02bd 0.99 ±0.03a 0.32 ±0.08 10 2.42 ±0.03bd 0.47 ±0.02 0.41 ±0.12 13 2.23 ±0.03bd
2.3 CCK-8比色法檢測轉(zhuǎn)染對UCMSCs增殖的影響 在轉(zhuǎn)染VEGF 24、48、96 h后CCK-8法檢測結(jié)果顯示,3組 UCMSCs比較差異均無統(tǒng)計學(xué)意義(P >0.05),見表2。
3 討論
對血液循環(huán)的重建而言,目前已知多種生長因子和細(xì)胞因子具有促進血管生成即血管化作用,其中VEGF被認(rèn)為是機體內(nèi)最強的促血管生長因子,研究證實VEGF可特異性地作用于血管內(nèi)皮細(xì)胞,顯著促進新生血管的形成,在動物實驗及臨床應(yīng)用中顯示了良好的效果[1]。但單純VEGF作用下形成的血管僅由血管內(nèi)皮細(xì)胞組成,其結(jié)構(gòu)不夠完整,通透性高,在局部形成不同程度的水腫,而新生血管的不穩(wěn)定性也可能影響到該方法的遠(yuǎn)期療效,因此,有必要對VEGF治療血管生成進行更深入的研究。骨髓干細(xì)胞(bone marrow mesenchymal stem cell,BMSCs)具有多向分化潛能、容易在體外擴增和可自體移植的特性,移植BMSCs重建肢體血管的可行性和有效性近年來已得到大量實驗及臨床證實[2-5],但采集BMSCs風(fēng)險較大,對患者年齡、身體條件、心理接受程度要求較高。糖尿病患者干細(xì)胞移植后向血管內(nèi)皮祖細(xì)胞分化能力下降,其增殖、黏附和參與血管形成能力都降低,機體不能為移植的細(xì)胞提供滿意的增殖分化環(huán)境等問題,導(dǎo)致臨床療效降低,UCMSCs與BMSCs在生物學(xué)特性方面極為相似,而且來源更廣泛,采集方便,擴增能力更強,免疫原性弱,具有更加有效的干細(xì)胞潛能,是治療缺血性疾病更為良好的種子細(xì)胞和轉(zhuǎn)基因載體細(xì)胞[6-8]。UCMSCs具有多向分化潛能,需要在適宜誘導(dǎo)因子作用下才能向血管內(nèi)皮細(xì)胞分化,可作為基因治療的受體細(xì)胞。為使誘導(dǎo)因子能持續(xù)高效發(fā)揮作用,利用分子組織工程學(xué)技術(shù),將具有多重生物學(xué)效應(yīng)及促血管新生最強因子VEGF基因轉(zhuǎn)入UCMSCs,通過轉(zhuǎn)基因干細(xì)胞在缺血局部持續(xù)表達(dá)高生物學(xué)活性的內(nèi)源性VEGF以促進其向血管內(nèi)皮分化,從而減少外源性誘導(dǎo)因子大劑量使用導(dǎo)致的不良反應(yīng),提高促血管新生及修復(fù)效果。
表2 CCK-8比色法檢測轉(zhuǎn)染對UCMSCs增殖的影響(±s)
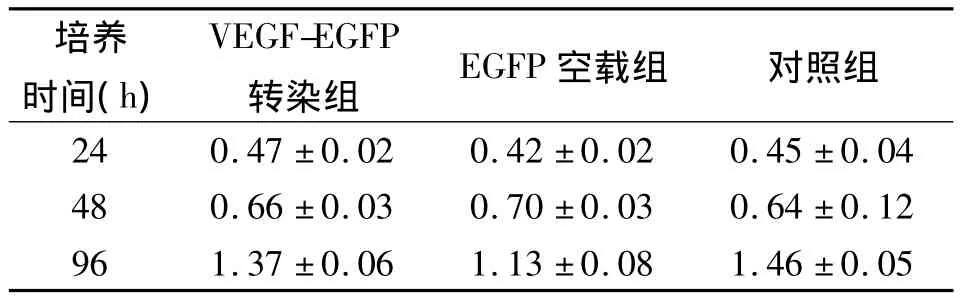
表2 CCK-8比色法檢測轉(zhuǎn)染對UCMSCs增殖的影響(±s)
注:UCMSCs:臍帶間充質(zhì)干細(xì)胞,VEGF:血管內(nèi)皮生長因子,EGFP:增強型綠色熒光蛋白;VEGF-EGFP轉(zhuǎn)染組、EGFP空載組分別加入VEGF-EGFP和EGFP基因重組腺病毒液,對照組加入不含血清的DMEM培養(yǎng)基
培養(yǎng)時間(h)VEGF-EGFP轉(zhuǎn)染組 EGFP 空載組 對照組24 0.47 ±0.02 0.42 ±0.02 0.45 ±0.04 48 0.66 ±0.03 0.70 ±0.03 0.64 ±0.12 96 1.37 ±0.06 1.13 ±0.08 1.46 ±0.05
基因治療需要合適的載體,目前被研究應(yīng)用最多的是腺病毒載體,有實驗證實重組腺病毒Ad-VEGF165滴度高、毒性低、轉(zhuǎn)染效率高、體外轉(zhuǎn)染安全[9-10]。
本實驗選擇分泌型VEGF作為轉(zhuǎn)入基因,攜EGFP構(gòu)建質(zhì)粒,通過腺病毒感染UCMSCs后能夠同時穩(wěn)定表達(dá)EGFP和VEGF兩種外源性基因,仍保持其原有分化特征,同時利用EGFP基因示蹤可以充分了解融合基因的特征、理化特性及移植細(xì)胞在體內(nèi)的功能和分泌,方便目的基因的表達(dá)鑒定及定位追蹤[11]。本研究觀察到用EGFP轉(zhuǎn)染UCMSCs后在熒光顯微鏡下觀察細(xì)胞在轉(zhuǎn)染后的24 h即有EGFP的表達(dá),48 h達(dá)到高峰,以后逐漸減弱,細(xì)胞形態(tài)結(jié)構(gòu)無明顯變化。流式細(xì)胞學(xué)檢測發(fā)現(xiàn)MOI為400是較為合適的轉(zhuǎn)染倍數(shù),可以獲得比較穩(wěn)定的轉(zhuǎn)染率,對細(xì)胞的形態(tài)和增殖沒有影響,而且也不影響UCMSCs的血管分化能力[12]。CCK-8比色法檢測VEGF-EGFP轉(zhuǎn)染對UCMSCs增殖無影響。研究結(jié)果表明UCMSCs對于腺病毒是易感細(xì)胞[13],VEGF165基因表達(dá)載體可有效轉(zhuǎn)染UCMSCs,并在體外高效表達(dá)而不影響細(xì)胞生長,通過 Western blotting和ELISA檢測顯示,轉(zhuǎn)染了VEGF基因的UCMSCs可以穩(wěn)定表達(dá)外源性VEGF,轉(zhuǎn)染2 d后培養(yǎng)上清液中已經(jīng)開始有VEGF的產(chǎn)生,且顯著高于對照組,到第4天時達(dá)到高峰,且能維持在一定水平的VEGF表達(dá),至轉(zhuǎn)染后第13天分泌的VEGF能夠促進UCMSCs的增殖[14]。Akt在調(diào)節(jié)細(xì)胞存活和凋亡過程中起重要作用,激活A(yù)kt可以上調(diào)Bcl2和VEGF表達(dá)及促進細(xì)胞Akt磷酸化來抑制間質(zhì)干細(xì)胞(MSCs)的凋亡作用,提高 MSCs的存活率[15-16]。本實驗觀察到過表達(dá)VEGF的UCMSCs中Akt呈現(xiàn)出更高的水平,而Akt作為抗凋亡蛋白之一,其高水平可明顯提高UCMSCs的存活能力。本研究結(jié)果顯示,轉(zhuǎn)染VEGF基因的UCMSCs能使細(xì)胞獲得局部持續(xù)、穩(wěn)定、高效表達(dá)VEGF蛋白的能力,同時轉(zhuǎn)染EGFP基因?qū)崿F(xiàn)目的基因VEGF在體內(nèi)外表達(dá)的示蹤定位,了解轉(zhuǎn)染后UCMSCs功能及分化、移植定位等;通過上調(diào)Akt信號通路等提高MSCs的抗凋亡能力,促進MSCs移植后的“歸巢”及內(nèi)皮修復(fù)。
總之,采用UCMSCs作為VEGF基因治療的平臺,通過有效目的基因轉(zhuǎn)染入靶細(xì)胞,可持續(xù)高效表達(dá)高生物學(xué)活性的內(nèi)源性VEGF以促進其向血管內(nèi)皮分化,減少UCMSCs的凋亡,為VEGF基因聯(lián)合UCMSCs治療獲得糖尿病下肢血液循環(huán)重建的可行性提供有力理論依據(jù)[17-21]。
[1] Frelin C,Ladoux A,Dangelo G.Vascular endothelial growth factors and angiogenesis[J].Ann Endocrinol Par-is,2000,61(1):70-74.
[2] Liang W,Cai Q,Liu Y.Transfection of human vascular endothelial growth factor 165 gene into rat bone marrow mesenchymal stem cells in vitro[J].Chinese Journal of Reparative and Reconstructive Surgery,2011,25(11):1383-1388.
[3] Smadja D,Silvestre JS,Levy B I.Transfusion clinique et biologique:journal de la Societe francaise de transfusion sanguine[J].Transfus Clin Biol,2013,20(2):211-220.
[4] 何璽君,李慧勇,彭余江,等.腺病毒介導(dǎo)hVEGF編碼基因轉(zhuǎn)染骨髓基質(zhì)干細(xì)胞的實驗研究[J].浙江創(chuàng)傷外科,2012,17(5):596-598.
[5] Iwaguro H,Yamaguchi J,Kalka C.Endothelial progenitor cell vascular endothelial growth factor gene transfer for vascular regeneration[J].Circulation,2002,105(6):732-738.
[6] Schneider R K,Püllen A,Kramann R,et al.Long-term survival and characterisation of human umbilical cordderived mesenchymal stem cells on dermal equivalents.[J].Differentiation,2010,79(3):182-193.
[7] Baksh D,Yao R,Tuan R S.Comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bonemarrow[J].Stem Cells,2007,25(6):1384-1392.
[8] 李曉玲,朱旅云,趙芳.臍帶Wharton's Jelly中間充質(zhì)干細(xì)胞的生物學(xué)特性[J].中國組織工程研究與臨床康復(fù),2011,15(32):5979-5982.
[9] 何春耒,劉午陽,姬廣林,等.重組人血管內(nèi)皮生長因子165腺病毒載體的構(gòu)建與鑒定[J].中華臨床醫(yī)師雜志:電子版,2012,(2):54-56.
[10]李玉玲,李紅,胡明均,等.腺病毒裝載人vegf-165基因轉(zhuǎn)染的間充質(zhì)干細(xì)胞對下肢缺血性壞死大鼠模型促血管新生的作用[J].中國實驗血液學(xué)雜志,2010,18(6):1568-1573.
[11] Wang X,Hu P,Liu Z,etal.The stability of synthesized EGFPmRNA in vitro transfected into human umbilical cord mesenchymal stem cells[J].XiBao Yu Fen ZiMian Yi Xue Za Zhi,2013,29(10):1094-1097.
[12]代娜,李棟,時慶,等.血管內(nèi)皮生長因子對人骨髓和臍帶間充質(zhì)干細(xì)胞中內(nèi)皮細(xì)胞組分的影響[J].中國實驗血液學(xué)雜志,2012,20(3):717-721.
[13]洪敬欣,張茜真,韓俊領(lǐng),等.人臍帶間充質(zhì)干細(xì)胞在3種不同培養(yǎng)體系中的生長狀況及腺病毒感染效率[J].中國組織工程研究與臨床康復(fù),2010,14(1):42-47.
[14] Altaner C,Altanerova V,Cihova M,etal.Characterization ofmesenchymal stem cells of"no-options"patients with critical limb ischemia treated by autologous bone marrow mononuclear cells[J].PLoSOne,2013,8(9):e73722.
[15]李鵬,周長勇,尹磊,等.低氧對人臍帶間充質(zhì)干細(xì)胞活性和內(nèi)皮分化能力的影響及VEGF的干預(yù)作用[J].中南大學(xué)學(xué)報(醫(yī)學(xué)版),2013,38(4):329-340.
[16]孔霞,鄭飛,郭凌鄖,等.VEGF通過細(xì)胞外信號調(diào)節(jié)激酶途徑促進骨髓源間充質(zhì)干細(xì)胞的增殖[J].中國實驗血液學(xué)雜志,2010,18(5):1292-1296.
[17]何遠(yuǎn)東,王玉,彭江.人臍帶間充質(zhì)干細(xì)胞中神經(jīng)營養(yǎng)因子的表達(dá)[J].中華神經(jīng)醫(yī)學(xué)雜志,2012,11(5):438-442.
[18] Madonna R,Pizzi SD,Tartaro A,etal.Transplantation ofmesenchymal cells improves peripheral limb ischemia in diabetic rats[J].Mol Biotechnol,2014[Epub Ahead of Print].
[19]趙俊暕,陳乃耀,石峻,等.人臍血間充質(zhì)干細(xì)胞移植對創(chuàng)傷性腦損傷大鼠VEGF分泌及血管新生的影響[J].中國神經(jīng)免疫學(xué)和神經(jīng)病學(xué)雜志,2013,20(4):267-273.
[20] Shen W C,Liang C J,Wu V C,et al.Endothelial progenitor cells derived from Wharton's jelly of the umbilical cord reduces ischemia-induced hind limb injury in diabetic mice by inducing HIF-1alpha/IL-8 expression[J].Stem Cells Dev,2013,22(9):1408-1418.
[21]袁源,楊樹源,韓忠朝,等.人臍帶間充質(zhì)干細(xì)胞體外擴增和向神經(jīng)元樣細(xì)胞定向誘導(dǎo)分化的研究[J].中華神經(jīng)醫(yī)學(xué)雜志,2006,5(3):230-236.
Transfection of Adenovirus-mediated Vascular Endothelial Grow th Factor into Umbilical Cord Mesenchymal Stem Cells in Vitro
LIXiao-ling1a,ZHU Lyu-yun1a,SONGGuang-yao2,XINGHan-ying2,LIU Su-rui1b,WANG Chao2(1.Bethune International Peace Hospital of PLA,a,Department of Endocrinology,b.Department of Blood Bank,Shijiazhuang 050082,China;2.Department of Endocrinology,People's Hospital of Hebei Province,Shijiazhuang 050000,China)
ObjectiveTo investigate the feasibility of transfection of adenovirus-mediated vector vascular endothelial growth factor(VEGF)into umbilical cordmesenchymal stem cells(UCMSCs)and the effectof VEGF transfection on UCMSCs function.MethodsVEGF165-EGFP genetic recombination of adenovirus vectors were constructed,and UCMSCs were isolated and cultured,and then adenovirus vector-enhanced green fluorescent protein(EGFP)transfected UCMSCs.The transfection effectwas observed under inverted fluorescencemicroscope,and transfection effectivenesswas detected by flow cytometer so to confirm the bestmultiplicity of infection(MOI).Cells were divided into VEGF-EGFP transfection group,EGFP group and control group,and the cellswere transfected and collected based on the best MOI.Expressions of VEGF and protein kinase B(PKB also named Akt)signaling protein were detected by Western blotting;the expression of VEGF proteinwas detected by enzyme linked immunosorbentassay(ELISA).The proliferation effectof transfected UCMSCswas evaluated with CCK 8 method.ResultsAdenovirus-mediated VEGF165-EGFP gene successfully transfected UCMSCs,and VEGF gene was transcribed and expressed in cells,and then was secreted out of cells.Levels of VEGF and Akt transfection secretion in VEGF-EGFP group 48 hours after transfection were significantly higher than those in EGFP group and control group;the expression and secretion of VEGF could be detected in VEGF-EGFP transfection group by ELISA 48 hours after transfection,and the peak appeared 4thd after transfection,at the same time the expressions in VEGF group were significantly higher than those in EGFP group and control group(P<0.01),and then the levels gradually decreased,butcanmaintain stable expression for severaldays.ResultsofCCK 8method showed that VEGF gene transfection had no significant effect on the UCMSCs proliferation.ConclusionAdenovirus-mediated VEGF-EGFP genemay successfully transfect UCMSCs,maintain UCMSCs original biological characteristics,and significantly and efficiently express VEGF,which can provide theoretical basis for the feasibility of VEGF gene combined with UCMSCs in treatment of diabetic lower limb blood circulation reconstruction.
Vascular endothelial growth factor;Umbilical cord mesenchymal stem cell;Adenovirus vector;Transfection
R349.8
A
2095-140X(2014)05-0005-05
10.3969/j.issn.2095-140X.2014.05.002
河北省自然科學(xué)基金課題(H2013505067)
050082石家莊,解放軍白求恩國際和平醫(yī)院內(nèi)分泌科(李曉玲、朱旅云),輸血科(劉素蕊);050000石家莊,河北省人民醫(yī)院內(nèi)分泌科(宋光耀、邢邯英、王超)
2014-02-20 修回時間:2014-03-16)
·論著·

