腹腔鏡下電子胃鏡手術治療胃間質瘤38例
孔延龍,于建平,韓曉鵬,朱萬坤,蘇 琳,劉宏斌
腹腔鏡下電子胃鏡手術治療胃間質瘤38例
孔延龍,于建平,韓曉鵬,朱萬坤,蘇 琳,劉宏斌
目的探討經腹腔鏡下電子胃鏡手術治療胃間質瘤(GSTs)的安全性及可行性。方法 對2008年8月—2012年8月我院應用電子胃鏡定位后腹腔鏡下行胃腔外腫瘤楔形切除術38例GSTs的臨床資料進行回顧性分析。結果 38例行胃腫瘤楔形切除術手術時間(82.4±31.6)min,術中出血量(32.2±13.8)m l,術后住院(5.8±1.6)d。術后無吻合口出血、吻合口漏、切口感染等并發癥。35例獲得隨訪,術后隨訪6~48個月,均未見復發。結論經腹腔鏡下電子胃鏡治療GSTs具有定位準確,手術時間短,并發癥少等優點,安全可行。
腹腔鏡檢查;胃鏡檢查;腸胃間質瘤
Mazur等[1]于1983年首次提出胃腸道間質瘤(gastrointestinal stromal tumor,GIST)的概念,是起源于胃腸道原始非定向多潛能間質干細胞,其組織學形態有梭形細胞、上皮樣細胞或多形性細胞。Hirota于1998年發現GIST c-kit基因的突變,KIT蛋白產物(CD117)是GIST的高特異性的標記物[2]。近年研究表明GIST少有通過淋巴結途徑轉移,不需行大范圍的淋巴結清掃,對于<5 cm的腫瘤可行局部切除。Lukaszczyk等[3]于1992年首次成功通過腹腔鏡下切除GIST。隨著腹腔鏡技術的發展,其微創效果得到越來越多的人認可,但腹腔鏡下對胃腸道病變范圍較小的腫瘤和一些特殊部位的腫瘤(腔內生長或胃后壁),往往存在定位困難等技術方面的不足,導致手術效果不滿意[4-5]。因此,術中電子胃鏡協助定位,經腹腔鏡切除胃腸道腫瘤(雙鏡聯合)具有重要的臨床意義。我院2008年8月—2012年8月對收治的38例胃間質瘤(GSTs)術中應用電子胃鏡定位,成功行經腹腔鏡下胃腔外腫瘤楔形切除、胃部分切除術,現報告如下。
1 資料與方法
1.1 一般資料 本組38例,男21例,女17例,年齡31~69歲,平均55.9歲。術前均行電子胃鏡及電子超聲胃鏡檢查示胃黏膜下腫物,直徑2.0~4.0 cm,邊界清楚,其中3例腫物表面有小潰瘍。影像學診斷均考慮為GSTs。腫瘤位于賁門下方小彎側8例,胃底部12例,胃體部15例(其中胃體前壁11例、胃體后壁4例),胃竇部3例。術后病理均明確診斷GSTs。
1.2 手術方法 氣管插管全麻下,患者仰臥位,雙腿分開,呈“大”字形。于臍下作弧形10 mm小切口,以氣腹針穿刺入腹腔,充入 CO2氣體造成12 mmHg氣腹。拔出氣腹針,以套管針穿刺腹腔,插入腹腔鏡。腹腔鏡明視下分別于雙側鎖骨中線臍水平、雙側腋中線平肋緣作小切口(術者及一助右手操作部位置入12 mm Trocar,左手部位置入5 mm Trocar,以方便操作),經戳孔置入超聲刀、抓鉗等。腹腔鏡下暴露胃體,確定瘤灶位置。對于腫瘤較大,向胃腔外突出者,可通過腹腔鏡明確腫瘤位置,無需經電子胃鏡配合;若腫瘤較小或腫瘤向胃腔內生長,通過腔鏡無法確定腫瘤位置,則需經口腔置入電子胃鏡觀察胃內病變,確定瘤灶位置。依據術前胃鏡及電子超聲胃鏡對腫瘤的初步定位,調整胃鏡探頭的角度及位置,施行胃鏡定位者和腹腔鏡術者在胃壁內外相互配合,通過器械擠壓胃壁,并在腔鏡高清圖像中觀看從胃腔內透出的光亮,準確定位腫瘤(圖1A、B)。手術切除方法選擇:①胃前壁(11例):直接用腔內直線型切割閉合器(Endo-GIA)閉合瘤體,或分離網膜等毗鄰結構楔形切除(圖1C);②胃后壁或胃底(胃體后壁4例,胃底10例腫瘤較小者):在橫結腸上緣無血管區用超聲刀剪開胃結腸韌帶,將橫結腸系膜之前葉分離。向右游離至胃竇部,向左至胃網膜左動脈,鈦夾夾閉后離斷,將胃挑起,繼續游離胃后韌帶至膈肌腳;沿脾胃韌帶以超聲刀向上游離至賁門左側;徹底暴露胃后壁或胃底腫瘤,腔鏡明視下Endo-GIA在距離病灶邊緣>2 cm的范圍將胃連同病灶一起離斷閉合瘤體或楔形切除瘤體,止血;③對于胃底或胃竇部較大腫瘤并向胃腔內生長者(胃竇3例,胃底2例),需行近側胃或遠側胃部分切除術。標本的移除:較小腫瘤,可放入取物袋內自12 mm戳孔中取出。對于較大腫瘤者,無法從戳孔中取出,則需于上腹正中或順延戳孔取一小口,長3~5 cm(視腫瘤大小相應調整),逐層切開進腹,置入切口保護套,保護切口,將游離的標本移除腹腔,觀察腫瘤是否完整,周圍切緣是否足夠(圖1D)。標本送冷凍病理檢查,確保完整切除及排除胃癌可能。
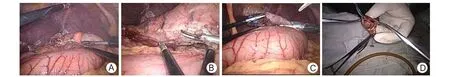
圖1 胃間質瘤腹腔鏡及電子鏡腫瘤定位及切除
2 結果
38例均成功施行腹腔鏡手術,無中轉開腹(其中2例行遠側胃次全切,于上腹正中取3~5 cm小切口,在保護套下取出標本)。手術時間30~144(82.4±31.6)min、術中出血量20~100(32.2±13.8)ml、術后胃管留置時間10~14 h,腸道功能恢復時間12~48 h、下床活動時間8~20 h、術后24~48 h恢復流質飲食、術后住院時間5~8(5.8±1.6)d。術后無吻合口出血、吻合口漏、切口感染等并發癥。免疫組織化學結果:CD117陽性35例(92.1%),CD34陽性28例(73.7%)。生物學風險分級:極低度風險22例(圖2A),免疫組化顯示:瘤組織 CKp(-),Vimentin(++),CD117(+),CD34(+),Dog-1(+),SMA(-),S-100(-),Ki-67 <5%;低度風險11例(圖2B),免疫組化顯示:瘤組織CKp(-),Vimentin(++),CD117(++),CD34(++),Dog-1(++),SMA(-),S-100(-),Ki-67<5%。中度風險3例。高度風險2例(圖2C),免疫組化顯示:瘤組織 CKp(-),Vimentin(++),CD117(+++),CD34(+++),Dog-1(+++),SMA(- ),S-100(-),Ki-67核陽性細胞灶性 >10%,Desmin(-)。切緣均未見瘤體組織。隨訪6~48個月,均未見復發。術后石蠟切片病理診斷示GSTs。術后35例疼痛輕微,3例感疼痛,給予鹽酸哌替啶肌內注射,疼痛緩解。術后35例(92.1%)獲得隨訪,時間6~48個月,平均26個月。隨訪病例經CT、電子超聲胃鏡檢查未發現復發及轉移。
3 討論
GIST是一種起源于Cajal細胞的胃腸道非上皮源性間質腫瘤,占胃腸道腫瘤的3%,其中GSTs約占GIST的60%[6]。GIST是一種具有多向分化潛能并具有潛在惡性的腫瘤,其惡性程度主要與瘤體大小及核分裂數目相關。目前研究認為,CD117陽性表達是診斷GIST的金標準[7-8]。GSTs主要是通過血行轉移到肝臟[9],臨床上也可見淋巴結轉移,但術中一般無需淋巴結清掃[10-11]。對未轉移的GSTs患者,手術切除是治療的首選[12]。手術切除的關鍵是腫瘤完整切除并盡可能保留胃的功能,重點強調切緣無轉移[9,12]。
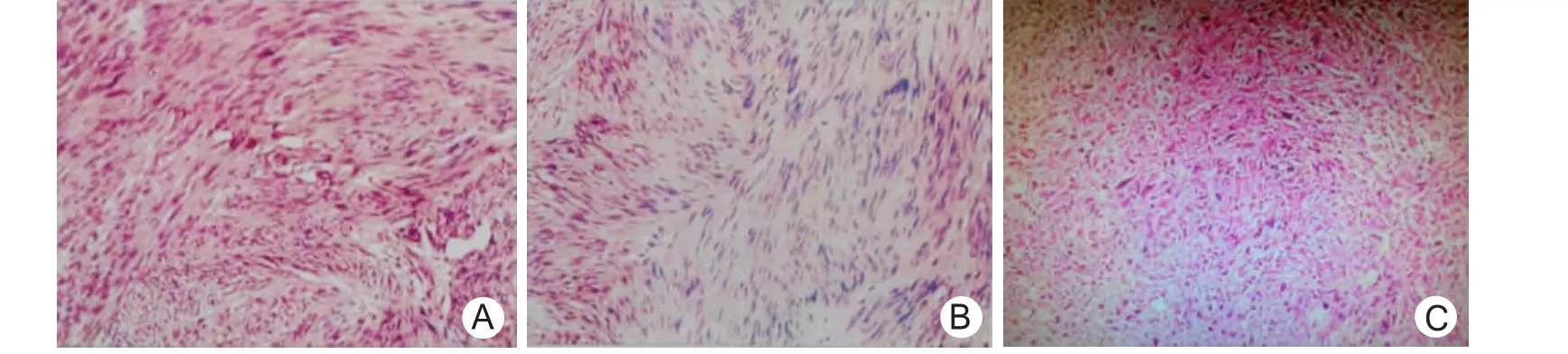
圖2 胃間質瘤切除組織免疫組化結果(HE×100)
1992年Lukaszczyk等[3]首先報道了通過腹腔鏡成功切除 GIST,Nguyen等[13]通過大宗的病例研究,認為通過腹腔鏡行GIST切除術在并發癥及病死率方面與傳統手術比較無明顯差異,是安全可行的。隨著工業科技的發展,腹腔鏡器械發展和腹腔鏡手術技術日益成熟,Endo-GIA可直接將標本切除并一次性完成吻合,大大簡化了手術的過程,縮短了手術時間。但是單純行腹腔鏡下GSTs切除在臨床仍存在一些技術方面的難點:①腫瘤較小或瘤體向腔內生長時難以精確定位,手術操作有一定的盲目性;②腔鏡下操作,視野局限,但手術要求較高,需要腫瘤完整切除,切緣無轉移,還要保留胃的功能。
電子胃鏡聯合腹腔鏡(LGCS)手術切除GSTs在一定程度充分發揮了雙鏡的優勢,彌補了單一腹腔鏡在GSTs手術切除方面的弱項,充分顯示了其在微創外科的臨床應用價值。電子胃鏡能夠精準地為腫瘤定位并協助其完成手術。同時腹腔鏡手術在胃鏡直視定位下進行病灶完整切除,可保證切緣的陰性,還可盡量保留正常胃壁組織,減少對胃正常功能損傷。同時可通過胃鏡檢查有無狹窄、漏氣,確保了手術質量[14]。
LGCS手術中的關鍵點是病變的定位。術中應用胃鏡活檢鉗在胃鏡直視下將病變處黏膜向外推動或從腔鏡高清圖像中觀看從胃腔內透出的光亮,準確定位腫瘤,以達到定位目的。本組38例GSTs,36例在雙鏡聯合下成功利用Endo-GIA局部直線切除或楔形切除,2例因腫瘤較大,位居賁門或胃竇部,為避免術后出現狹窄,行胃部分切除。通過本組研究,筆者體會下列情形需采用LGCS切除GSTs:①腫瘤橫徑<5 cm并向腔內生長;②腫瘤位于胃后壁,術中預計尋找瘤體有困難;③瘤體較小單純性腹腔鏡下無法探及;④術前通過電子超聲胃鏡及CT檢查腫瘤未侵犯周圍臟器及腹腔轉移。本組38例應用雙鏡聯合的方法,均準確定位腫瘤并確定腫瘤范圍,順利通過腹腔鏡完成GSTs切除,達到微創的效果。
LGCS技術在近年來是一種新型微創外科手術,在治療GSTs中有重要的臨床應用價值。與傳統的開放性手術相比,具有創傷小、手術時間短、出血少、術后恢復快等優點[15-18]。內鏡下黏膜下切除適應證較窄,一旦穿孔需急診二次手術,內鏡與腹腔鏡聯合手術能相互補充不足,相輔相成,較單純腹腔鏡手術、內鏡治療更安全、術后并發癥更少、復發率更低[19]。臨床經驗:①不能盲目追求小切口或無切口,防止取標本時腫瘤破裂播散;②腹腔鏡定位后,胃鏡再次明確是否抓取準確,確保一次性整塊切除;③手術醫師、器械護士、胃鏡技師為一固定團隊。隨著腹腔鏡手術的廣泛開展,手術者操作水平的提高,超聲刀及Endo-GIA的合理使用,以及臨床外科醫師的不斷探索,雙鏡聯合技術縮短了手術時間,減少了手術創傷,將有更廣泛的發展空間。
[1] Mazur M T,Clark H B.Gastric stromal tumors.Reappraisal of histogenesis[J].Am J Surg Pathol,1983,7(6):507-519.
[2] 師英強,杜春燕.胃腸道間質瘤臨床治療進展[J].實用腫瘤雜志,2003,18(4):263-265.
[3] Lukaszczyk J J,Preletz R JJr.Laparoscopic resection of benign stromal tumor of the stomach[J].J Laparoendosc Surg,1992,2(6):331-334.
[4] 仇明,沈炎明,鄭成竹,等.電視腹腔鏡技術在胃腸外科的應用[J].中華醫學雜志,1996,76(2):92-95.
[5] Sasaki A,Koeda K,Obuchi T,et al.Tailored laparoscopic resection for suspected gastric gastrointestinal stro-mal tumors[J].Surgery,2010,147(4):516-520.
[6] Bertolini V,Chiaravalli A M,Klersy C,et al.Gastrointestinal stromal tumors-frequency,malignancy,and new prognostic factors:the experience of a single institution[J].Pathol Res Pract,2008,204(4):219-233.
[7] Miettinen M,Lasota J.Gastrointestinal stromal tumorsdefinition,clinical,histological,immunohistochemical,and molecular genetic features and differential diagnosis[J].Virchows Arch,2001,438(1):1-12.
[8] 饒旭光,楊偉,馬立民,等.13例食管賁門間質瘤的診斷和治療[J].中國腫瘤臨床,2008,35(10):566-567.
[9] Ponsaing L G,Hansen M B.Therapeutic procedures for submucosal tumors in the gastrointestinal tract[J].World JGastroenterol,2007,13(24):3316-3322.
[10] Heinrich M C,Corless C L.Gastric GI stromal tumors(GISTs):the role of surgery in the era of targeted therapy[J].JSurg Oncol,2005,90(3):195-207.
[11]付焱,李恒,金曙,等.雙鏡聯合行胃間質瘤切除術的臨床分析[J/CD].中華臨床醫師雜志:電子版,2012,6(20):6557-6558.
[12] D'Amato G,Steinert D M,McAuliffe JC,et al.Update on the biology and therapy of gastrointestinal stromal tumors[J].Cancer Control,2005,12(1):44-56.
[13] Nguyen SQ,Divino CM,Wang JL,etal.Laparoscopic management of gastrointestinal stromal tumors[J].Surg Endosc,2006,20(5):713-716.
[14]楊平,鄧建中,程龍慶,等.雙鏡聯合技術在胃間質瘤切除術中的應用[J].中華腔鏡外科雜志,2010,3(2):178-181.
[15]江平,李桂圓.胃腸道間質瘤56例的外科診療分析[J/CD].中華臨床醫師雜志:電子版,2012,6(6):1592-1593.
[16]朱柱.胃間質瘤的CT診斷[J].中國醫藥科學,2011,1(7):111-112.
[17] Tsujimoto H,Yaguchi Y,Kumano I,et al.Successful gastric submucosal tumor resection using laparoscopic and endoscopic cooperative surgery[J].World JSurg,2012,36(2):327-330.
[18]范西紅,張小化,張小橋,等.胃腸間質瘤35例診治體會[J].中華腫瘤防治雜志,2009,16(9):713-714.
[19]Eisenberg D,Bell R.Intraoperative endoscopy:a requisite tool for laparoscopic resection ofunusualgastrointestinal lesions a case series[J].JSurg Res,2009,155(2):318-320.
Laparoscopes Combined with Electronic Gastroscope in Surgical Treatment of 38 Patients with Gastrointestinal Stromal Tumors
KONG Yan-long,YU Jian-ping,HAN Xiao-peng,ZHUWan-kun,SU Lin,LIU Hong-bin(Department of General Surgery,Lanzhou General Hospital of Lanzhou Military Area Command,Lanzhou 730050,China)
ObjectiveTo explore the feasibility and security of laparoscopes combined with electronic gastroscope in surgical treatment of gastrointestinal stromal tumors(GSTs).MethodsClinical data of38 patientswith GSTs
gastric extraluminalwedge-resection under laparoscopes after intraoperative localization by the electronic gastroscope during August2008 and August2012 was retrospectively analyzed.ResultsOf the38 patients,the average operation time was(82 ±31)min,intraoperative blood losswas(32 ±13)m l,and postoperative hospital stay was(5.8 ±1.6)d.Therewas no complication such as postoperative stoma bleeding,stoma leakage or incision infection.During 6-48 months of follow-up for 35 patients,there was no recurrence.ConclusionLaparoscopes combined with electronic gastroscope in surgical treatment of GSTs is safe with the advantages of accurate location,short operative time and fewer complications.
Laparoscopy;Gastroscopy;Gastrointestinal stromal tumor
R735
A
2095-140X(2014)04-0064-04
10.3969/j.issn.2095-140X.2014.04.018
國家科技部、財政部惠民計劃(2012GS620101);甘肅省科技廳科技重大專項資助項目(2010GS04390)
730050蘭州,蘭州軍區蘭州總醫院普通外科
劉宏斌,E-mail:Liuhongbin999@163.com
2013-12-01 修回時間:2014-01-09)
·論著·

