氧化魔芋葡甘露聚糖對齊口裂腹魚品質和脂肪代謝相關基因表達的影響
周 成,鄔應龍,向世瓊,夏曉杰
氧化魔芋葡甘露聚糖對齊口裂腹魚品質和脂肪代謝相關基因表達的影響
周 成,鄔應龍*,向世瓊,夏曉杰
(四川農業大學食品學院,四川 雅安 625014)
目的:研究日糧氧化魔芋葡甘露聚糖(oxidized konjac glucomannan,OKGM)對齊口裂腹魚的品質和脂肪代謝相關基因表達的影響。方法:將初始體質量為80 g的齊口裂腹魚隨機分成5 組,分別飼喂質量分數為0(對照組)、0.4%、0.8%、1.6%、3.2% OKGM,養殖60 d后,考察OKGM對齊口裂腹魚的品質和脂肪代謝相關基因表達的影響。結果:與對照組相比,日糧OKGM添加量為1.6%和3.2%能顯著增加齊口裂腹魚腹肌中蛋白質含量(P<0.05),添加量為0.8%時,會顯著降低腹肌粗脂肪含量(P<0.05),OKGM添加量對齊口裂腹魚肌肉中水分和粗灰分無顯著影響(P>0.05);添加量對齊口裂腹魚肌肉的pH值、失水率、羥脯氨酸含量、膠原蛋白含量的影響均無顯著性差異(P>0.05);添加量為1.6%時能顯著升高肌肉中過氧化物酶體增殖物激活受體-α(peroxisome proliferator activated receptor-α,PPAR-α)mRNA 表達水平(P<0.05),添加量為0.8%能顯著升高肝胰臟中PPAR-α mRNA表達水平(P<0.05);添加量為0.8%能極顯著降低齊口裂腹魚肌肉中脂肪酸結合蛋白(fatty acid binding protein,FABP)mRNA表達水平(P<0.01),添加量對肝胰臟中FABP mRNA表達水平的影響差異均不顯著(P>0.05)。結論:日糧中添加適量OKGM能改善齊口裂腹魚的品質,調節脂肪代謝相關基因表達。
氧化魔芋葡甘露聚糖;齊口裂腹魚;品質;過氧化物酶體增殖物激活受體-α;脂肪酸結合蛋白
齊口裂腹魚(Schizothorax prenanti Tchang)為川西高原特有的冷水性魚類,其肉質細嫩、味道鮮美,具有較高的營養價值和經濟價值,是產區名貴的野生經濟魚類[1-2]。目前,齊口裂腹魚的人工繁殖技術已經基本成熟[3],并逐步開始了集約化養殖。但在養殖過程中,各種疾病時有發生,影響了齊口裂腹魚人工養殖的發展[4]。有效提高養殖魚類的品質,保證魚肉的質量安全,對促進養殖業的持續健康發展具有深遠意義。
氧化魔芋葡甘露聚糖是魔芋葡甘露聚糖(konjac glucomannan,KGM)經適當的氧化劑氧化后制得的。KGM是到目前為止最優良的可溶性膳食纖維,同時具有降血脂、降血糖、增強免疫等生理功能,對預防和輔助治療各種疾病,如肥胖癥、腸道癌、心血管病、糖尿病等,具有重要作用[5]。
過氧化物酶體增殖物激活受體(peroxisome proliferator activated receptors,PPARs)是一類由配體激活的核轉錄因子,屬Ⅱ型核受體家族成員[6]。PPARs分為α、β、γ 3個亞型[7]。PPARs在介導脂肪酸氧化及脂肪代謝中起重要作用,其靶基因均與脂質轉運和代謝途徑有關。Desvergne等[8]報道,PPARs可增加脂肪酸轉運蛋白和脂肪酸轉運酶的表達,刺激細胞對脂肪酸的攝入和向脂酸CoA的轉化PPARs是調控肝臟脂肪酸氧化酶基因表達的轉錄因子。Panadero等[9]研究表明:PPAR-α可以調節若干線粒體脂肪酸催化酶的表達,通過誘導肌肉和肝臟特異性的肉毒堿棕擱酸轉運酶表達而調控脂肪酸向線粒體的轉運,刺激β-氧化過程,降低脂肪酸和甘油三酯合成。脂肪酸結合蛋白(fatty acid binding protein,FABP)屬于脂質結合蛋白超家族成員,是一類分子質量較小而對脂肪酸有高親和力的可溶性蛋白質[10],有研究表明,心型脂肪酸結合蛋白(H-FABP)表達量與肌間脂肪含量呈正相關[11],因此脂肪酸結合蛋白基因被作為肌肉間脂肪的候選基因。
本實驗主要研究日糧中添加氧化魔芋葡甘露聚糖(oxidized konjac glucomannan,OKGM)對齊口裂腹魚肌肉品質的影響,并通過實時熒光定量聚合酶鏈式反應(real-time polymerase chain reaction,RT-PCR)技術檢測齊口裂腹魚脂肪代謝相關基因PPAR-α、FABP的mRNA表達水平。由于沉淀在肌肉內的脂肪含量與肉的嫩度和風味有直接的關系,對齊口裂腹魚PPARs及其脂肪代謝相關基因的研究,可為齊口裂腹魚育種和品質改良提供理論依據。
1 材料與方法
1.1 材料與試劑
OKGM由四川農業大學食品學院功能性食品實驗室自制[12];齊口裂腹魚購自四川省雅安天泉雅魚場,為2011年孵化的同一批魚種,體質量(79.54±8.12)g/尾,選擇體質健壯的實驗魚300 尾,暫養馴食14 d后開始實驗;魚粉、豆粕、玉米、麩皮、魚用多維、礦物添加劑、磷酸二氫鈣由四川農業大學動物營養研究所提供;菜油、面粉購自雅安市農貿市場。
總膽固醇、甘油三酯試劑盒 南京建成生物工程研究所;TRNzol 天根生化科技有限公司;反轉錄試劑盒、SYBR?Premix Ex TaqTM日本TaKaRa公司;西班牙瓊脂糖 北京恒奧生物科技有限公司;其他試劑均為國產分析純。
1.2 儀器與設備
PCR儀、凝膠成像系統、熒光定量PCR儀、水平電泳槽、電泳儀 美國Bio-Rad公司;微量移液器、Centrifuge 5810R高速低溫離心機 德國Eppendorf公司。
1.3 動物飼養與管理
1.3.1 動物分組與管理
暫養2 周后,選擇健康無傷病的齊口裂腹魚隨機分組,設1 個對照組,4 個OKGM處理組,每個處理組設3 個平行組。每個處理組投放20 尾魚,每個重復組投入1 個魚缸(規格為0.70 m×0.50 m×0.50 m),共15 個魚缸,按實驗設計分別編號。每天以體質量2.5%的量投喂飼料,定時、定質、定量投喂飼料,實驗期間水溫為 18~22 ℃,pH 7.4~7.6。實驗期間保持微流水,各實驗池水體每天的交換量為30%。實驗結束禁食24 h,進行各種指標的測定。
1.3.2 實驗飼料
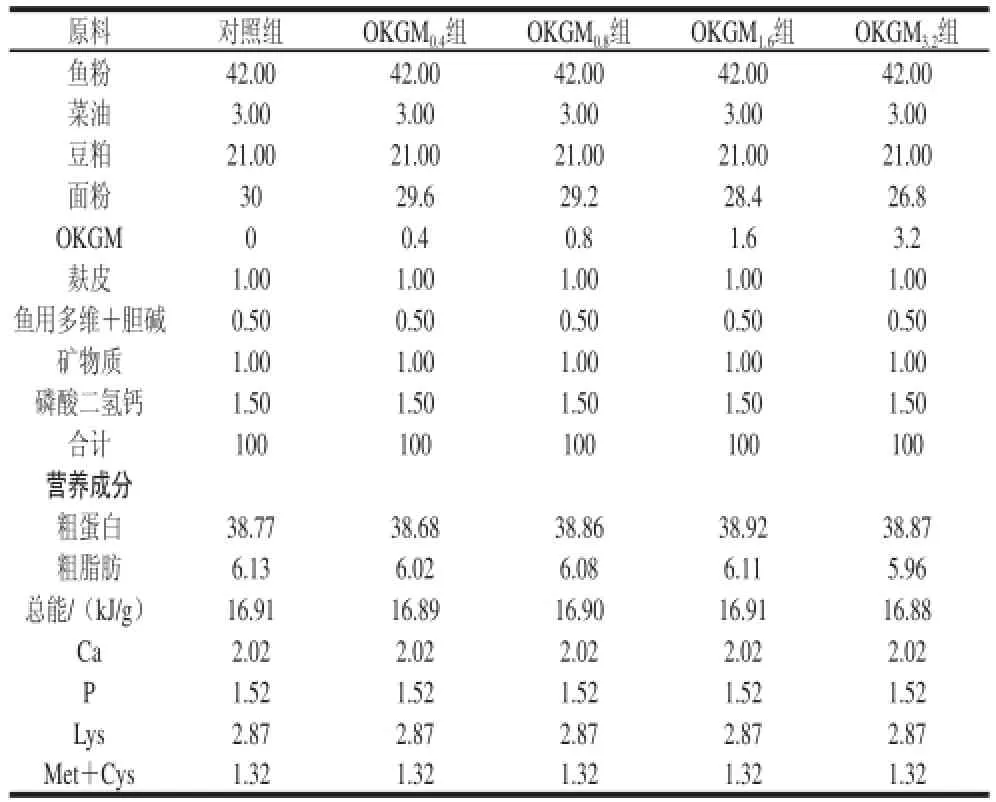
表1 實驗飼料的組成及營養水平Table 1 Composition and nutrient levels of the experimental diets %
以魚粉、豆粕為蛋白源,以食用菜油為脂肪源,參照美國國家科學研究委員會(1994)魚類的營養需要,段彪[13]和何雷[14]等的齊口裂腹魚飼料配方設計,基礎飼料配方及營養水平見表1,飼料原料均過40目篩,按飼料配方表制得基礎飼料;在基礎飼料中分別添加質量分數為0、0.4%、0.8%、1.6%、3.2%的OKGM,分別記為對照組、OKGM0.4、OKGM0.8、OKGM1.6、OKGM3.2組,配成氮含量和能量相等的5 種飼料,實驗飼料充分混合后用制粒機加工成直徑1 mm的硬顆粒飼料,干燥并密封保存于4 ℃備用。
1.4 方法
1.4.1 樣品采集
實驗結束時,解剖齊口裂腹魚后迅速取出肝胰臟和肌肉組織,放入液氮中,-80 ℃保存備用;背肌取第1 根背鰭至最后1 根背鰭之間,側線以上白肌,腹肌取側線以下腹部肌肉(每次取樣位置盡可能在相同位置),置于-20 ℃冰箱中保存。
1.4.2 魚肉基本組成的測定
魚體粗蛋白質采用凱氏定氮法測定(GB 5009.5—2010《食品中蛋白質的測定》);粗脂肪和肌內脂肪(intramuscular fat,IMF)采用索氏抽提儀測定法(GB/T 14772—2008《食品中粗脂肪的測定》);水分采用干燥法測定(GB 5009.3—2010《食品中水分的測定》);粗灰分采用馬福爐灼燒法測定(GB 5009.4—2010《灰分的測定》)。
1.4.3 肌肉pH值[15]和失水率[16]的測定
魚宰殺后取背部肌肉5 g,冷藏于4 ℃冰箱中24 h后,剔除肌間刺剪碎,加入少量蒸餾水,用研缽碾碎勻漿,然后轉移到小燒杯內,加入等量蒸餾水混和均勻,靜置10 min后,提取上清液,用酸度計測定pH值。重復3 次,取平均值。
取魚體背部肌肉(相同位置)5 g,稱質量m0,于沸騰水中煮5 min,撈出冷卻,吸去魚肉表面水分,稱質量為m,按照公式(1)計算失水率,重復3 次,計算平均失水率。
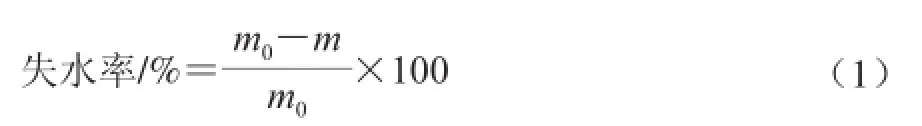
1.4.4 肌肉羥脯氨酸含量的測 定及膠原蛋白含量[17]計算
羥脯氨酸含量按照試劑盒說明書測定,以鮮樣計。膠原蛋白含量按照公式(2)計算,以濕質量計。

1.4.5 肌肉和肝胰臟PPAR-α mRNA、FABP mRNA表達水平的測定
1.4.5.1 引物設計與合成
用Primer Premier 5.0軟件根據GenBank中齊口裂腹魚β-actin基因序列(JQ013000)、PPAR-α基因序列(KF316324)、FABP基因序列(GU205786)設計特異性引物,引物序列如表2。
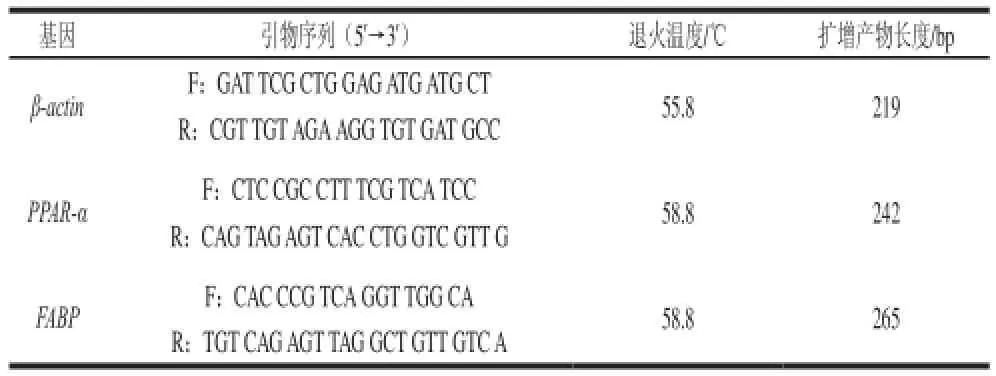
表2 引物序列及退火溫度Table 2 Primer sequences and corresponding annealing temperatures
1.4.5.2 總RNA提取和cDNA制備
參照TRNzol總RNA提取試劑盒說明書方法提取RNA,用1 g/100 mL的瓊脂糖凝膠電泳鑒定提取RNA的完整性,OD260nm/OD280nm檢測樣本純度。
cDNA由反轉錄試劑盒法制備放置于-20 ℃備用。
1.4.5.3 RT-PCR基因檢測
采用SYBR GreenⅠ熒光染料法,10 μL反應體系,含5 μL SYBR?Premix Ex TaqTM(2×)、上下游引物各0.25 μL、1 μL cDNA、3.5 μL DEPC水。熒光定量PCR步驟:95 ℃ 3 min;95 ℃ 10 s,55.8 ℃(β-actin) 30 s,39 個循環;95 ℃ 10 s;擴增完畢后,迅速降溫到65 ℃進行溶解曲線分析,然后以0.5 ℃/s的速率從65 ℃遞增到95 ℃,連續測定樣品熒光強度以獲取溶解曲線。
1.4.5.4 相對表達量 的分析
以β-actin基因作為內參基因,選擇一校準樣本,比較待測樣本相對校準樣本的表達差異,利用2-△△Ct法進行相對定量分析[18]。
式中:Δ ΔCt=(Ct受檢基因-Ctβ-actin)待測樣本-(Ct受檢基因-Ctβ-actin)校準樣本
結果是通過參照基因表達水平校正的待測樣本中的目標基因相對于校準樣本的相對表達量,用參照基因校準目標基因表達來彌補樣本組織量的差異。
1.5 統計學分析
結果用x±s表示,采用SPSS 19.0對數據進行單因素方差分析(One-Way ANOVA),Duncan’s多重比較,差異顯著水平為P<0.05。
2 結果與分析
2.1 日糧OKGM對齊口裂腹魚品質的影響
2.1.1 日糧OKGM對齊口裂腹魚背肌和腹肌基本成分的影響
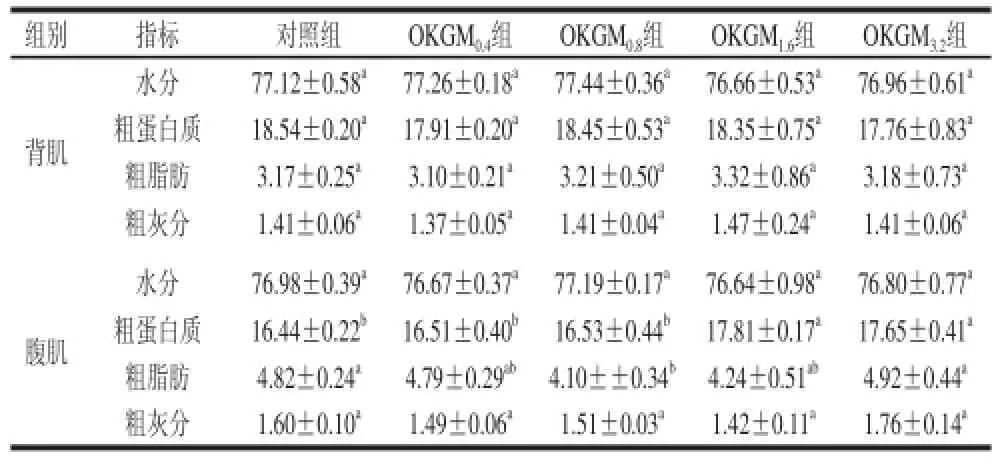
表3 日糧OKGM對齊口裂腹魚的背肌和腹肌基本成分的影響x±s,n=8)Table 3 Effect of dietary OKGM on basic composition of back muscle and abdominal muscle of Schizothorax prenanti Tchang x±s,n=8) g/100 g
由表3可知,與對照組相比,日糧OKGM添加量對齊口裂腹魚背肌水分、粗蛋白質、粗脂肪、粗灰分的影響均不顯著(P>0.05),當日糧OKGM添加量達到1.6%
及以上時,能顯著增加齊口裂腹魚腹肌中蛋白質含量(P<0.05),當日糧中添加了OKGM,齊口裂腹魚腹肌粗脂肪均有所降低,但OKGM添加量為0.8%時,腹肌粗脂肪才顯著降低(P<0.05),日糧OKGM添加量對齊口裂腹魚腹肌中水分和粗灰分影響不顯著(P>0.05)。
2.1.2 日糧OKGM對齊口裂腹魚肌肉pH值、失水率、羥脯氨酸及膠原蛋白含量的影響
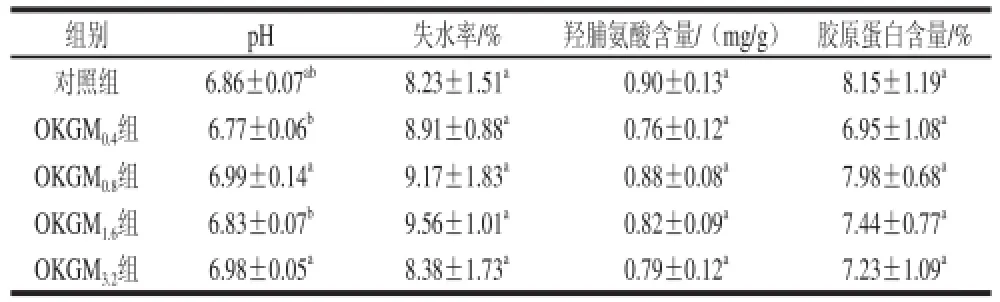
表4 日糧OKGM對齊口裂腹魚肌肉中pH值、失水率、羥脯氨酸及其膠原蛋白含量的影響(x±s,n=8)Table 4 Effect of dietary OKGM on muscle pH, dehydration rate, hydroxyproline content and collagen content of Schizothorax prenanti Tchang (x±s,n=8)
由表4可知,齊口裂腹魚肉冷藏24 h后,與對照組相比,日糧OKGM添加量為0.4%和1.6%能顯著降低肌肉的pH值(P<0.05),日糧OKGM添加量對齊口裂腹魚肌肉中的失水率、羥脯氨酸含量、膠原蛋白含量的影響均無顯著性差異(P>0.05)。
2.2 日糧OKGM對齊口裂腹魚IMF的影響
由圖1可知,與對照組相比,日糧OKGM添加量為0.8%時能顯著降低齊口裂腹魚IMF含量(P<0.05),其他組間的差異不顯著(P>0.05)。

圖1 日糧OKGM對齊口裂腹魚IMF的影響Fig.1 Effect of dietary OKGM on intramuscular fat of Schizothorax prenanti Tchang
2.3 日糧OKGM對齊口裂腹魚肌肉和肝胰臟PPAR-α mRNA、FABP mRNA表達水平的影響
2.3.1 日糧OKGM對齊口裂腹魚肌肉中PPAR-α mRNA表達水平的影響
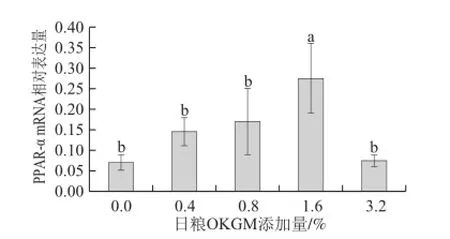
圖2 日糧OKGM對齊口裂腹魚肌肉中PPAR-α mRNA 表達水平的影響Fig.2 Effect of dietary OKGM on PPAR-α mRNA expression level in muscle of Schizothorax prenanti Tchang
由圖2可知,日糧OKGM組肌肉中PPAR-α mRNA 表達水平都高于對照組,當OKGM添加量為1.6%時,肌肉中PPAR-α mRNA表達水平顯著高于對照組(P<0.05),其他組PPAR-α mRNA增加都不顯著(P>0.05)。
2.3.2 日糧OKGM對齊口裂腹魚肝胰臟中PPAR-α mRNA表達水平的影響
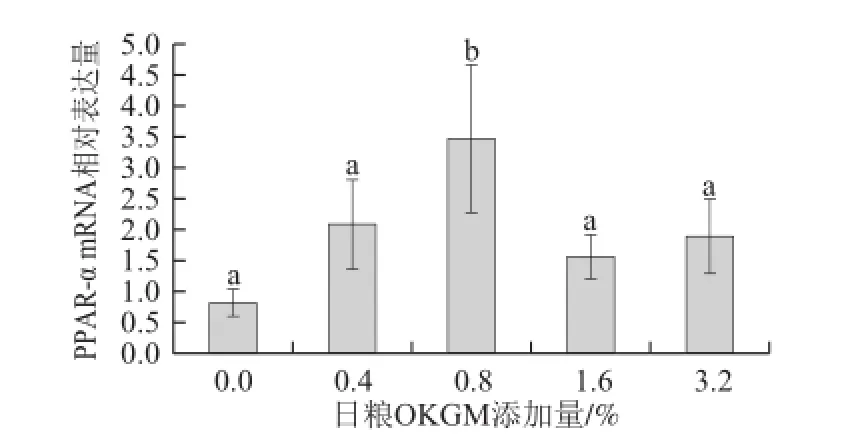
圖3 日糧OKGM對齊口裂腹魚肝胰臟PPAR-α mRNA表達量的影響Fig.3 Effect of dietary OKGM on PPAR-α mRNA expression level in liver of Schizothorax prenanti Tchang
由圖3可知,日糧OKGM組肝胰臟中PPAR-α mRNA 表達水平都高于對照組,當OKGM添加量為0.8%時,肝胰臟中PPAR-α mRNA 表達水平顯著高于對照組(P<0.05),其他組PPAR-α mRNA增加都不顯著(P>0.05)。
2.3.3 日糧OKGM對齊口裂腹魚肌肉中FABP mRNA表達水平的影響
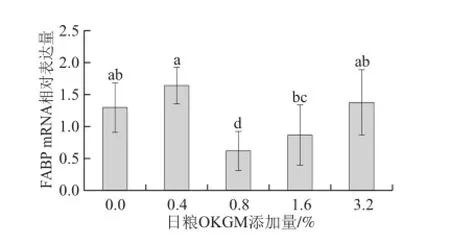
圖4 日糧OKGM對齊口裂腹魚肌肉中FABP mRNA表達水平的影響Fig.4 Effect of dietary OKGM on FABP mRNA expression level in muscle of Schizothorax prenanti Tchang
由圖4可知,與對照組相比,日糧OKGM添加量為0.8%能極顯著降低齊口裂腹魚肌肉中FABP mRNA表達水平(P<0.01),其他組差異都不顯著(P>0.05)。
2.3.4 日糧OKGM對齊口裂腹魚肝胰臟中FABP mRNA表達水平的影響
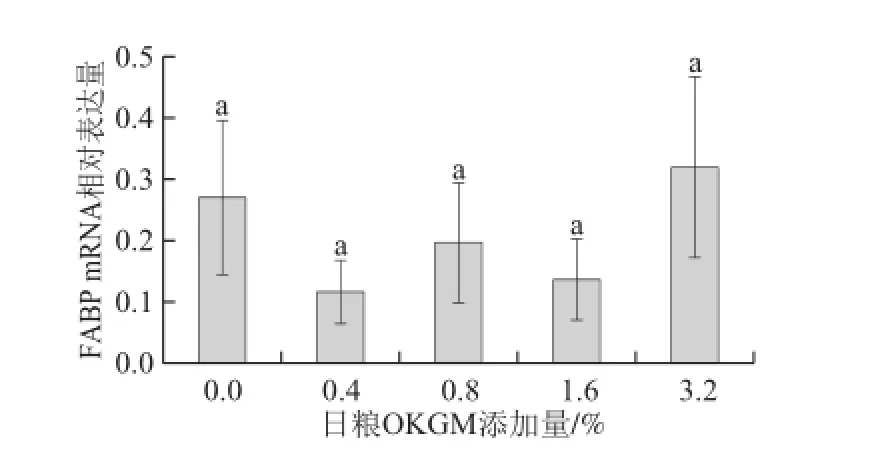
圖5 日糧OKGM對齊口裂腹魚肝胰臟中FABP mRNA表達水平的影響Fig.5 Effect of dietary OKGM on FABP mRNA expression level in liver of Schizothorax prenanti Tchang
由圖5可知,與對照組相比,日糧OKGM添加量對齊口裂腹魚肝胰臟中FABP mRNA表達水平影響均不顯著(P>0.05)。
3 討 論
實驗結果表明,日糧OKGM添加量對齊口裂腹魚背肌和腹肌中的水分和粗灰分含量沒有影響,但能增加齊口裂腹魚腹肌中蛋白質含量,降低腹肌粗脂肪含量,這與向梟等[19]的研究結果基本一致,對齊口裂腹魚肌肉的pH值、失水率、羥脯氨酸和膠原蛋白含量基本沒有影響,魚肌肉的pH值直接影響肌肉組織的系水力和嫩度,當宰后肌肉pH值下降時肌肉組織的蛋白質保持內含水分的能力隨之降低。pH值越高,肌肉的嫩度越好,本實驗中添加OKGM對齊口裂腹魚肌肉中的pH值并沒有造成顯著影響,因此添加OKGM不會降低其持水力,影響其品質,綜上所述,日糧中添加適量的OKGM能一定程度改善齊口裂腹魚肌肉品質。
本實驗中,日糧添加OKGM能升高肌肉和肝胰臟中PPAR-α mRNA表達水平,PPAR-α可以調節若干線粒體脂肪酸催化酶的表達,通過誘導肌肉和肝臟特異性的肉毒堿棕擱酸轉運酶表達而調控脂肪酸向線粒體的轉運,刺激β-氧化過程,降低脂肪酸和甘油三酯合成。
日糧OKGM添加量為0.8%能極顯著降低齊口裂腹魚肌肉中FABP mRNA表達水平,但對齊口裂腹魚肝胰臟中FABP mRNA表達水平的影響不顯著。FABP主要參與細胞內脂肪酸的運輸,可將脂肪酸從細胞膜上運送到甘油三酯和磷脂合成的位點,調節體脂含量,尤其是調節肌間脂肪含量。FABP能夠加強脂肪酸的轉運擴散,調節細胞內脂肪酸的濃度,優先結合轉運脂肪酸,促進甘油三酯的合成。本實驗結果顯示,當OKGM添加量為0.8%時能夠顯著降低齊口裂腹魚肌肉中FABP mRNA表達水平,這與IMF含量變化趨勢一致,這與林亞秋等[20]的研究結果基本一致。而肌間脂肪被認為與肉質風味及口感呈正相關,影響肉質的嫩度、風味、多汁性,特別是肉的嫩度[21]。因此,深入了解動物體脂肪組織的發育和生長機理對于控制多余脂肪沉積有積極意義。
[1] 溫安祥, 曾靜康, 何濤. 齊口裂腹魚肌肉的營養成分分析[J]. 水利漁業, 2003, 23(1): 13-15.
[2] 宋昭彬. 齊口裂腹魚和巖原鯉野生種群遺傳多樣性研究[D]. 成都:四川大學, 2005.
[3] 若木, 王鴻泰, 殷啟云, 等. 齊口裂腹魚人工繁殖的研究[J]. 淡水漁業, 2001, 31(6): 3-5.
[4] 耿毅, 汪開毓, 昊麟, 等. 齊口裂腹魚敗血癥的病原分離與鑒定[J].水利漁業, 2004, 24(4):71-73.
[5] 黃明發, 張盛林. 魔芋膳食纖維保健作用研究進展[J]. 中國食物與營養, 2010(5): 75-77.
[6] 趙占宇. 共軛亞油酸(CLA)對大黃魚脂肪代謝、免疫、肉品質及PPAR基因表達的影響[D]. 杭州: 浙江大學, 2008.
[7] VAMECQ J, LATRUFFE N. Medical significance of peroxisome proliferator-activated receptors[J]. The Lancet, 1999, 354: 141-148.
[8] DESVERGNE B, IJPENBERG A, DEVCHAND P R, et al. The peroxisome proliferators-activated receptors at the cross-road of diet and hormonal signalling[J]. The Journal of Steroid Bioehemistry and Moleeular Biology, 1998, 65(1/6): 65-74.
[9] PANADERO M, VIDAL H, HERRERA E, et al. Nutritionally induced changes in the peroxisome proliferator-activated receptor-alpha gene expression in liver of suckling rats are dependent on insulinaemia[J]. Archives of Biochemistry and Biophysics, 2001, 394(2): 182-188.
[10] 姜延志, 李學偉, 楊光希. 豬L-FABP 基因的克隆、表達特征及遺傳多態性研究[J]. 遺傳學報, 2006, 33(7): 598-606.
[11] 蔣金津, 陳立祥, 鄒增丁. 脂肪酸結合蛋白的研究進展[J]. 畜牧與飼料科學, 2009, 30(2): 6-8.
[12] 吳波, 陳運中, 徐凱, 等. 魔芋葡甘聚糖的氧化改性及其性質研究[J].糧油深加工及食品, 2008(5): 15-16.
[13] 段彪, 向梟, 周興華, 等. 齊口裂腹魚飼料中適宜脂肪需要量的研究[J].動物營養學報, 2007, 19(3): 232-236.
[14] 何雷. 齊口裂腹魚幼魚對蛋白質、脂肪和糖適宜需要量的研究[D].雅安: 四川農業大學, 2008.
[15] 王艷萍, 曾維斌, 廖秋萍, 等. 阿克蘇地區三種食用魚肉質特性的比較分析[J]. 淡水漁業, 2012, 42(3): 81-83.
[16] 任澤林, 李愛杰. 飼料組成對中國對蝦肌肉組織中膠原蛋白、肌原纖維和失水率的影響[J]. 中國水產科學, 1998, 5(2): 40-44.
[17] 李星星. 半咸水暫養羅非魚、草魚改善其肉質的研究[D]. 上海: 上海水產大學, 2006.
[18] PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR[J/OL]. Nucleic Acids Research, 2001, 29(9): e45. doi: 10.1093/nar/29.9.e45.
[19] 向梟, 陳建, 周興華, 等. 黃芪多糖對齊口裂腹魚生長、體組成和免疫指標的影響[J]. 水生生物學報, 2011, 35(2): 291-299.
[20] 林亞秋, 李瑞文, 鄭玉才, 等. 齊口裂腹魚和鯉魚H-FABP基因的克隆及其表達譜[J]. 中國生物化學與分子生物學報, 2012, 27(6): 554-560.
[21] GERBENS F, VERBURG F J, van MOERKERK H T, et al. Associations of heart and adipocyte fatty acid-binding protein gene expression with intramuscular fat content in pigs[J]. Journal of Animal Science, 2001, 79(2): 347-354.
Effect of Dietary Oxidized Konjac Glucomannan on Quality and Lipid Metabolism-Related Gene Expression of Schizothorax prenanti Tchang
ZHOU Cheng, WU Ying-long*, XIANG Shi-qiong, XIA Xiao-jie
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
Objective: To study the effect of dietary oxidized konjac glucomannan (OKGM) on the quality and lipid metabolismrelated gene expression of Schizothorax prenanti Tchang (SPT). Methods: The SPT with body weight of approximately 80 g were randomly divided into five groups which were fed 0 (control group), 0.4%, 0.8%, 1.6% and 3.2% (experimental groups) OKGM for 60 days, respectively. The results showed that compared with the control group, the protein content in abdominal muscle of SPT was significantly increased by adding 1.6% and 3.2% OKGM in the SPT diet (P < 0.05), the fat content in abdominal muscle was significantly reduced by adding 0.8% OKGM in the diet (P < 0.05); however, the amount of OKGM had no significant impact on muscle moisture or crude ash in SPT (P > 0.05). In addition, no significant difference in pH, dehydration rate, hydroxyproline content or collagen content in abdominal muscle of SPT was observed in response to varying amounts of OKGM (P > 0.05). Meanwhile, PPAR-α mRNA expression level in muscle of SPT was significantly increased by dietary addition of 1.6% OKGM (P < 0.05), and a significant increase in this parameter was also observed for liver of SPT administered with 0.8% OKGM (P < 0.05). In contrast, FABP mRNA expression level in muscle of SPT was significantly decreased by dietary addition of 0.8% OKGM (P < 0.01), yet the amount of OKGM had no significant impact on the expression level of FABP mRNA in liver (P > 0.05). Conclusion: The dietary addition of OKGM can improve the quality of SPT and regulate the gene expression associated with lipid metabolism.
oxidized konjac glucomannan; Schizothorax prenanti Tchang; quality; peroxisome proliferator activated receptor-α; fatty acid-binding protein
TS254.1
A
1002-6630(2014)17-0245-05
10.7506/spkx1002-6630-201417047
2013-10-25
四川農業大學“211工程”雙支計劃項目(2014)
周成(1986—),男,碩士研究生,研究方向為功能性食品。E-mail:806888397@qq.com
*通信作者:鄔應龍(1963—),男,教授,博士,研究方向為功能性食品。E-mail:wuyinglong99@163.com

