丹參滴注液生產過程中的內毒素水平監控
李存玉, 支興蕾, 李賀敏, 李紅陽, 鄭云楓, 彭國平*
(1. 南京中醫藥大學藥學院,江蘇 南京210023;2. 江蘇省中藥資源產業化過程協同創新中心,江蘇 南京210023)
中藥注射劑的出現給中藥制劑的發展帶來了新的機遇,但是由于直接進入血液,因此易引起不良反應[1-2],從而導致了安全性出現質疑的后果。而在注射劑臨床使用過程中出現的熱原反應,多是由于在注射劑生產、儲存、運輸、配液使用過程中的細菌污染所導致的,其中以生產過程最易引入污染[3],而目前對注射劑中內毒素檢測僅對終產品檢驗作為產品質量優劣的評判,與藥品生產過程實施過程分析監控的理念相悖[4]。
熱原反應為最常見的中藥注射劑不良反應,主要物質是內毒素,當進入體內的內毒素積量超過人體的耐受量時,便發生熱原反應,臨床表現為體溫升高甚至高熱,伴以發冷、出汗、惡心等,嚴重者甚至導致休克、死亡[5-6]。目前注射劑生產廠家對熱原的檢測主要采用家兔法和鱟試劑法[7],而家兔法在清熱解毒類中藥注射劑的熱原檢查時,由于藥物的清熱藥效作用往往會產生假陰性結果[8]。為了降低成分對內毒素檢測的干擾,本實驗選用鱟試劑法進行內毒素定量測定。
為了體現過程監控的必要性,選擇臨床中用量較大的中藥注射劑丹參滴注液作為研究對象,根據生產工藝中的關鍵環節進行取樣,采用鱟試劑動態濁度法進行內毒素含量測定,分析生產中的易引入內毒素污染的重點環節,并對注射劑生產中的內毒素過程監控的重要性進行分析。
1 材料與方法
1.1 材料 定量檢測用鱟試劑(批號1303270,最低檢測限0.03 EU/mL,規格0.6 mL/Amp,湛江博康海洋生物有限公司),細菌內毒素工作對照品(批號201176,規格100 EU/Amp,中國食品藥品檢定研究院),細菌內毒素檢查用水(批號1303120,規格5 mL/Amp,湛江博康海洋生物有限公司)。丹參滴注液(批號13042603,生產過程取樣及檢測在上海華源安徽錦輝制藥有限公司完成)。
1.2 儀器 BET-72M 細菌內毒素測定儀(天津市天大天發科技有限公司);渦旋混合器(天津市天大天發科技有限公司);高溫烘箱(HJ101-2,常州昊江電熱器材制造有限公司);玻璃試管及玻璃槍頭(250 ℃烘烤除內毒素2 h)。
1.3 方法
1.3.1 丹參滴注液的生產工藝 丹參藥材,加純化水煎煮3 次,煎煮液濾過,濃縮,醇沉2 次至含醇量分別為75%和85%,回收乙醇,加注射用水稀釋,調節pH 至3.0,冷藏,過濾,加針用活性炭,攪拌并煮沸15 min 以上,進行脫炭過濾。取葡萄糖加入針用活性炭,攪拌并煮沸15 min以上,進行脫炭過濾,濾液與煮沸后的丹參提取液合并,調pH 為3.8 ~4.2,加注射用水及適量亞硫酸氫鈉,加針用活性炭,攪拌并煮沸15 min 以上,經鈦棒過濾器循環過濾,再經0.45 μm、0.22 μm 過濾器循環過濾,超濾,灌封,滅菌。
1.3.2 丹參滴注液的生產工藝中的取樣環節 根據丹參滴注液生產工藝中的關鍵環節,確定了取樣點,具體見表1。

表1 取樣點及工藝步驟
1.3.3 動態濁度法檢測細菌內毒素[7,9-11]
1.3.3.1 丹參滴注液內毒素限值 根據2010 年版《中國藥典》附錄ⅩⅢD 細菌內毒素檢查法項下的規定,藥品的細菌內毒素限值(L)按照下式計算:

式中,L 為供試品的細菌內毒素限值,單位為EU/mL;K為人每千克體質量每小時最大可接受的內毒素劑量,注射劑K=5.0 EU/(kg·h),M 為人用每千克體質量每小時的最大供試品劑量,以mL/(kg· h)表示,人均體質量按60 kg 計算。
丹參滴注液成人每小時最大給藥劑量是500 mL,則內毒素最小限值為L =[5.0 EU/(kg·h)×1 h ×60 kg]/500 mL=0.6 EU/mL。
1.3.3.2 標準曲線的可靠性試驗 取細菌內毒素工作標準品,檢查用水1 mL 溶解得100 EU/mL 的內毒素母液,3 000 r/min 渦旋混勻15 min,按照稀釋梯度為4 倍,配制成濃度為2.0、0.5、0.125、0.031 25 EU/mL 的內毒素溶液,各取0.1 mL 分別加到預先加有0.1 mL 鱟試劑溶液的玻璃管內,渦旋混勻,插入BET-72M 細菌內毒素定量檢測儀內進行檢測,其中每一濃度重復3 管,并同時做未加細菌內毒素的陰性對照3 管。按最小二乘法進行回歸運算,則標準曲線為:lgT = 3.024 16 - 0.396 16lgC,r =-0.993 0。其中T 為反應時間,單位為s;C 為內毒素濃度,單位為EU/mL。反應時間在1 104 ~4 044 s 之間,內毒素濃度在2.0 ~0.031 25 EU/mL 時,陰性對照管反應時間大于標準曲線最低濃度的反應時間,且相關系數(r)的絕對值大于0.980,故標準曲線成立。
1.3.3.3 最大有效稀釋倍數 最大有效稀釋倍數是指在試驗中供試品溶液被允許達到稀釋的最大倍數(MVD),在不超過此稀釋倍數的濃度下進行內毒素限值的檢測,其計算公式為:
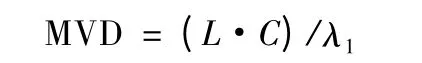
L 為丹參滴注液內毒素限值0.6 EU/mL,C 為藥液質量濃度為1.0 g/mL,λ1為0.031 25 EU/mL,因此,丹參滴注液的最大有效稀釋倍數為19.2 倍。
1.3.3.4 干擾試驗 根據《中國藥典》2010 年版附錄ⅩⅢD 細菌內毒素檢查法中光度法的干擾試驗要求,本試驗中細菌內毒素的回收率在50% ~200%之間,則認為在此試驗條件下丹參滴注液不存在干擾作用。
1.3.3.5 丹參滴注液稀釋倍數 為了提高檢測結果的準確度,本實驗選擇在最大有效稀釋倍數范圍內,分別考察稀釋2、4、8、16 倍時,以回收率為指標分析丹參滴注液對內毒素檢查檢查結果的干擾程度,結果見表2。
從表2 中數據可以看出,丹參滴注液在稀釋倍數為8倍時,檢測結果最為準確,因此本實驗供試品均是以丹參滴注液成品中濃度折算稀釋后,進而采用稀釋8 倍進行測定。

表2 稀釋倍數考察
2 結果
分析圖1 中內毒素濃度的變化趨勢可以看出,丹參滴注液在生產中的內毒素污染比較嚴重,在經過醇沉過濾后(樣品1),內毒素的濃度高于100 EU/mL,這主要是由丹參藥材及所用試劑和環境因素所引起的。

圖1 丹參滴注液生產過程中的內毒素水平
丹參提取液在經過活性炭處理后(樣品2)內毒素濃度有明顯下降,但是從圖1 中可以看出,由于活性炭的飽和吸附,樣品2 中的內毒素濃度仍高于20 EU/mL。
丹參滴注液中所用輔料葡萄糖在配液中可以發現,葡萄糖溶液(樣品3)中內毒素濃度較低,約為5 EU/mL 左右,再經過活性炭處理后濃度降至0.5 EU/mL,說明在溶液中內毒素濃度在一定范圍內時,活性炭可以較好的去除內毒素,去除效果在90%以上。
但是在丹參提取液(樣品2)和葡萄糖溶液(樣品4)進行混合配液時(樣品5),內毒素濃度出現了明顯上升,遠遠高于二者的濃度總和,說明在配液過程中不同溶液的合并容易引起內毒素的突發污染。
合并配液后,采用活性炭處理(樣品6),微孔濾膜過濾(樣品7),內毒素濃度出現明顯下降,但是內毒素濃度均在0.6 EU/mL 左右,與其內毒素濃度限值接近,但是在超濾處理后(樣品8),內毒素濃度低于0.2 EU/mL,在灌封滅菌后(樣品9)雖然出現小幅的增高,但是仍低于0.2 EU/mL,在其安全限度范圍內。
3 討論
目前中藥注射劑中內毒素的檢測均是以終產品的作為對象,缺乏生產保險系數。隨著“藥物是生產出來的,而不是檢驗出來的”概念提出,中藥注射劑在某種程度上應當借鑒這種理念,從傳統的控制成品質量上升至藥品生產過程的有效監控的現代質量管理模式。
通過對丹參滴注液生產環節樣品中的內毒素分析,可以發現內毒素濃度的變化水平,并根據易引起內毒素污染的關鍵環節進行監控,從而有效地控制丹參滴注液的內毒素的量。但是目前較靈敏的內毒素檢測方法為鱟試劑動態濁度法,此方法檢測準確、靈敏,但是樣品的檢測周期較長,且檢測試劑價格偏高。由于是通過生產過程中的取樣分析,取樣容器和保存過程中易受外界環境的影響,無法實現在注射劑生產過程中的密閉環境中的內毒素在線監控。
目前,經文獻分析發現,內毒素根據其結構特征具有類表面活性,在水溶液中呈現出團聚狀態[12-13],經激光照射可呈現出散射特征[14],因此通過對內毒素本身的性質開發注射劑生產過程中的在線監控裝置,通過與注射劑生產管路并聯,才能真正地實現“過程監控”[15]。
[1] 李 榮,蔣英藍,曾敬懷,等. 中藥注射劑發生不良反應的相關性研究進展[J]. 中成藥,2013,35 (5):1059-1061.
[2] 段為鋼,張陸勇. 提高中藥注射劑安全性的技術策略[J].中成藥,2012,34(11):2201-2205.
[3] 吳國琳,張 力,余國友. 中藥注射劑發生不良反應常見原因分析及防范對策[J]. 中國中西醫結合雜志,2008,28(12):1137-1140.
[4] 馬 莉,鄢 丹,曹俊嶺,等. 細菌內毒素定量檢測方法在中藥注射劑質量控制中的應用研究[J]. 中草藥,2009,40(12):2005-2008.
[5] 薛玉強,孫麗紅. 控制大輸液生產過程中的熱原污染體會[J]. 實用醫技雜志,2004,11(7):1352.
[6] 宋曉坤,李利娟. 5 種中藥注射液細菌內毒素檢測方法的建立[J]. 中草藥,2006,37(12):1819-1821.
[7] 國家藥典委員會. 中華人民共和國藥典:2010 年版一部[S]. 北京:中國醫藥科技出版社,2010:附錄ⅩⅢA,ⅩⅢD.
[8] 楊國秀,張同星,彭國平. 清熱解毒類清開靈注射液中熱原檢測方法的比較[J]. 中藥與臨床,2011,2 (2):27-29.
[9] 張玉臣. 清開靈注射液細菌內毒素的檢測[J]. 中成藥,2008,30(2):307-308.
[10] 尹 楠,李紅陽,彭國平,等. 超濾法去除中藥注射液中的細菌內毒素[J]. 中國醫藥工業雜志,2008,39(12):927-929.
[11] 李存玉,鄭云楓,李紅陽,等. 細菌內毒素定量法研究活性炭與超濾法熱原去除工藝[J]. 醫藥導報,2010,29(2):142-144.
[12] Magalh?es P O,Lopes A M,Mazzola P G,et al. Methods of endotoxin removal from biological preparations:a review[J]. J Pharma Sci,2007,10(3):388-404.
[13] Li C Y,Huang X F,Xiao W,et al. Removal of bacterial endotoxin micelle from Salvia injection by composite materials ultrafiltration membrane[J]. Asi j chem,2013,25 (12):6978-6982.
[14] Santos N C,Silva A C,Castanho M A R B,et al. Evaluation of lipopolysaccharide aggregation by light scattering spectroscopy[J]. Chembiochem,2003,4(1):96-100.
[15] 彭國平,鄭云楓,李紅陽. 納米粒徑分析儀用于內毒素檢測的方法:中國,201210196656.6[P]. 2012-06-14.

