黃芪多糖對奶牛口蹄疫疫苗免疫抗體水平的影響
申義君,王 斌,周金偉,沈留紅,余樹民,彭廣能,曹隨忠
四川農業大學動物醫學院 動物疫病與人類健康四川省重點實驗室,雅安 625014
黃芪(Radix astragali)是傳統補氣中藥,具有補氣益衛、托毒生肌、補虛升陽之功效。黃芪多糖(Astragalus polysaccharide,APS)是黃芪中含量最多,免疫活性最強的水溶性復合植物多糖[5,6]。現代藥理研究證明APS 具有增強免疫力,有效的增強細胞和體液免疫反應,對疫苗有輔助增效的作用[5-7]。目前APS 作為免疫增強劑在雞和小鼠方面的應用研究較多,張訓海等[8]研究發現APS 能增強機體的體液免疫,顯著提高新城疫抗體效價。關于APS 是否能提高奶牛對口蹄疫疫苗應答能力,目前還鮮見報道。本試驗通過對奶牛日糧中添加APS 探討APS 對奶牛口蹄疫疫苗免疫抗體水平的影響,以期為天然免疫增強劑的開發和應用提供科學依據。
1 材料與方法
1.1 材料
1.1.1 試驗藥品
APS 購自愛迪森(北京)生物科技有限公司(批號:1208041,純度:每1 g 含黃芪多糖以葡萄糖計為564 mg;每1 g 黃芪多糖粉相當于原生藥7 g),為黃色精細粉末。口蹄疫病毒O 型、亞洲I 型二價滅活苗購自新疆天康畜牧生物技術股份有限公司(生產批號:2012007)。
1.1.2 試驗動物
年齡、胎次和體重相近的健康荷斯坦奶牛40頭,由四川雅安滎經縣新世紀生態乳業有限公司提供。
1.1.3 儀器與試劑
Varioskan Flash 全波長多功能酶標儀(美國),超純水儀(型號MILLPAK20,美國),8 道移液槍。口蹄疫亞洲Ⅰ型抗體液相阻斷ELISA 檢測試劑盒(批號:2012111302);口蹄疫O 型抗體液相阻斷ELISA 檢測試劑盒(批號:2012111601),以上試劑盒均購自中國農業科學院蘭州獸醫研究所。
1.2 方法
1.2.1 動物分組與處理
(3)結果:將脫氧烏頭堿水溶液加熱不同時間的樣品進行HPLC檢測,色譜圖進行對比,篩選出變化較為明顯的色譜圖(圖6)進行分析。
將40 頭年齡、胎次和體重相近的健康荷斯坦奶牛隨機分為4 組(每組10 頭),分別為空白對照組、APS 低劑量(5 g/頭·d)、中劑量(10 g/頭·d)、高劑量(15 g/頭·d)組。在常規飼養的基礎上,3個試驗組分別將5、10、15 g 劑量的APS 粉拌入精料飼喂,每天1 次,連續給藥7 d;空白對照組按照同樣方法飼喂。給藥第4 d 所有奶牛進行口蹄疫免疫,每頭注射疫苗2 mL。
1.2.2 飼養管理
各組試驗奶牛的飼養管理條件相同,在開放式固定槽位栓系飼養,統一定時定量定質飼喂,自由飲水。
1.2.3 血樣采集
分別于給藥第0、4、18、32、46 d 和104 d 上午9∶00~10∶00 對所有試驗奶牛進行尾根靜脈采血,分離血清,-20 ℃保存待檢。
1.2.4 抗體檢測及方法
采用液相阻斷ELISA 試劑盒分別檢測第0、4、18、32、46 和104 d 時血清中口蹄疫抗體水平。具體檢測方法和步驟參照試劑盒說明書進行。嚴格按照試劑盒檢測方法和步驟進行具體步驟如下:1.包被ELISA 板,充分混勻濕盒中室溫過夜;2.抗原抗體反應,血清1∶4 開始做2 倍連續稀釋至1∶512,同時稀釋陰陽性對照血清,之后每孔中加入稀釋好的抗原,震蕩混勻,封板,4 ℃過夜;3.洗滌ELISA 板后將抗原抗體反應中對應各孔中的血清病毒混合物按次序轉移至ELISA 板上,37 ℃溫育1 h;4.洗滌ELISA板,將稀釋好的豚鼠抗口蹄疫病毒血清加入到ELISA 板中,37 ℃溫育1 h;5.洗滌ELISA 板,將稀釋好的兔抗豚鼠酶結合物加入到ELISA 板中37 ℃溫育1 h;6.洗滌ELISA 板,加入底物37 ℃溫育15 min 后加入終止液,立即在492 nm 波長下讀取吸光值。
1.2.5 檢測結果的判定
嚴格按液相阻斷ELISA 試劑盒說明書進行。被檢血清稀釋孔D492nm的吸光值大于臨界值的孔為陰性孔,小于或等于臨界值的孔為陽性孔,陽性孔在D492nm的吸光值等于臨界值所對應的稀釋度為該份血清的抗體滴度。若臨界值在兩個滴度之間,抗體滴度則取中間值;抗體效價≥1∶l28,保護率99%以上;抗體效價在1∶22~1∶90,保護率50%;抗體效價≤1∶16,不保護。
1.3 數據統計
試驗數據采用SPSS19.0 軟件應用one-way ANOVA 選擇LSD 法進行統計處理,結果用均值±標準差(D)表示,以P<0.05 作為差異顯著性判斷標準。
2 結果與分析
2.1 黃芪多糖對亞洲Ⅰ型口蹄疫抗體水平的影響
試驗初期各喂藥組與對照組亞洲Ⅰ型口蹄疫抗體水平差異不顯著(P >0.05);接種疫苗后各組奶牛口蹄疫的抗體水平均增高,各組的保護率均達到99%。對照組抗體水平先達到峰值,而此時喂藥組抗體水平仍有上升趨勢,較晚到達峰值。各喂藥組的抗體水平相對與對照組抗體水平下降趨勢較緩和,且試驗第25 d 時各喂藥組亞洲Ⅰ型抗體水平已高于對照組。試驗第32~104 d 各喂藥組亞洲Ⅰ型口蹄疫抗體效價顯著的高于對照組(P<0.05),其中低劑量組高于對照組1個滴度左右,中劑量組和高劑量組高于對照組1個滴度以上;在46 d 時對照組保護率已降低到80%。結果表明,APS 能延長亞洲Ⅰ型口蹄疫的抗體效價的平臺期,而在衰退期使亞洲Ⅰ型口蹄疫的抗體保持在高位水平,從而增強口蹄疫疫苗的保護力度。
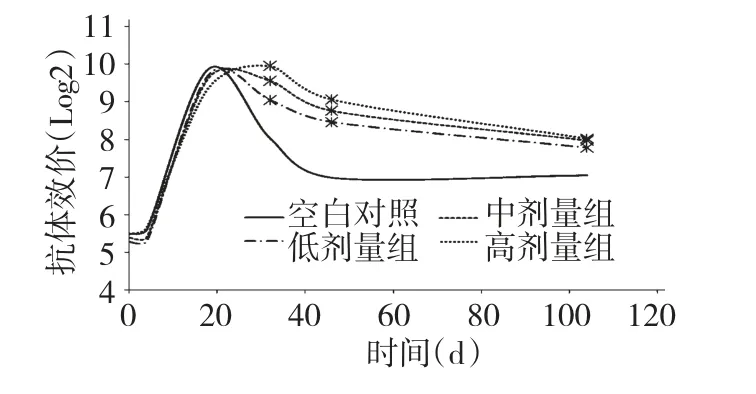
圖1 APS 對血清FMD 抗體效價的影響(亞洲Ⅰ型)Fig.1 Effects of APS on serum FMD antibody titer (type Asia I)
2.2 黃芪多糖對O 型口蹄疫抗體水平的影響
試驗初期各喂藥組與對照組O 型口蹄疫抗體水平差異不顯著(P >0.05);接種疫苗后各組奶牛O 型口蹄疫抗體水平均增高,各組的保護率都達到99%。試驗第32~104 d 時,APS 中、高劑量組的O型口蹄疫的抗體效價顯著高于空白對照組(P<0.05),且在此時間段內APS 中、高劑量組O 型抗體水平高于對照組一個滴度以上,而APS 低劑量組僅在第32~46 d O 型口蹄疫的抗體效價顯著高于空白對照組(P<0.05)其中在第46 d 時APS 低劑量組O 型口蹄疫抗體水平高于對照組一個滴度以上。結果表明,APS 能夠延長O 型口蹄疫抗體效價的平臺期,有效的延緩抗體效價進入衰退期。
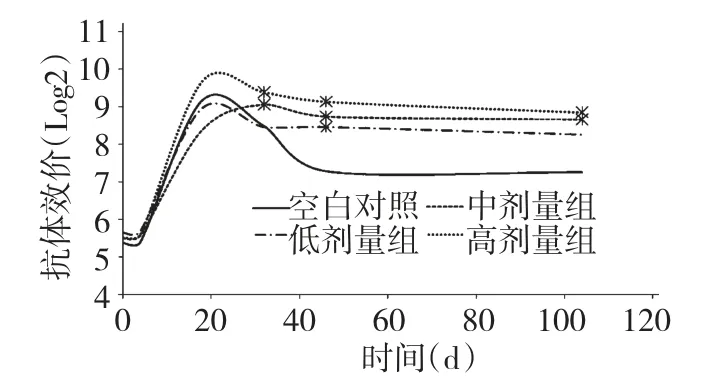
圖3 APS 對血清FMD 抗體效價的影響(O 型)Fig.3 Effects of APS on serum FMD antibody titer (type O)
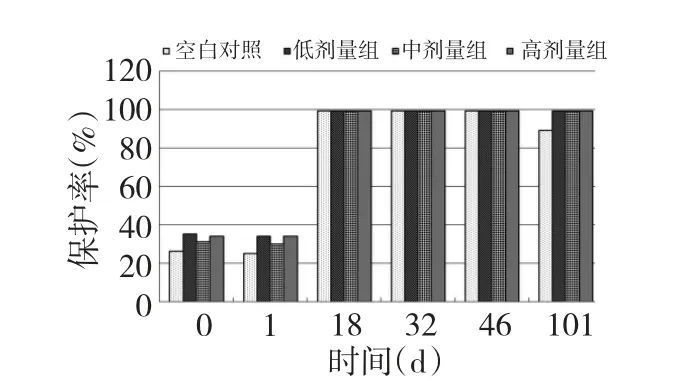
圖4 APS 對FMD 保護率的影響(O 型)Fig.4 Effects of APS on protection rates against FMD (type O)
3 討論
免疫增強劑能增強機體抗病力降低機體對有害微生物的易感性以及防止動物發生免疫抑制。大量藥理及臨床研究表明,多糖類化合物是良好的免疫調節劑,尤其是植物(板藍根、玉米花粉、黃芪、香菇、海藻等)多糖具有治療的廣譜性及相對低毒性,它能激活免疫細胞,提高機體免疫功能,其作用具有多途徑、多環節、多靶點等特點,適合作為免疫增強劑[3]。
APS 能促進T 細胞轉化和增殖,激發T 淋巴細胞和B 淋巴細胞的功能,使脾內效應B 細胞增生,促進抗體的合成,增強體液免疫[8]。項杰等[9]發現黃芪多糖能夠促進B 細胞的活化、增殖、產生抗體提高小鼠血清抗體滴度,增強宿主的體液免疫來保護宿主抵抗胞內菌的感染。邱妍等[10]通過對雛雞應用一定劑量的黃芪多糖,能顯著提高新城疫疫苗和雞新城疫和雞傳染性支氣管炎二聯苗的免疫效果。王學斌等[6]研究發現黃芪多糖粉劑、黃芪多糖注射液對雛雞均有較好的免疫增強作用,均能提高雛雞體內新城疫抗體效價。
體液免疫是機體抗御傳染病的主要因素之一,在體內可發揮多種免疫功能,是機體免疫系統的重要組成部分。抗體滴度的高低直接反應機體的體液免疫狀態,是評估其免疫狀況的重要指標,因此本試驗采用檢測抗體滴度作為評價黃芪多糖增強口蹄疫疫苗免疫效果的指標。免疫增強劑能夠促進抗體的產生,延緩抗體的下降或消失。奶牛接種口蹄疫疫苗后發揮免疫作用的有T 細胞、B 細胞,這些免疫細胞受到抗原刺激后能分化增殖,發生特異性免疫應答,產生抗體。從本實驗結果可以看出APS 能減緩抗體水平增高的速度,延長增高的時間、提高增幅、延緩抗體下降,延長口蹄疫抗體的平臺期,在衰退期使口蹄疫的抗體保持在較高滴度水平,喂藥組口蹄疫抗體滴度比對照組高1個滴度以上,且與用藥的劑量有量效關系。這與張紅英等[11]報道的山藥多糖免疫增強作用主要是在免疫的中后期,且一直持續到試驗結束結果相似。APS 除具有免疫增強作用外,還可能與試驗組從免疫前4 d 就開始使用黃芪多糖,提高了機體非特異性免疫,降低了接種時的應激反應有關。因此在進行奶牛口蹄疫疫苗免疫接種前后,配合使用黃芪多糖飼喂奶牛能提高口蹄疫抗體滴度,延長抗體維持時間并且群體效價水平整齊,提高機體免疫功能,達到增強疫苗免疫的效果。
1 Wu HR(吳煥榮),Zhao QX(趙全興),Liu FN(劉方娜),et al.Effect of different immunostimulants on the Layers with NDV vaccine.China Poultry(中國家禽),2012,34(3):60-63.
2 Zhu ZY(朱志盈),Miao DN(繆德年),Jiang FM(姜法銘),et al.Enhancement of bursin on inactivated foot-andmouth disease vaccine in piglets.Veterin Sci China (中國獸醫科學),2007,37:150-154.
3 Shi YX(師永霞).Immune synergies research of APS.Gansu Agricultural University(甘肅農業大學),MSc.2008.
4 Saifuding ABL(賽福丁·阿不拉),Wang JM(王君敏),Mikeremu SYBZT(米克熱木·沙衣布扎提),et al.Progress on antivirus and immune enhancement activities of polysaccharides and sulfated derivatives.Nat Prod Res Dev (天然產物研究與開發),2013,25:572-575.
5 Chen GH(陳國輝),Huang WF(黃文鳳).Progress in pharmacological effects of compositions of Astragalus membranaceus.Chin J New Drugs(中國新藥雜志),2008,17:1482-1485.
6 Wang XB(王學斌),Chen GY(陳功義),Wei ZY(魏戰勇),et al.Comparison on effect of Astragalus plysaccnaride powders and injects on immune function and growth of chickens.China Poultry(中國家禽),2007,29(3):21-23.
7 Wei X,Zhang J,Li J,et al.Astragalus mongholicus and Polygonum multiflorum's protective function against cyclophosphamide inhibitory effect on thymus.Am J Chin Med,2004,32:669-680.
8 Zhang XH(張訓海),Wang DY(王德云),HuYL(胡元亮),et al.Immunologic enhancement of Astragalus polysaccharide(APS)on the humoral immunity of chicken.Chin J Vet Sci(中國獸醫學報),2009,29:312-334.
9 Xiang J(項杰),Wang YB(王育斌),Xu T(徐濤),et al.Effects of astragalus mongholicus polysaccharide on host resistance in mice infected with listeria monocytohenes.Med J Wuhan Univ(武漢大學學報,醫學版),2007,28:741-743.
10 Li SP,Zhao XJ,Wang J.Synergy of A stragalus polysaccharides and probiotics (Lactobacillus and Bacillus cereus)on immunity and intestinal microbiota in chicks.Poult Sci,2009,88:519-525.
11 Zhang HY(張紅英),Wang XB(王學兵),Cui BA(崔保安),et al.Effects of Chinese Yam polysaccharide on antibody and T lymphocytes subpopulations in the immune response to PRRSV killed vaccine.Acta Agriculturae Boreali-Sinica(華北農學報),2010,25:236-238.

