Caveolae 在高糖誘導的大鼠腎小球系膜細胞細胞外基質合成中的作用*
盧圣霞, 劉元濤, 孔 峰, 杜月娟, 劉 曄, 傅余芹△
(山東大學第二醫院1腎臟內科,2內分泌科,3中心實驗室 山東 濟南250033;4濟南市中心醫院腎臟內科,山東 濟南250013)
糖尿病腎病(diabetic nephropathy,DN)是糖尿病最主要的微血管并發癥之一,以腎小球細胞外基質(extracellular matrix,ECM)過度沉積為其顯著的病理特點,成為導致終末期腎病最主要的原因[1-2]。高血糖是導致DN 發病的一個主要因素,它通過激活多條信號通路,上調纖維連接蛋白(fibronectin,FN)及I型膠原(collagen type I,Col I)的表達,最終導致ECM積聚[3-4]。Caveolae 是近年來發現的一種富含膽固醇(cholesterol,Chol)及磷脂的胞膜小凹結構,caveolin是其標志性結構蛋白,廣泛存在于血管內皮細胞、平滑肌細胞、成纖維細胞及上皮細胞等多種細胞的細胞膜上。研究表明,caveolae 為多種信號分子提供了一個聚集的場所,對于細胞增殖、分化、凋亡等多種功能具有重要調控作用[5-6]。腎小球系膜細胞(mesangial cells,MCs)是一種類平滑肌樣細胞,其細胞膜含有caveolae[6]。既往研究發現,caveolae 在轉化生長因子β(transforming growth factor β,TGF-β)誘導的內皮細胞ECM 分泌過程中具有重要作用[7],而高糖環境下caveolae 在腎小球系膜細胞ECM 合成中的作用目前尚不明確。本研究旨在探討caveolae 在高糖誘導的腎小球系膜細胞ECM 合成中的作用與機制。
材 料 和 方 法
1 材料
大鼠腎小球系膜細胞(由山東大學醫學院易凡教授惠贈);DMEM 培養基和新生胎牛血清(fetal bovine serum,FBS)均購自Gibco;小凹蛋白1(caveolin-1,Cav-1)抗體購自BD;磷酸化的小凹蛋白1(phosphorylated caveolin-1 on tyrosine 14,p-Cav-1-Y14)抗體購自CST;Col I 抗體購自Abcam;β-actin 抗體、辣根過氧化物酶標記的兔Ⅱ抗和鼠Ⅱ抗均購自北京中杉金橋公司;FN ELISA 試劑盒購自RD。Real-time PCR Ultra SYBR mixture 試劑盒購自大連寶生物工程總公司;RIPA、PMSF 和BCA 試劑盒均購自江蘇碧云天生物技術研究所。
2 方法
2.1 大鼠腎小球系膜細胞培養 MCs 以(0.5 ~1)×106接種于DMEM 完全培養基中(含10%胎牛血清、1 ×105U/L 青霉素、100 mg/L 鏈霉素和2 mmol/L L-谷氨酰胺),置于37 ℃、5%CO2細胞培養箱中培養,2 ~3 d 換液,待細胞長至90% 培養皿時用0.25%胰蛋白酶消化傳代。
2.2 細胞分組及處理 培養細胞待其貼壁融合70% ~80%后用無血清低糖DMEM 培養基同步化24 h,根據實驗設計進行如下分組及處理:(1)正常糖(normal glucose,NG)組(5.5 mmol/L 葡萄糖+24.5 mmol/L 甘露醇);(2)高糖(high glucose,HG)HG 組(30 mmol/L 葡萄糖);各組繼續培養細胞0、12、24 和48 h。為觀察高糖誘導Cav-1 磷酸化的劑量效應,不同濃度的葡萄糖(5.5、16.7 和30.0 mmol/L)分別處理細胞1 h,各組滲透壓均用甘露醇調整至30.0 mmol/L 以避免滲透壓不同對實驗結果造成的干擾(5.5 mmol/L 葡萄糖+24.5 mmol/L 甘露醇;16.7 mmol/L 葡萄糖+13.3 mmol/L 甘露醇)。為觀察高糖誘導Cav-1 磷酸化的時間效應,選取作用效果最明顯的30.0 mmol/L 葡萄糖短時處理細胞0~4 h。同步化的細胞經甲基-β-環糊精(methyl-βcyclodextrin,β-MCD;5 mmol/L)預處理1 h 后再分為2 組:β-MCD+HG 組(5 mmol/L β-MCD + 30 mmol/L 葡萄糖);β-MCD+HG+Chol 組(5 mmol/L β-MCD+ 30 mmol/L 葡萄糖+ 15 mg /L Chol),各組繼續培養細胞1、12、24 和48 h,按照各處理組指定時間收集細胞及上清,進行分析。
2.3 實時定量PCR 以TRIzol 抽提處理后的細胞總RNA,逆轉錄為cDNA,采用SYBR Green 嵌合熒光進行實時定量PCR,反應體系25 μL,上、下游引物均由大連寶生物工程有限公司(TaKaRa)設計合成(表1),反應條件如下:預變性:95 ℃,30 s;95 ℃,5 s;55℃~60 ℃,34 s;同時獲取熒光,共40 個循環,每組重復6 次,反應結束后行產物的熔解曲線分析,以GAPDH 為內參照進行結果分析。
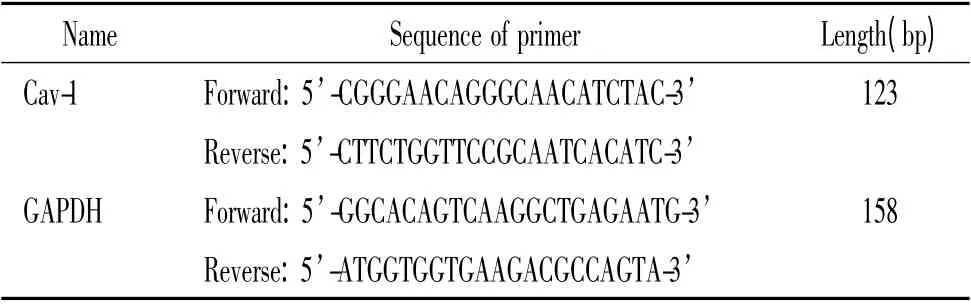
表1 實時定量PCR 的引物序列Table 1. Real-time PCR primer sequences
2.4 ELISA 法檢測細胞上清液中FN 蛋白含量 取不同處理因素作用0、12、24 和48 h 的細胞上清液,6 000 r/min 4 ℃離心10 min,收集上清,每組重復3次,后續操作按ELISA 試劑盒說明書進行,在酶標儀450 nm 波長處,以空白對照孔調零,直接測定其吸光度(A),并由標準曲線公式換算成各蛋白的濃度值。
2.5 Western blotting 細胞處理不同時點后,棄去培養基,用預冷PBS 洗3 遍,加入細胞裂解液,提取細胞蛋白。BCA 法檢測蛋白濃度。等量細胞蛋白(60 μg)加5 ×loading buffer 煮沸變性10 min,10%SDS 聚丙烯酰胺凝膠電泳后轉至NC 膜,5%脫脂牛奶封閉1 h,Ⅰ抗[Cav-1(1 ∶2 000);p-Cav-1-Y14(1∶1 000);Col I(1∶1 000);β-actin (1∶1 000)]4 ℃孵育過夜,NC 膜用TBST 緩沖液洗3 遍后,再與辣根過氧化物酶標記的Ⅱ抗室溫孵育1 h 后顯影。免疫復合物用ECL 方法檢測,電泳條帶用ImageJ 軟件分析灰度值。
3 統計學處理
使用SPSS 17.0 軟件進行統計分析,所有數據以均數±標準差(mean ±SD)表示,組間比較及顯著性檢驗采用One-way ANOVA 檢驗,以P <0.05 為差異有統計學意義。
結 果
1 高糖對系膜細胞FN 和Col I 蛋白表達的影響
與NG 組相比,高糖培養24 h 細胞FN 濃度顯著增加(P <0.05),48 h 達到高峰,見圖1。與HG 0 h組相比,高糖培養12 h 細胞Col I 蛋白表達明顯增多(P <0.05),48 h 達到高峰,見圖2。
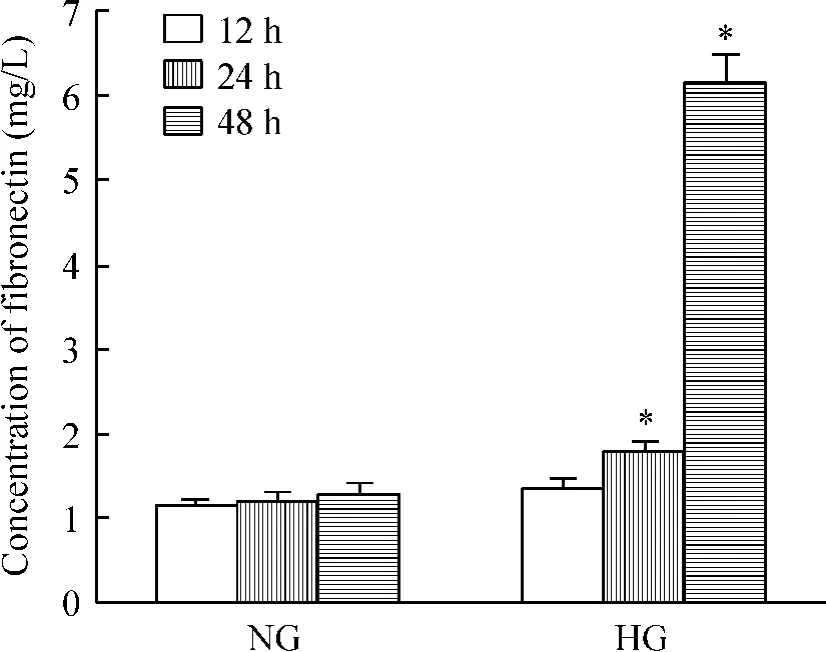
Figure 1. Quantitative analysis of the FN level induced by high glucose (30 mmol/L). Mean ±SD. n =3. * P <0.05 vs NG group.圖1 高糖(30 mmol/L)對系膜細胞FN 蛋白水平的定量分析
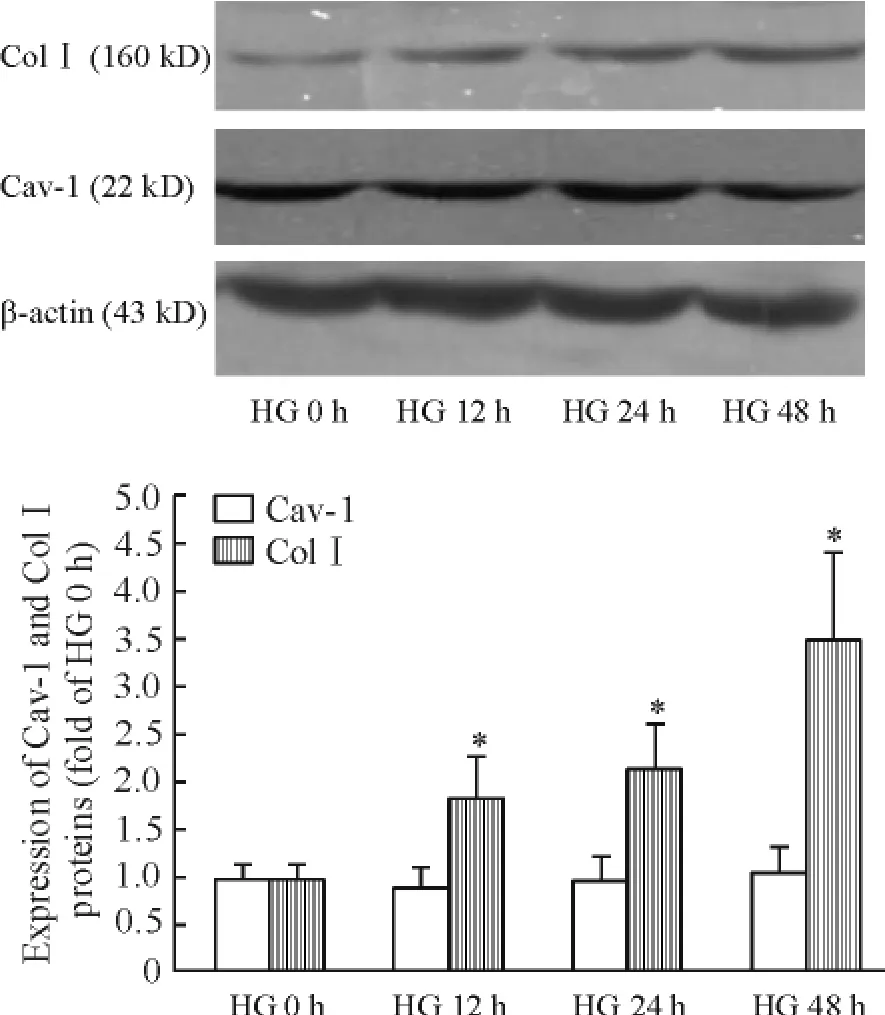
Figure 2. The effect of high glucose (30 mmol/L)on expression of Cav-1 and Col I. Mean ± SD. n =3. * P <0.05 vs HG 0 h group.圖2 高糖(30 mmol/L)對系膜細胞Col I 和Cav-1 蛋白表達的影響
2 高糖對系膜細胞Cav-1 mRNA 及蛋白表達的影響
高糖處理系膜細胞,各時點Cav-1 mRNA 及蛋白表達量較HG 0 h 組差異均無統計學意義(均P >0.05),見圖2、3。
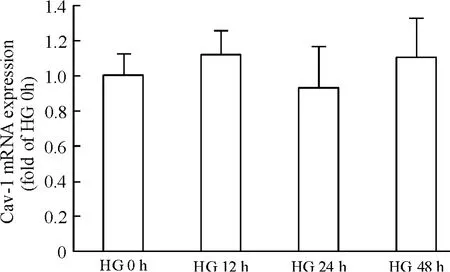
Figure 3. The effect of high glucose (30 mmol/L)on Cav-1 mRNA expression.Mean±SD.n=3.圖3 高糖(30 mmol/L)對系膜細胞Cav-1 mRNA 表達的影響
3 高糖對腎小球系膜細胞Cav-1 磷酸化水平的影響
以p-Cav-1-Y14 與Cav-1 灰度比值作為Cav-1 磷酸化水平的指標進行定量分析,結果顯示:不同濃度(5.5、16.7 和30 mmol/L)葡萄糖處理MCs,Cav-1 磷酸化水平呈現濃度依賴性升高(P <0.01),見圖4;30 mmol/L 高糖處理后,Cav-1 磷酸化水平于0.5 h即可出現升高,1 h 達到高峰,之后磷酸化水平逐漸下降(P <0.01),見圖5。
4 甲基-β-環糊精及膽固醇對腎小球系膜細胞Cav-1 磷酸化水平的影響
與單純HG(30 mmol/L)組相比,β-MCD(預處理1 h)+HG(30 mmol/L,1 h)組Cav-1 磷酸化水平明顯下降(P <0.01);而β-MCD + HG + Chol(15 mg/L)組Cav-1 磷酸化水平較β-MCD +HG 組顯著升高(P <0.01),見圖6。
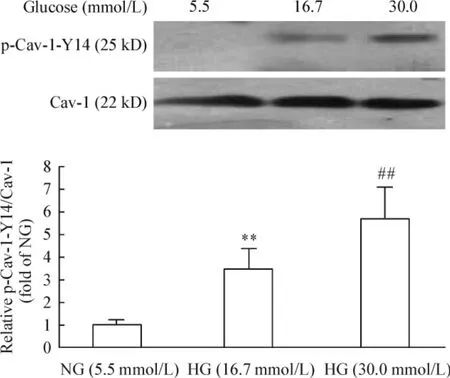
Figure 4. Phosphorylation of Cav-1 induced by high glucose at different concentrations.Mean±SD.n=3. **P <0.01 vs NG (5.5 mmol/L)group;##P <0.01 vs HG (16.7 mmol/L)group.圖4 高糖誘導Cav-1 磷酸化的劑量效應
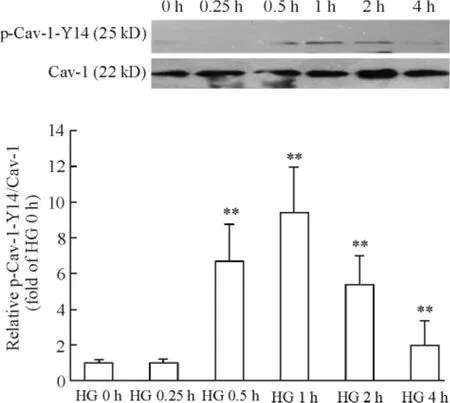
Figure 5. Phosphorylation of Cav-1 induced by high glucose(30 mmol/L)at different time points. Mean ± SD. n =3.**P <0.01 vs HG 0 h group.圖5 高糖(30 mmol/L)誘導Cav-1 磷酸化的時間效應
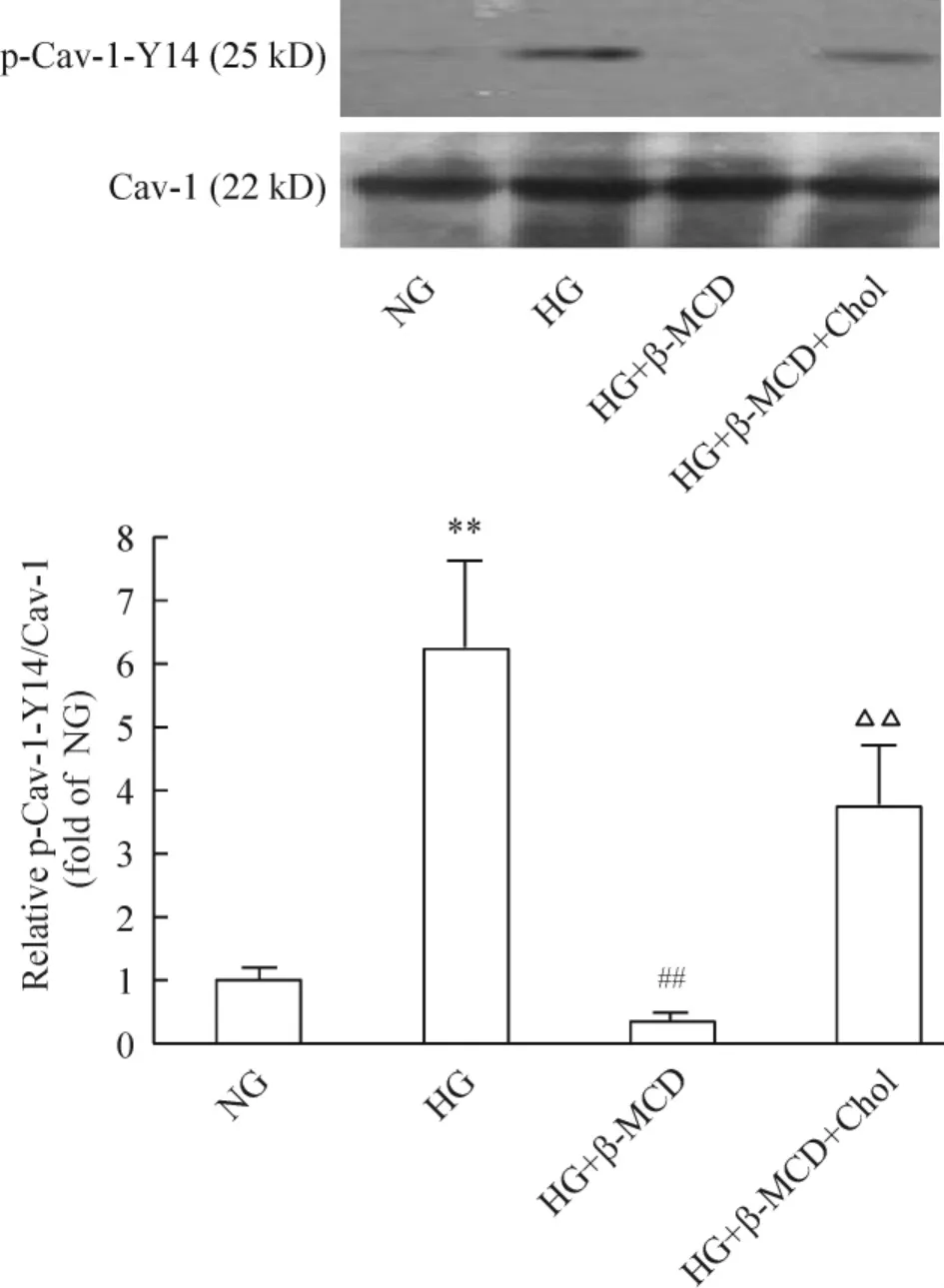
Figure 6. Effects of β-MCD(5 mmol/L)and cholesterol(15 mg/L)on phosphorylation of Cav-1.Mean±SD.n=3. **P <0.01 vs NG group;##P <0.01 vs HG group;△△P <0.01 vs HG+β-MCD group.圖6 甲基-β-環糊精(5 mmol/L)及膽固醇(15 mg/L)對系膜細胞Cav-1 磷酸化的影響
5 甲基-β-MCD 及膽固醇對細胞FN 及Col-1 蛋白表達的影響
與單純HG 組相比,HG +β-MCD 組各時點FN的濃度均顯著降低(均P <0.05),見圖7;與HG+β-MCD 組相比,HG+β-MCD+ Chol 組各時點FN 濃度均明顯升高(均P <0.05),見圖7。各時點Col-1 蛋白表達量在HG、HG + β-MCD 及HG + β-MCD +Chol 組差異無統計學意義(均P >0.05),圖8 為各組處理細胞48 h 后的結果。
討 論
Caveolae 是具有燒瓶底型凹陷形態的特殊脂筏結構,廣泛存在于血管內皮細胞、平滑肌細胞、成纖維細胞及上皮細胞等多種細胞的細胞膜上[6]。在腎臟,caveolae 主要存在于腎小球血管內皮細胞及系膜細胞[5-6]。Cav-1 是caveolae 的標志性蛋白,對維持caveolae 結構和功能的完整起關鍵作用[8]。目前已知,caveolae 參與細胞分化、增殖、腫瘤、炎癥、衰老等多種病理生理過程,對疾病的發生、發展及轉歸有重要的意義[9]。既往研究發現,糖尿病大鼠腎小球血管內皮細胞Cav-1 表達明顯升高,而Cav-1 表達升高可抑制eNOS 活性,使NO 合成減少[10],這可能是糖尿病腎病的重要發病機制之一。至于糖尿病狀態下,腎小球系膜細胞Cav-1 表達的變化及其在糖尿病腎病中的病理意義目前尚不清楚。本研究發現,高糖培養的大鼠系膜細胞FN 和Col I mRNA 及蛋白水平明顯升高,這與既往的研究結果一致[11]。為探討caveolae在高糖誘導的系膜細胞ECM合成中的作用,我們觀察了高糖對Cav-1 表達的影響,結果顯示高糖對Cav-1 的mRNA 及蛋白表達無明顯影響。
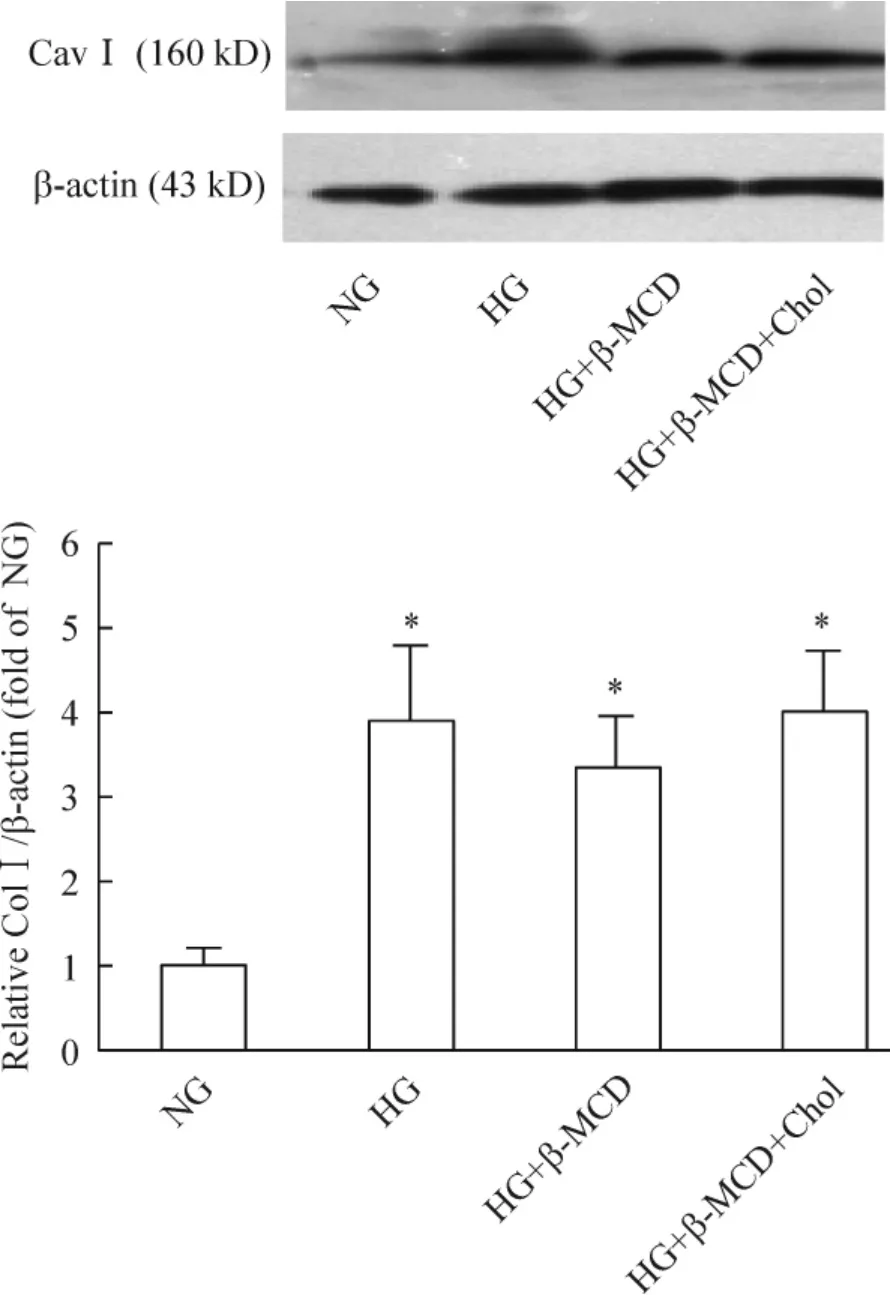
Figure 8. The effect of β-MCD (5 mmol/L)and cholesterol (15 mg/L)on Col I expression. Mean ±SD. n =3. * P <0.05 vs NG group.圖8 甲基-β-環糊精(5 mmol/L)及膽固醇(15 mg/L)對系膜細胞Col-1 表達的影響
最初,Cav-1 是以其酪氨酸磷酸化的形式,作為Src 激酶的磷酸化底物被首次發現[12]。業已證實,位于Cav-1 的N 末端酪氨酸14 位點是其主要磷酸化位點[13]。除Src 之外,多種細胞因子(如血小板衍生因子、上皮生長因子、胰島素等)也能夠引起該位點的磷酸化。p-Cav-1-Y14 被認為是Cav-1 的活化形式,可與多種信號蛋白交聯,實現信號的跨膜轉導[14-15]。本研究發現,高糖狀態下Cav-1 蛋白表達雖無變化,但其磷酸化水平顯著升高,且與FN 表達密切相關。
Caveolae 結構中富含膽固醇,而膽固醇對維持caveolae 結構和功能是必需的。β-MCD 是一種細胞外膽固醇受體,對膽固醇有很高的親和力,可以去除胞膜中的膽固醇,特異性干擾caveolae 形成而不對胞膜的完整性造成影響[16-17]。本實驗發現,β-MCD 預處理可顯著抑制高糖誘導的Cav-1 磷酸化,同時導致FN 合成減少,但對高糖誘導的Col I 表達無顯著影響。以上結果提示,高糖誘導的Cav-1 磷酸化有賴于caveolae 結構的完整,而磷酸化的Cav-1 可能介導了高糖誘導的FN 合成,但對高糖誘導的Col I 合成無介導作用。以上結果提示高糖通過多種信號途徑對不同細胞外基質的合成進行調控。
總之,本研究結果提示caveolae 及其結構蛋白Cav-1 在高糖誘導的腎小球系膜細胞FN 的合成過程中具有重要調節作用。關于高糖狀態下Cav-1 磷酸化的發生機制以及磷酸化的Cav-1 如何調節FN 合成尚待進一步研究。
[1] 周 群,宋菊敏,陳衛星,等.糖尿病性微血管病的臨床病理生理[J]. 中國病理生理雜志,2007,23(2):399-402.
[2] 方華偉,傅玉芹,韓亞麗,等.組織蛋白酶B 和胱抑素C在糖尿病腎病大鼠腎組織中的表達及意義[J].中國病理生理雜志,2009,25(7):1399-1403.
[3] Hayashi K,Wakino S,Kanda T,et al. Molecular mechanisms and therapeutic strategies of chronic renal injury:role of Rho-kinase in the development of renal injury[J].Pharmacol Sci,2006,100(1):29-33.
[4] Zeng L,Xu H,Chew TL,et al.HMG CoA reductase inhibition modulates VEGF-induced endothelial cell hyperpermeability by preventing RhoA activation and myosin regulatory light chain phosphorylation[J]. FASEB J,2005,19(13):1845-1847.
[5] Percy CJ,Pat BK,Healy H,et al.Phosphorylation of caveolin-1 is anti-apoptotic and promotes cell attachment during oxidative stress of kidney cells[J]. Pathology,2008,40(7):694-701.
[6] Tamai O,Oka N,Kikuchi T,et al. Caveolae in mesangial cells and caveolin expression in mesangial proliferative glomerulonephritis[J].Kidney Int,2001,59(2):471-480.
[7] Wang XM,Zhang Y,Kim HP,et al. Caveolin-1:a critical regulator of lung fibrosis in idiopathic pulmonary fibrosis[J].J Exp Med,2006,203(13):2895-2906.
[8] Couet J,Li S,Okamoto T,et al. Identification of peptide and protein ligands for the caveolin-scaffolding domain.Implications for the interaction of caveolin with caveolae-associated proteins[J]. J Biol Chem,1997,272(10):6525-6533.
[9] Schwencke C,Braun-Dullaeus RC,Wunderlish C,et al.caveolae and caveolin in transmembrane signaling:implications for human disease[J]. Cardiovasc Res,2006,70(1):42-49.
[10]Chen Z,Bakhshi FR,Shajahan AN,et al. Nitric oxide-dependent Src activation and resultant caveolin-1 phosphorylation promote eNOS/caveolin-1 binding and eNOS inhibition[J].Mol Biol Cell,2012,23(7):1388-1398.
[11]Marks JB,Raskin P.Nephropathy and hypertension in diabetes[J].Med Clin North Am,1998,82(4):877-907.
[12]Bharat J,Michele B,Scott SS,et al.Phosphocaveolin-1 is a mechanotransducer that induces caveola biogenesis via Egr1 transcriptional regulation[J].J Cell Biol,2012,199(3):425-435.
[13]Li S,Seitz R,Lisanti MP.Phosphorylation of caveolin by Src tyrosine kinases:the α-isoform of caveolin is selectively phosphorylated by v-Src in vivo[J]. J Biol Chem,1996,271(7):3863-3868.
[14]Sargiacomo M,Sudol M,Tang ZL,et al. Signal transducing molecules and glycosylphosphatidylinositol-linked proteins form a caveolin-rich insoluble complex in MDCK cells[J].J Cell Biol,1994,126(1):111-126.
[15]Lisanti MP,Scherer PE,Vidugiriene J,et al. Characterization of caveolin-rich membrane domains isolated from an endothelial-rich source:implications for human disease[J].J Cell Biol,1994,126(1):111-126.
[16]Chintagari NR,Jin N,Wang P,et al.Effect of cholesterol depletion on exocytosis of alveolar typeⅡcells[J]. Am J Respir Cell Mol Biol,2006,34(6):677-687.
[17]蕈 麗,廖端芳.Caveolae/caveolin-1 與細胞膽固醇轉運[J].中國病理生理雜志,2007,10(4):2067-2070.

