白云石煅燒/加壓碳酸化循環捕獲CO2實驗研究
陳惠超 趙長遂
(東南大學能源與環境學院,南京 210096)
(東南大學能源熱轉換及其過程測控教育部重點實驗室,南京 210096)
目前,世界各國在大規模減排、分離CO2技術方面正進行著廣泛的研究.然而,經濟性是決定CO2分離技術大規模應用的重要因素之一.石灰石、白云石等吸收劑以其分布廣泛、價格低廉,其主要成分碳酸鈣的分解與合成具有可逆性,能實現循環利用捕獲CO2等優勢,引起學者們的廣泛關注.運用鈣基吸收劑在雙流化床進行循環煅燒/碳酸化反應是捕集CO2的重要工藝,具體過程是:石灰石送入流化床煅燒爐內煅燒,形成的CaO送入增壓流化床碳酸化爐中捕捉CO2,從而使煙氣中CO2的排放量降低.碳酸化反應生成的CaCO3通過氣固分離器分離至煅燒爐中再生,同時適當補充新鮮的石灰石以保證吸收劑的活性.煅燒爐采用純氧燃燒方式,便于形成高濃度的CO2(>95%).該工藝可以實現電站在煤燃燒或煤氣化以及煤、生物質氣化制氫過程中CO2的大規模、高效、經濟分離[1-3].分離出的CO2純度大于95%,可用于石油開采提高石油開采率,或進一步純化用于食品加工等.
然而,在循環煅燒/碳酸化過程中,石灰石的碳酸化能力隨著反應次數的增加下降迅速[4].Abanades等[5]進行了大量實驗工作,并對實驗數據分析整理后提出了CaO碳酸化轉化率與循環次數的函數關系,該式適用實驗條件寬(碳酸化溫度600~866℃、碳酸化氣氛中CO2分壓0.01~0.13MPa,煅燒溫度750~1060℃,煅燒氣氛中CO2分壓0~0.4MPa),具有重要參考價值.然而,根據該函數關系式,循環反應20次后,CaO的碳酸化轉化率降至0.174.
為此,研究者從對吸收劑進行改性[6-11]、制備高效吸收劑[12]等方面開展了一系列研究工作,以提高鈣基吸收劑循環捕獲CO2性能.雖然這些研究結果顯示,CaO循環捕獲CO2能力均有不同程度的提高,但它們離大規模應用還有一定距離,仍需作進一步的檢驗,并降低改性、制備成本.
研究表明,CaO的碳酸化速率與碳酸化氣氛中CO2分壓力成比例[13];Oakeson等[14]在碳酸化溫度為850~1044℃,CO2分壓力為0.245~2.487MPa的條件下獲得的研究結果表明碳酸化反應速率是碳酸化溫度和CO2分壓力的函數,CO2分壓力的影響與Langmuir等溫吸附形式有很好的關聯性.Sun等[15]認為CaO碳酸化本征反應速率與CO2分壓力存在變化的反應級數,當CO2分壓力大于10kPa時,反應級數由一級轉變為零級.雖然學者們對于CaO與CO2分壓力之間反應速率關系的意見不完全一致,但普遍認為在一定的CO2分壓力范圍內,CaO的碳酸化反應與CO2分壓力成比例,即提高CO2分壓力可望能促進碳酸化反應的進行.因此,采用增加碳酸化壓力的方法提高鈣基吸收劑的CO2捕獲效率,不僅能提高吸收劑循環利用率,減少煅燒耗熱量及失活吸收劑處理量,降低煅燒爐耗氧量,而且還能縮小碳酸化爐和煅燒爐的體積,大大降低CO2的捕獲成本.采用加壓碳酸化/煅燒循環捕獲CO2的方法高效捕集CO2將具有更廣泛的應用前景.
本文從提高吸收劑循環碳酸化性能出發,考察白云石在不同碳酸化反應壓力、溫度、碳酸化氣氛和煅燒氣氛中CO2濃度以及顆粒粒徑等條件下的循環碳酸化特性,并與石灰石的循環特性作比較,為推廣利用鈣基吸收劑循環高效捕集CO2提供理論指導.
1 實驗裝置及方法
圖1為常壓煅燒/加壓碳酸化反應系統簡圖.該系統包括常壓煅燒爐和加壓碳酸化爐,智能溫控系統能夠準確控制爐內的工作溫度,溫度偏差為±1℃.實驗過程中,將反應樣品平鋪在磁舟內形成薄層,放置煅燒爐內煅燒充分后,送入加壓碳酸化爐內,爐內迅速升壓至所需反應壓力,待爐內溫度穩定后,將氣氛切換到碳酸化反應氣氛.反應結束后,將爐內壓力卸去,取出樣品,在高精度電子天平上稱重,天平精度為±0.5mg,如此反復,進行循環碳酸化反應.調整給氣流量,使進入爐內的氣速大于0.1m/s以消除反應過程中外擴散的影響.對樣品做預備性實驗以確定充分煅燒時間和碳酸化反應時間,分別為10和25min.表1和表2分別示出了本實驗的主要反應條件和反應樣品的主要成分.循環碳酸化轉化率XN按下式計算:
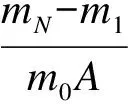
(1)
式中,XN為循環N次后的碳酸化轉化率;mN為第N次循環反應后樣品質量,g;m1為第1次煅燒后的樣品質量,g;m0為反應前樣品質量,g;A為樣品中CaO含量;WCaCO3和WCaO分別為CaCO3和CaO的摩爾質量,g/mol.
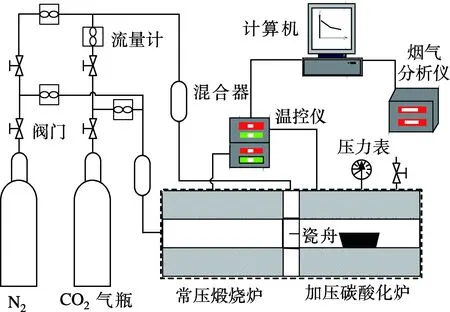
圖1 常壓煅燒/加壓碳酸化反應系統簡圖

表1 反應條件
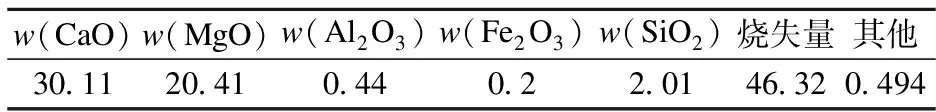
表2 白云石的成分分析 %
2 實驗結果與分析
2.1 實驗結果誤差分析
圖2給出了碳酸化反應壓力(Pcarb)為0.5MPa,碳酸化反應溫度(Tcarb)為650和750℃時,白云石的XN隨N的變化情況.由圖可知,相同碳酸化反應溫度條件下,2組實驗的碳酸化轉化率隨循環次數的變化趨勢一致,Tcarb為650℃和750℃時,2組實驗結果的相對誤差分別為2.8%和0.5%.其他工況條件下的實驗結果在相似的實驗過程下獲得,因此本實驗結果相對誤差可認為均小于5.0%.
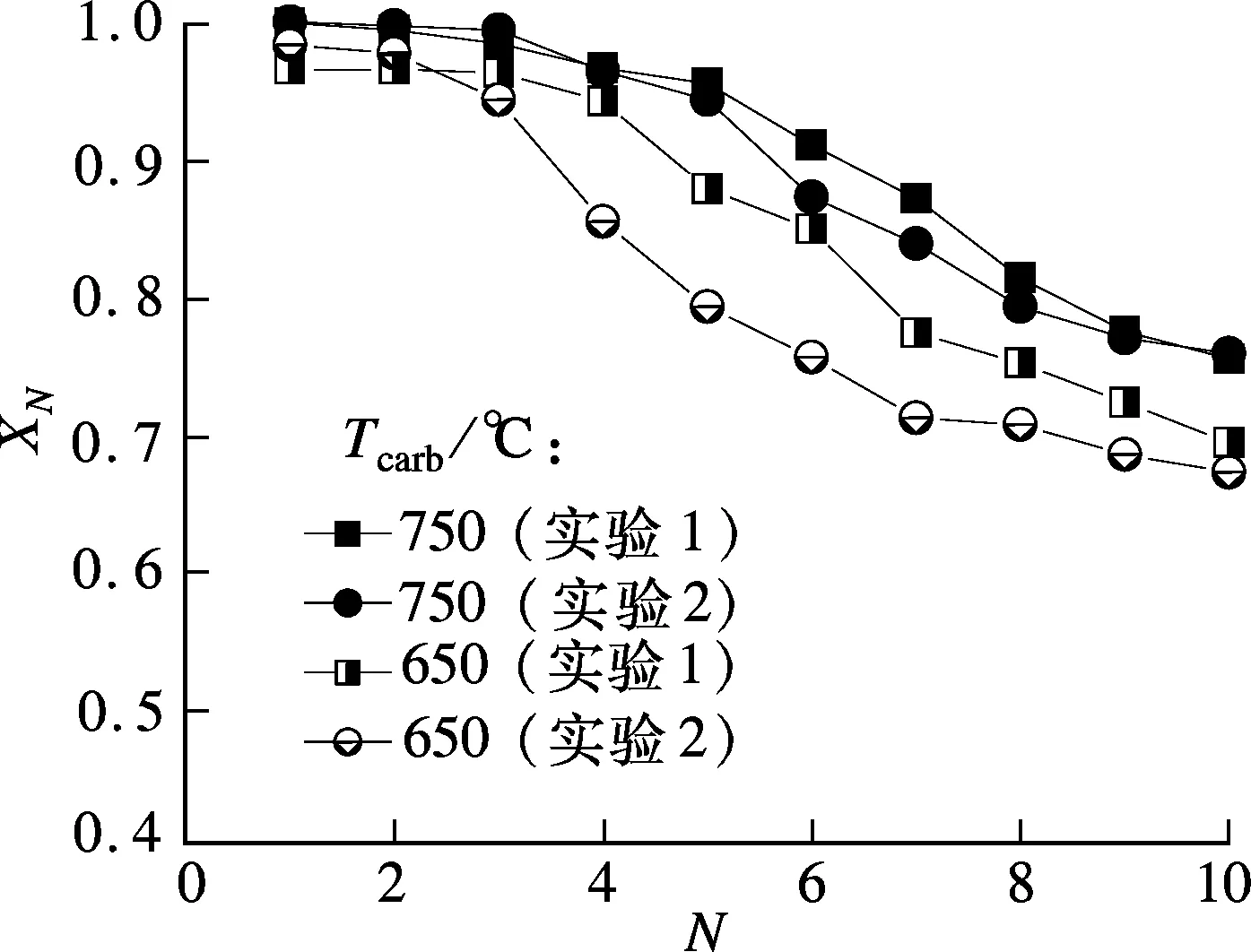
圖2 白云石XN隨N的變化情況
2.2 Pcarb和Tcarb對白云石加壓碳酸化的影響
圖3展示了Pcarb和Tcarb對白云石XN的影響.當Tcarb=650℃時,隨著N的增加,XN呈下降趨勢,如圖3(a)所示.隨著Pcarb的增加,XN呈現先增加后減小的趨勢,白云石在0.5MPa左右呈現出最佳的XN.當Tcarb=700℃時,各壓力下的XN均比Tcarb=650℃時大,如圖3(b)所示.由化學反應動力學原理可知,反應溫度增加,反應速率增大,有利于碳酸化反應的進行.同時,由吉布斯自由能最小原理可得,CaO與CO2反應過程中CO2分壓力與平衡溫度存在如下關系[16]:
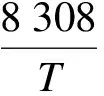
(2)
式中,Peq為CO2平衡分壓力,MPa;T為熱力學平衡溫度,K.
由式(2)可知,Tcarb=700℃對應的CO2平衡分壓力為3.5kPa,隨著Pcarb從0.1MPa增加至0.7MPa,CO2分壓力從15kPa增加至90kPa,碳酸化反應驅動力(CO2分壓力與反應溫度下CO2平衡分壓力之差)增加,有利于碳酸化反應的進行.然而,當CO2分壓力增加到一定程度時,XN并不相應增加.其原因可能是,Tcarb=700℃時,CaO與CO2本身的反應速率較快,隨著CO2分壓力的增加,碳酸化反應速率加快,然而,對于具有一定微觀孔隙結構的吸收劑,過快的反應速率將使得CO2來不及通過孔道進入顆粒內部進行反應,便與表面CaO反應生成CaCO3產物層.由于CaCO3產物層的摩爾體積(36.9mol/cm3)較大,為CaO(16.9 mol/cm3)的2倍多,CaO顆粒的孔隙容易被堵塞而阻礙碳酸化反應的繼續進行,導致XN并不與Pcarb成比例.Tcarb=700℃時,存在著最佳的Pcarb使得白云石獲得最高的XN.
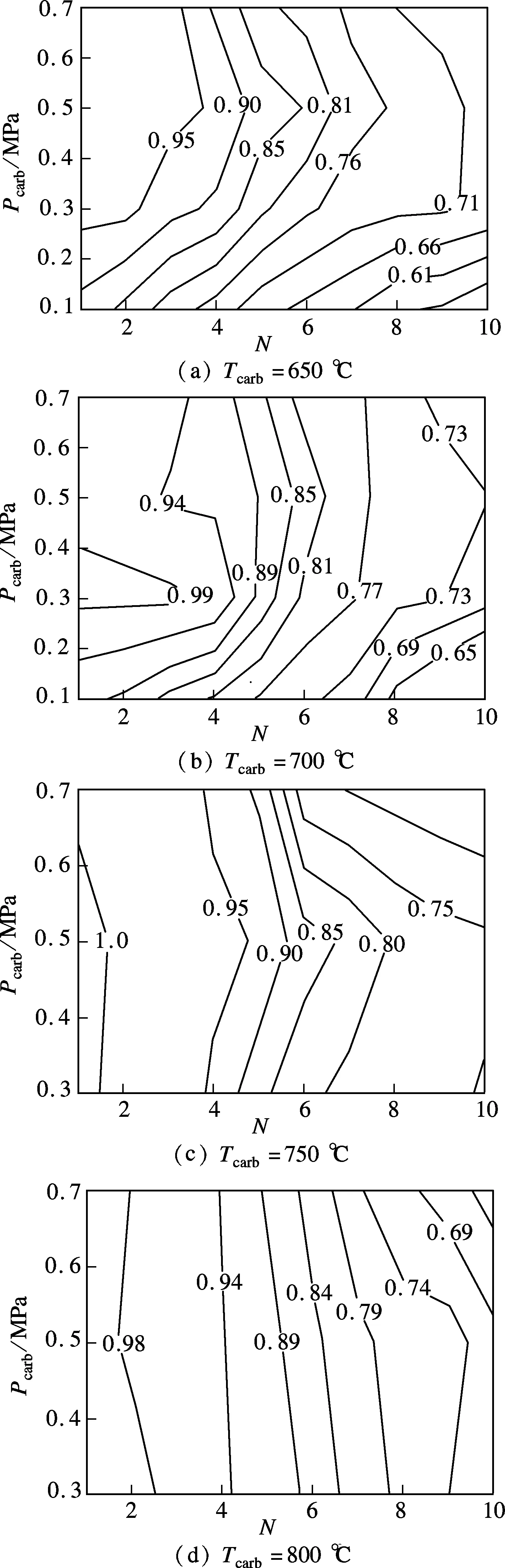
圖3 Tcarb和Pcarb對白云石XN的影響(dp<125μm)
當Tcarb=750℃時,XN隨Pcarb和N的變化趨勢如圖3(c)所示,可發現該趨勢與圖3(a)和(b)類似,且XN與Tcarb=700℃時非常接近.這表明,白云石在Tcarb=700~750℃,Pcarb=0.5MPa時具有相近的循環碳酸化反應特性.當Tcarb=800℃時,XN隨N增加下降相對較快,如圖3(d)所示.其原因主要是,Tcarb增加,對應的CO2平衡分壓力增加,在一定Pcarb下吸收劑的碳酸化反應驅動力減小,不利于碳酸化反應進行,隨著N的增加,煅燒過程和碳酸化過程的燒結作用造成了吸收劑在高、低Tcarb下的孔隙結構改變,并逐漸產生差異,使得有利于CO2擴散和反應的中孔和微孔在高Tcarb下大量減少,不利于碳酸化反應進行,XN隨N的增加下降較快.
2.3 dp對白云石加壓碳酸化的影響
鈣基吸收劑的顆粒粒徑對其碳酸化反應有一定的影響.一般而言,固體顆粒粒徑dp越小,其在氣固化學反應控制條件下的反應程度越大,轉化率越高;dp越大,孔擴散在反應中占主導地位,氣固反應阻力增大,對氣固反應不利[17].圖4展示了dp對白云石XN的影響.由圖可知,在Tcarb=700℃,Pcarb為0.5和0.7MPa下,3種dp下白云石前4次循環反應的XN均非常接近1.0.第5次循環反應開始,0.7MPa壓力下各dp的XN隨N的增加下降較快,但XN差別不大,循環10次后XN為0.68左右.這表明,高Pcarb對dp具有較好的適應性.而在0.5MPa下,存在最佳的dp,為150~300μm,經歷10次循環反應后,XN=0.77.由燒結動力學可知,固體粉末dp越大,其比表面積越小,本征表面能驅動力越小;dp越小,比表面越大,本征表面能驅動力越大[18].dp較大的白云石抗燒結能力比dp較小的白云石強,而白云石的dp較大時,其在碳酸化過程中又容易限制CO2的擴散,因此,在孔擴散控制和燒結機理共同作用下,白云石在dp=150~300μm時獲得了最高的XN.
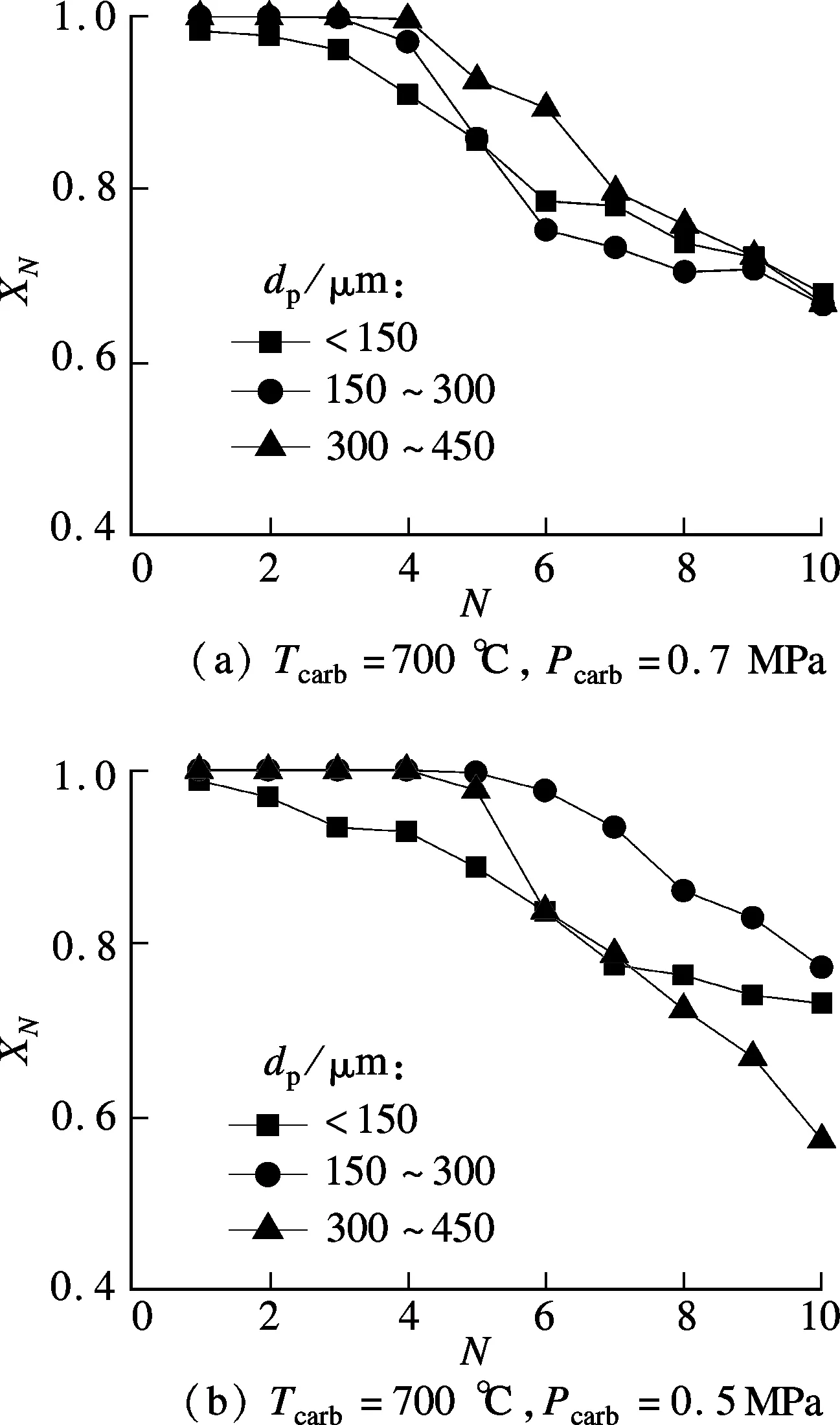
圖4 dp對白云石XN的影響
2.4 碳酸化氣氛中CO2濃度對白云石加壓碳酸化的影響
Mess等[4]認為,CaO的碳酸化反應過程中,CO2通過孔隙擴散的有效擴散系數Deff為
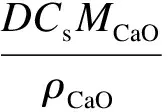
(3)
式中,D為孔擴散系數,cm/s2;Cs為反應氣相本體中CO2濃度,mol/cm3(假設CaO表面CO2濃度為零);MCaO為CaO的摩爾質量,g/mol;ρCaO為CaO的真實密度,g/cm3.由此可見,反應氣氛中CO2濃度越大,CO2的有效擴散系數也越大,碳酸化反應越快,對碳酸化反應越有利.
然而,在加壓碳酸化反應過程中,XN并不隨碳酸化氣氛中CO2濃度的增加而增加.圖5示出了Pcarb=0.5MPa,Tcarb=700℃,dp<125μm時碳酸化氣氛中CO2濃度對白云石XN的影響.由圖可知,碳酸化氣氛中CO2濃度從15%增加到100%時,XN隨N的增加均呈下降趨勢,各CO2濃度下轉化率差別非常小.這主要是因為白云石本身擁有優良的孔隙結構,Pcarb=0.5MPa,Tcarb=700℃下的碳酸化反應較快,碳酸化氣氛中CO2濃度的增加對進一步增加碳酸化反應速率的貢獻有限,XN沒有明顯地提高.白云石本身具有一定的抗燒結能力,其在不同的CO2濃度下,隨著N的增加,能保持比較高的碳酸化轉化率.因此,對于孔隙結構優越的吸收劑,在加壓碳酸化條件下,其對碳酸化氣氛中CO2濃度具有很好的適應性.對于本實驗,在Tcarb=700℃和Pcarb=0.5MPa條件下,煙氣CO2濃度為15%時便可獲得較高的XN,表明0.5MPa和700℃下對捕捉煙氣中的CO2非常適合,可高效捕獲具有不同CO2濃度氣體中CO2,凈化煙氣或合成氣.

圖5 碳酸化氣氛中CO2濃度對白云石XN的影響
2.5 煅燒氣氛中CO2濃度對白云石加壓碳酸化的影響
CO2已被普遍認為是一種燒結媒介,會強烈影響石灰石煅燒產物的微觀結構,其分壓力的增加對石灰石分解的動力學特性存在影響[19].然而,煅燒氣氛中CO2濃度對鈣基吸收劑加壓碳酸化的影響程度是一個值得關注的問題.
圖6給出了dp<125μm的白云石在Tcarb=700℃時,煅燒氣氛中CO2濃度對XN的影響.由圖可知,Pcarb=0.1MPa時,XN受煅燒氣氛中CO2濃度的影響相對較大,煅燒氣氛中無CO2時X1為0.88~0.92,循環反應10次后,XN下降為0.55,而CO2濃度為80%時XN則下降為0.46,多衰減了9%.常壓碳酸化反應下,煅燒氣氛中CO2濃度的增加加速了XN的衰減.Pcarb=0.5MPa時,隨著煅燒氣氛中CO2濃度從0增加到100%,各CO2濃度下的XN差異較小,循環反應10次后,XN均大于0.73,其中無 CO2時的XN比 CO2濃度為100%時高2%,CO2濃度為80%與CO2濃度為100%時的XN幾乎沒有差別.表明煅燒氣氛中CO2濃度對加壓碳酸化反應XN的影響較小,加壓碳酸化反應對煅燒氣氛具有較好的適應性,0.5MPa和700℃的碳酸化反應條件在某種程度上可以彌補煅燒氣氛中CO2濃度的增加導致吸收劑微觀結構改變的影響.
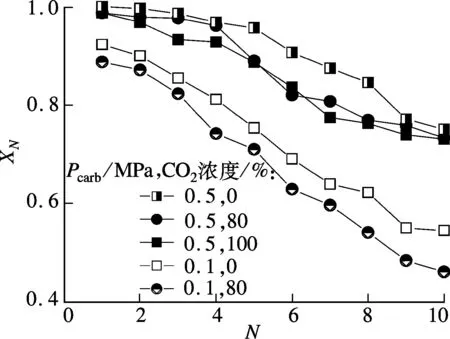
圖6 煅燒氣氛中CO2濃度對白云石XN的影響
2.6 白云石與石灰石的加壓碳酸化特性比較
圖7給出了在Tcarb=700℃,Pcarb=0.5MPa,dp<125μm,CO2濃度為15%和100%的碳酸化氣氛下,白云石與石灰石的循環碳酸化特性及其循環反應10次后的孔容積特性.由圖7(a)可知,白云石在2種碳酸化氣氛中的XN均比石灰石高.經歷10次循環后,15%CO2濃度下白云石的XN為0.73,而石灰石的為0.62.白云石在較寬的CO2濃度下均獲得比較高的XN.而石灰石的XN隨著碳酸化中CO2濃度的增加下降較快.白云石對CO2濃度的適應性更強,在循環碳酸化過程能保持較高的XN.圖7(b)說明了在CO2濃度為15%的碳酸化氣氛下白云石的XN較石灰石高的主要原因.白云石的加壓碳酸化/循環煅燒反應對顆粒粒徑、煅燒氣氛及碳酸化氣氛中CO2濃度等具有相對寬松的適應范圍,易實現高效捕獲煙氣中CO2及凈化合成氣的規模化應用.
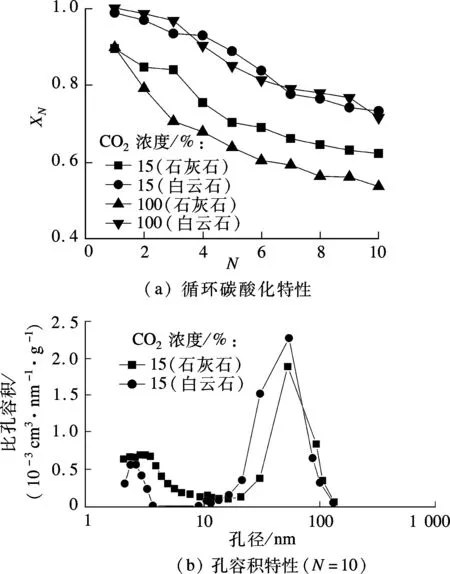
圖7 白云石與石灰石的循環碳酸化特性及孔容積特性比較
3 結論
1)Pcarb一定時,XN隨Tcarb增加先增加后減小,在Tcarb=700℃左右,XN隨N的增加下降緩慢;在15% CO2濃度下,Tcarb一定時,在一定范圍內提高Pcarb有利于碳酸化反應.隨著Pcarb的進一步增加,由于CaCO3產物層的快速形成抑制了碳酸化反應的繼續進行,XN并不隨Pcarb的增加成比例增加.
2)Tcarb和Pcarb對CaO的碳酸化反應具有相互補償的作用,存在最佳的Tcarb和Pcarb使得CaO獲得最佳的XN,在本實驗范圍內,0.5MPa和700~750℃的碳酸化反應條件下獲得最佳的XN.
3) 白云石的加壓碳酸化對煅燒氣氛中CO2濃度具有較好的適應性,并具有較寬的粒徑(dp=0~450μm)適應范圍.相同反應條件下其XN較石灰石的大.
4) 增加碳酸化氣氛中CO2濃度并不一定能提高鈣基吸收劑加壓條件下的XN,在0.5MPa和700℃下提高CO2濃度,XN沒有顯著提高.
5) 白云石具有較石灰石優越的孔隙結構是其獲得較高XN的主要原因.
)
[1]Abanades J C,Rubin E S,Anthony E J.Sorbent cost and performance in CO2capture systems [J].IndustrialandEngineeringChemistryResearch,2004,43(13): 3462-3466.
[2]Koppatz S,Pfeifer C,Rauch R,et al.H2rich product gas by steam gasification of biomass with in situ CO2absorption in a dual fluidized bed system of 8 MW fuel input [J].FuelProcessingTechnology,2009,90(7/8): 914-921.
[3]Weimer T,Berger R,Hawthorne C,et al.Lime enhanced gasification of solid fuels: examination of a process for simultaneous hydrogen production and CO2capture [J].Fuel,2008,87(8/9): 1678-1686.
[4]Mess D,Sarofim A F,Longwell J P.Product layer diffusion during the reaction of calcium oxide with carbon dioxide [J].EnergyandFuels,1999,13(5): 999-1005.
[5]Abanades J C,Alvarez D.Conversion limits in the reaction of CO2with lime [J].EnergyandFuels,2003,17(2): 308-315.
[6]Roesch A,Reddy E P,Smirniotis P G.Parametric study of Cs/CaO sorbents with respect to simulated flue gas at high temperature [J].IndustrialandEngineeringChemistryResearch,2005,44(16): 6458-6490.
[7]Li Y J,Zhao C S,Chen H C,et al.Cyclic CO2capture behavior of KMnO4-doped CaO-based sorbent [J].Fuel,2010,89(3):642-649.
[8]Hughes R W,Lu D,Anthony E J,et al.Improved long-term conversion of limestone-derived sorbents for in situ capture of CO2in a fluidized bed combustor [J].IndustrialandEngineeringChemistryResearch,2004,43(18): 5529-5539.
[9]Manovic V,Anthony E J.Steam reactivation of spent CaO-based sorbent for multiple CO2capture cycles [J].EnvironmentalScienceandTechnology,2007,41(5): 1420-1425.
[10]Sun P,Grace J R,Lim C J,et al.Investigation of attempt to improve cyclic CO2capture by sorbents hydration and modification [J].IndustrialandEngneeringChemistryResearch,2008,47(6): 2024-2032.
[11]Chen H C,Zhao C S,Duan L B,et al.Enhancement of reactivity in surfactant-modified sorbent for CO2capture in pressurized carbonation [J].FuelProcessingTechnology,2011,92(3): 493-499.
[12]Lu H,Smirniotis P G.Calcium oxide doped sorbents for CO2uptake in the presence of SO2at high temperatures [J].IndustrialEngineeringChemicalResearch,2009,48(11): 5454-5459.
[13]Grasa G S,Abanades J C,Alonso M,et al.Reactivity of highly cycled particles of CaO in a carbonation/calcination loop [J].ChemicalEngineeringJournal,2008,137(3): 561-567.
[14]Oakeson W G,Cutler I B.Effect of CO2pressure on the reaction with CaO [J].JournaloftheAmericanCeramicSociety,1979,62(11/12): 556-558.
[15]Sun P,Grace J R,Lim C J,et al.Determination of intrinsic rate constants of the CaO-CO2reaction [J].ChemicalEngineeringScience,2008,63(1): 47-56.
[16]Baker E H.The calcium oxide-carbon dioxide system in the pressure range 1-300 atmospheres [J].JournalofChemicalSociety,1962,70: 464-470.
[17]塞克利.氣-固反應 [M].北京: 中國建筑工業出版社,1986.
[18]崔國文.缺陷、擴散與燒結 [M].北京: 清華大學出版社,1990.
[19]Adanez J,Diego L F,Garcia-Labiano F.Calcination of calcium acetate and calcium magnesium acetate: effect of the reacting atmosphere [J].Fuel,1999,78(5): 583-592.

