食管癌CT表現及其對放療的預測價值
施 怡 顏志勇 謝伯軍
食管癌UICC分期系術后病理分期,可以準確指導術后綜合治療及預后評價,而臨床上近半數食管癌因病情晚,無法手術或不能手術,需要接受放射治療。食管癌非手術治療準確分期艱難,臨床分期主要根據CT掃描、腔內超聲、PET-CT等方法[1~5]。雖然腔內超聲和PET-CT在分期準確性方面優于CT掃描,但根據我國實情,短期內難以廣泛應用于臨床。近年來,CT技術的發展使其對食管癌的分期準確率有所提高,對T4準確率更高[6,7]。
1 資料與方法
1.1 一般資料
2007年~2009年我院收治食管癌患者182例,均有完整臨床和CT資料,并經病理檢查證實為食管鱗癌,放療前均未發生轉移,男性114例,女性68例,年齡45~84歲,中位年齡70歲。病變部位:頸段19例,胸上段38例,胸中段103例,胸下段22例。CT掃描顯示腫瘤長度為1.5~14.7 cm,中位數5.0 cm,其中<3.0 cm 30例,3.1~5.0 cm 42例,5.1~7.0 cm 60例,>7.1 cm 50例。最大層面的食管直徑≤2.0 cm 52例,2.1~4.0 cm 51例,>4.1 cm 79例。腫瘤無明顯強化2例,輕度強化92例,中度強化86例,明顯強化2例。腫瘤邊緣規則54例,邊緣不規則但無明顯外侵62例,明顯外侵66例。
1.2 方法
1.2.1 CT掃描方法 放療前均應用東芝16層螺旋CT行增強掃描,掃描范圍為胸部+中下頸部,螺旋CT掃描螺距1.0,層間距5 mm。選用非離子型對比劑碘佛醇50 ml 33.9 g(江蘇恒瑞醫藥股份有限公司),于患者肘部置入靜脈留置針(20GX 29 mm)推注,對比劑成人劑量按1.2~1.5 ml/kg,注射速度為1.5~2.0 ml/s,延遲時間為60 s。
1.2.2 觀察方法 由3位有經驗的影像診斷科醫師對放療前CT資料進行分析,從食管癌強化程度、邊緣情況、病灶長度、最大層面的食管直徑4個方面,分析食管腫瘤CT表現與預后的關系。以食管腫瘤與胸鎖乳突肌CT值之差作為參考值,將食管腫瘤強化程度分為無明顯強化(<30 Hu),輕度強化(30~59 Hu),中度強化(60~90 Hu),明顯強化(>90 Hu)。
1.2.3 放射治療 所有病例采用常規分割放射治療。定位方法:胸段食管癌采用3個野照射,頸段設兩前斜野或T形野,放射野上下界分別在病變上下各擴3.0 cm,前野寬6.0 cm,后斜(兩前斜)野寬4.5~5.5 cm。所有患者采用8 MVX射線,2 Gy/次,5次/周,總劑量64~68 Gy,分32~34次、42~46天完成。
1.3 療效評價標準
食管癌的近期療效評價在放療后3個月內進行,參照萬鈞1989年提出的食管癌放療后近期療效評價標準,完全緩解(CR):腫瘤完全消失,食管X線攝片邊緣光滑,鋇劑通過順利,但管壁稍顯強直,管腔無狹窄和黏膜基本恢復正常或增粗;部分緩解(PR):病變大部分消失,無明顯的扭曲或成角,無腔外潰瘍,鋇劑通過尚順利,但邊緣欠光滑,有小的充盈缺損及小龕影,或邊緣雖光滑但管腔有明顯狹窄;無緩解(NR):放療結束時,病變有殘留或病變無明顯好轉,仍有明顯的充盈缺損及龕影或狹窄加重。
1.4 統計學方法
局部控制率及生存率采用Kaplan-Meier法計算,并應用logrank檢驗。
2 結果
2.1 隨訪結果
截止2011年12月隨訪率為100.0%,2年局部控制率為63.7%。
2.2 食管腫瘤CT表現及與其預后關系
食管腫瘤CT表現與患者近期療效、遠期局部控制率的關系見表1。
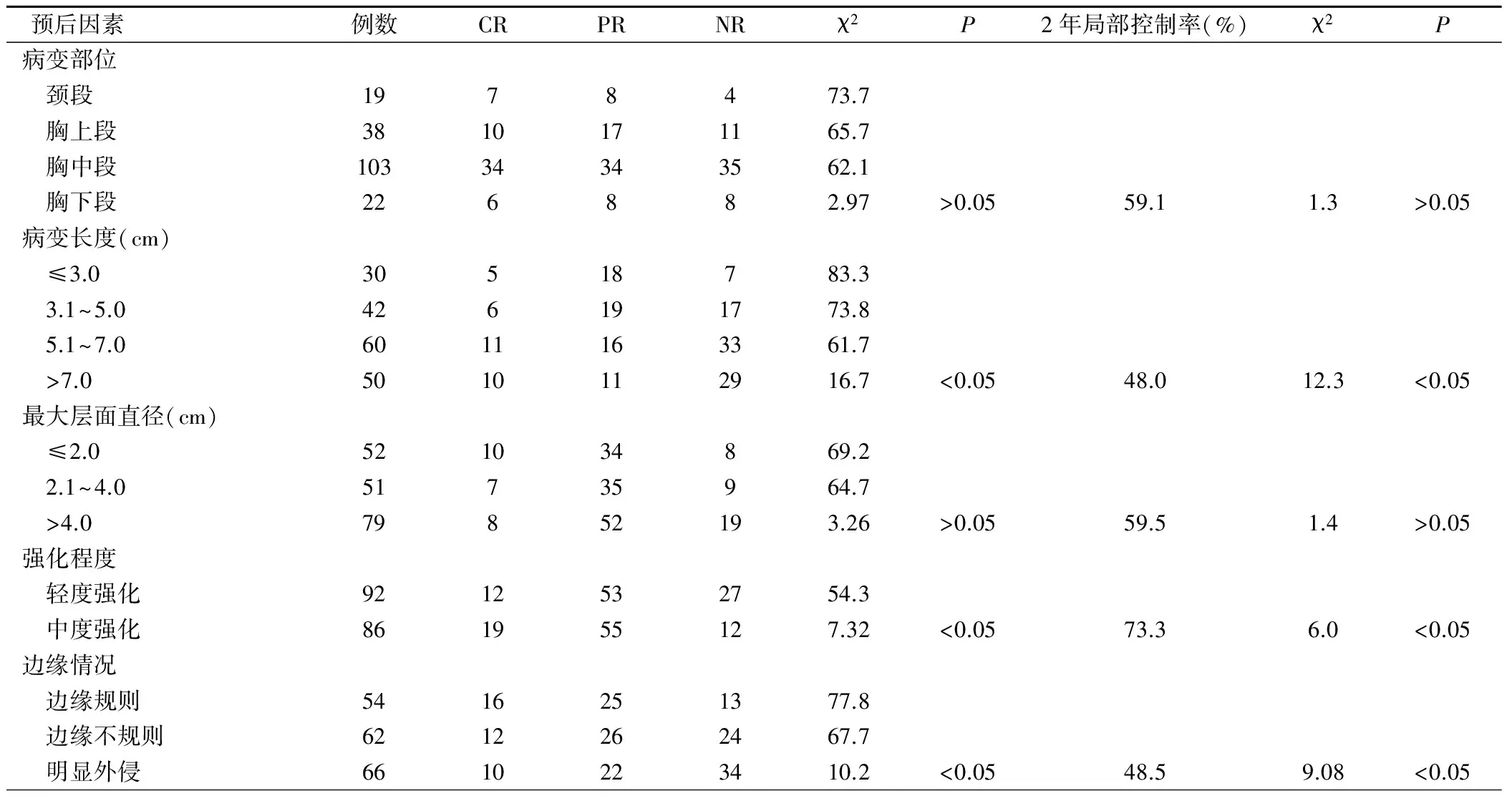
表1 食管腫瘤CT表現與患者近期療效和2年局部控制率的相關性(例)
中度強化者近期療效較輕度強化者好(χ2=7.32,P<0.05),2年局部控制率分別為73.3%和54.3%(χ2=6.0,P<0.05),兩者比較有統計學意義。無強化和明顯強化者因病例數太少,故不進行分析。
食管腫瘤邊緣規則者近期療效較邊緣不規則(χ2=6.87,P<0.05)和明顯外侵者好(χ2=6.04,P<0.05),邊緣不規則者好于明顯外侵者(χ2=6.0,P<0.05)。2年局部控制率邊緣規則者(77.8%)明顯高于邊緣不規則者(67.7%)(χ2=4.02,P<0.05)和明顯外侵者(48.5%) (χ2=16.0,P<0.05),不規則者高于明顯外侵者(χ2=3.88,P<0.05)。
病變長度對患者預后影響顯著(P<0.05),病變長度越長預后越差,病變長度越短預后越好。食管病變最大層面的直徑對患者預后無顯著影響(P>0.05)。
3 討論
放療是中晚期食管癌主要治療方法之一,臨床分期早晚是最主要預后影響因素之一[8]。好的分期標準首先應該能較為準確地反應患者實際預后情況,從二十世紀末至今,CT檢查已普遍應用于臨床,基于CT掃描的三維適形放療技術已成為主流技術,因此把CT圖像信息納入分期標準非常必要。對于食管癌的放療是否存在劑量效應關系,國內外一直存在爭議,早期萬鈞曾對221例食管癌患者進行前瞻性分組研究,結果顯示處方劑量為50 Gy組和70 Gy組5年生存率并無差異,10年生存率分別為9.3%和11.1%,認為食管癌單純放療時不必追求高劑量照射。近期歐美國家進行的多個周期放化療前瞻性隨機分組研究也提示提高食管癌的放療劑量并沒有獲得局部控制率和生存率改善,2年局部控制率均在50%上下[9]。由于國內大多數研究仍認為,食管癌接受60~70 Gy照射的療效優于不足60 Gy者,因此目前臨床采用的食管癌根治性放療處方劑量仍多在60~70 Gy。Denys等采用放化療綜合治療62例Ⅲ~Ⅳ期頭頸部鱗狀細胞癌患者,并前瞻性分析腫瘤退縮速度對預后的影響,發現CR或者接近CR患者的預后優于部分退縮/無退縮的患者。該結果與本文的研究結果類似,進一步證實治療結束時腫瘤殘留預示著預后欠佳,放療結束時腫瘤殘留提示預后不良,放療局部控制情況好者,預示著預后相對較好。因為最終的治療效果是由殘留的對輻射抗拒的克隆源性細胞決定的,腫瘤體積的縮小并不能使整個腫瘤恢復到未治療的敏感狀態,伴隨每一次照射,不敏感細胞的比例逐漸增高,而且變得更具有抵抗,可能是腫瘤復發的根源之一,從而導致治療失敗。
食管無漿膜層,使得食管癌在較早期時可直接向周圍組織器官侵襲,如主支氣管、肺門、主動脈弓或降主動脈、縱隔胸膜等。縱軸擴散是沿壁內淋巴網和神經周圍間隙向上或向下轉移,食管癌可通過壁內的淋巴管擴散,可形成壁內轉移灶或多中心來源而形成多中心病灶。劉復生報道多源性食管癌的發生率為10.8%,從食管癌病理研究中發現食管黏膜上皮增生、間變和上皮內癌可連續或間斷分布于整個食管黏膜,其最大范圍可達食管縱長13 cm。食管癌放療前食管鋇餐造影顯示病變長度是影響食管癌預后的重要因素,放療前食管鋇餐造影病變越長預后越差,病變越短預后越好[8,10,11],該結果與本文的研究結果類似。
中晚期食管癌大體臨床病理分型為髓質型、蕈傘型、潰瘍型、縮窄型、腔內型。髓質型組織主要向食管壁內擴展,食管壁明顯增厚,蕈傘型癌組織常呈卵圓形并突向食管腔內類似蘑菇狀,多數病例的癌組織并不累及食管全周,僅侵犯食管壁的一部分或大部。潰瘍型病變癌組織常累及食管壁的一部分,癌組織很薄。縮窄型病變癌組織呈明顯的狹窄與梗阻,局部管壁常常縮短,幾乎累及食管壁全周,癌組織已穿透肌層。腔內型腫瘤突向食管腔內呈圓形或卵圓形隆起,無蒂或有蒂,與食管壁相連。由于不同分型與預后相關,一般認為蕈傘型和腔內型對放射線敏感,髓質型中度敏感,縮窄型較抗拒。顯然癌細胞類型與分化程度對預后具有重要影響。蕈傘型、腔內型食管癌主要向腔內生長,其形態、生物學行為在CT圖像上表現為食管腫瘤直徑大,邊緣規則。
實體癌微循環狀態一定程度上決定瘤內氧合狀態并影響腫瘤細胞的增殖狀態。腫瘤微循環的特點:腫瘤生長、新生血管形成與血流量增加有關。但腫瘤的血管新生環境惡劣,其新生血管有些是畸形血管,其內皮不完整或間隙較大,而且缺少平滑肌和神經分布,容易被壓扁。這些異常造成惡性腫瘤不同區域血流的異質性和腫瘤間質滲透壓異常,使得腫瘤血流生理和血流動力學變得更加復雜,同時這些變化也成為CT強化,顯示病變特征的基礎[12]。乏氧作為惡性實體腫瘤微環境的重要特征之一,能促進腫瘤的惡性化進程,并造成治療抵抗[13]。
放射治療是食管癌有效的治療手段,2年局部控制率中度強化的好于輕度強化的,邊緣規則的好于邊緣不規則的和明顯外侵的,邊緣不規則的好于明顯外侵的,病變越長預后越差,病變越短預后越好,食管病變最大層面的直徑對預后無顯著影響。
總之,食管腫瘤強化低、明顯外侵、病灶長提示無轉移生存率明顯下降,因此可據此做出粗略判斷。增強CT掃描較CT平掃提供更祥細的圖像信息,因此,增強CT掃描可能對食管癌及預后關系能作出更準確的分析。
[1] 施 宏,陳索玉,謝招飛,等.超聲內鏡及CT檢查對食管癌術前TN分期的價值〔J〕.中華消化內鏡雜志,2008,25:233.
[2] 胡 煒,傅劍華,戎鐵華,等.超聲內鏡及CT在食管癌術前分期診斷的價值〔J〕.中華胃腸外科雜志,2008,11:150.
[3] Kutup A,Link BC,Schurr PG,et al.Quality control of endoscopic ultrasound in preoperative staging of esophageal cancer〔J〕.Endoscopy,2007,39:715.
[4] Shimpi RA,George J,Jowell P,et al.Staging of esophageal cancer by Eus:staging accuracy revisited〔J〕 .Gastrointest Endosc,2007,66:475.
[5] Van Vliet EP,Heijenbrok-Kal MH,Hunink MG,et al.Staging investigations for oesophageal cancer:a meta-analysis〔J〕.Br J Cancer,2008,98:547.
[6] Onbas O,Eroglu A,Kantarci M,et al.Preoperative staging of esophageal carcinoma with multidetector CT and virtual endoscopy〔J〕.Eur J Radid,2006,57:90.
[7] Panebianco V,Grazhdani H,Lafrate F,et al.3D CT protocol in the assessment of the esophageal neoplastic lesions:can it improve TNM staging〔J〕? Eur Radiol,2006,16:414.
[8] 蔣 杰,王奇峰,肖澤芬,等.132例食管癌三維適形放療的療效分析〔J〕.中華放射腫瘤學雜志,2009,18:47.
[9] Stahl M,Stuschke M,Lehmann N,et al.Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus〔J〕.J Clin Oncol,2005,23:2310.
[10] 王玉祥,祝淑釵,李 娟,等.209例食管癌三維適形放療療效分析〔J〕.中華放射腫瘤學雜志,2010,19:101.
[11] 祝淑釵,李 任,王玉祥,等.500例中晚期食管癌單純放療的多因素分析〔J〕.中華放射腫瘤學雜志,2005,14:253.
[12] Goh V,Padhani AR,Rasheed S.Functional imaging of colorectal cancer angiogenesis〔J〕.Lancet Oncol,2007,8:245.
[13] Fukumura D,Jain RK.Imaging angiogenesis and the microenvironment〔J〕.APMIS,2008,116:695.

