光照和生長階段對菖蒲根系泌氧的影響
王文林,王國祥,萬寅婧,夏 勁,唐曉燕,陳 昕,梁 斌,莊 巍
(1.南京師范大學地理科學學院/江蘇省環境演變與生態建設重點實驗室,南京 210023;2.環境保護部南京環境科學研究所,南京 210042;3.江蘇省環境工程咨詢中心,南京 210029)
濕地植物根系泌氧具有十分重要的意義,一方面形成根際氧化、還原異質環境,有利于污染物的吸收降解[1-3],另一方面使根系附近還原性物質得到氧化[4],促進濕地植物在根表形成鐵錳氧化物膜[5],有利于保護根部滲透性膜系統及其功能的發揮[6]。光照被認為是影響濕地植物根系泌氧的重要因素[7-8],其研究也日益得到關注。Emmal[7]和 Water[9]分別發現光照能提高蘆葦(Phragmites communis)和水稻(Oryza sativa L.)的根系泌氧能力,Tomomi[10]則發現光照能顯著提高香蒲(Typha orientalis)的根系泌氧能力,對狹葉香蒲(Typha angustifolia L.)則沒有影響。但以上研究均集中于光照對植物某一生長階段根系某一部位的根系泌氧能力的影響,而濕地植物生長階段的差異、根系不同部位的組織結構、生物功能等特性均可能會影響泌氧效果[11],目前關于光照及生長階段對濕地植物根系不同部位的泌氧影響研究鮮見報道。
根際微界面氧化層厚度往往只有數毫米[12-13],其內部環境因子定量測定比較困難,因而上述相關研究均采用圓筒狀金屬鉑電極技術、檸檬酸鈦比色、蒽醌自由基負離子法等異位測定技術[7,9-10],往往不能反映濕地植物根際在沉積物中的泌氧效應真實狀況。溶氧微電極技術的發展能夠原位測定濕地植物根際微界面溶氧的微時空分布,真實反映微界面溶氧特征,使進而探討根系泌氧作用及其對污染物的影響成為可能。
本實驗以自然湖泊沉積物為研究基質,利用微型電機控制溶氧微電極實現縱向精確微位移,在照光與遮光條件下,對典型濕地植物菖蒲幼苗、成株根系微界面徑向溶氧變化進行原位精確測定,真實反映光照及植物生長階段對根系-沉積物微界面溶氧特征的影響,揭示根系徑向泌氧變化規律,為富營養化水體植物生態修復及污染控制提供理論依據。
1 材料與方法
1.1 實驗植株培養
選用典型濕地植物菖蒲(Acorus calamus),一種多年生濕生草本植物,廣泛分布于溫帶、亞熱帶地區,我國各地均有分布,生長于池沼、河岸、河溪邊等季節性和非周期性水位埋深變化較大的淺水區域[14]。2012年6月,在南京師范大學水環境生態修復平臺玻璃溫室中,將越冬的菖蒲塊莖置于沉積物(沉積物取自南京城東一小型富營養化湖泊(32°06'10.36″N,118°54'13.75″E)表層底泥)中培養,平均培養溫度 29.5℃,最后根據實驗需求選擇萌發水平一致的菖蒲作為實驗用植物。
1.2 實驗設計
2012年6月29日,從已萌發的菖蒲中選擇株高12cm左右的菖蒲3株(3個重復),小心剝離根系沉積物后種植于1個0.5×0.5m實驗盆中,沉積物使用培養菖蒲塊莖時所用沉積物,覆泥深度12cm,定期加蒸餾水使其剛好覆蓋沉積物,最后將實驗盆置于光照培養箱中培養,培養箱外蒙上遮光布,培養條件為6:00—18:00 3000lx光照強度,18:00—翌日6:00停止照光,培養溫度25℃,實驗開始后定期測定菖蒲株高、葉寬。
7月3日,在菖蒲平均株高約15cm時(作為幼苗處理),在3株待測菖蒲中各選擇1個根(根長約6cm)作為測定根,在照光(光強強度3000lx(Light))及遮光(Dark)條件下,測定離根基部1.5cm處(根1/4)、3.0cm處(根1/2)、4.5cm處(根3/4)和根尖處(根1)根系微界面徑向溶氧濃度的變化;7月27日,在菖蒲平均株高約60cm時(作為成株處理),在照光及遮光條件下,再次測定幼苗時期選定的3個測定根(根長約11cm)離根基部2.7cm處(根1/4)、5.5cm處(根1/2)、8.2cm處(根3/4)和根尖處(根1)根系微界面徑向溶氧濃度的變化。每次測定時,照光處理組測定時間為12:00,遮光處理組測定時間為24:00。此外,還同時測定根長及不同部位根直徑等生長指標,以上指標取3個測定根平均值作比較,測定在光照培養箱中進行。
1.3 溶氧微電極測定
菖蒲測定根不同部位表面徑向溶氧濃度變化由氧氣微電極測定(clark-type O2-electrode,直徑25μm,Unisense,Germany)。每次測定前,小心取出菖蒲待測根,拉直后固定在小型支架上,然后操縱裝置將溶氧微電極定位到根測定部位表面處,再將實驗盆內表層沉積物小心覆蓋測定根,覆蓋厚度1cm,穩定30min[13],然后操縱溶氧微電極反向位移,記錄位移距離(程序自動記錄),操縱溶氧微電極反向位移20μm/次,測定根際表面以上徑向溶氧濃度,待溶氧濃度為零時停止測定,此時反向位移距離即為根系氧擴散層厚度。
1.4 試驗用的沉積物特性
菖蒲幼苗、成株測定時(7月3日、27日)用于覆蓋測定根的沉積物均為實驗盆內表層底泥,在進行理化性質分析后得知,兩者基本無差異(表1)。

表1 沉積物理化性質比較Table 1 The comparison of sediment physical and chemical properties
1.5 菖蒲葉片葉綠素光化熒光參數的測定
7月3日、7月27日7:00,使用水下飽和脈沖熒光儀DIVING PAM(德國WALZ公司)和數據采集軟件wincontrol原位測定菖蒲葉片葉綠素光化熒光參數,每一重復處理隨機選擇1片葉片的中上部位測定葉綠素熒光參數值,取3個重復的平均值作比較。葉片使用葉夾遮光處理(暗適應)5min后,打開葉夾,然后開啟光強度為30 μmol光子m-2s-1的光化光,照射葉片10s后,再開啟飽和脈沖光(飽和脈沖光強度4000μmol光子m-2s-1,持續時間0.8s)測得光化熒光參數Yield[15]。Yield表示在照光下PSⅡ的實際光化學效率,反映吸收的光子供給PSⅡ反應中心的效率,在低光強下,實際光化學效率的高低直接決定葉片光合速率的高低[16]。
1.6 統計分析
采用SPSS 13.0統計軟件對實驗數據進行處理和分析。菖蒲幼苗、成株的生長指標,根系每個測定點在菖蒲不同生長階段、不同光照條件下以及各個測定點之間的氧飽和度、氧擴散層厚度差異采用單因素方差分析(one way ANOVA)和Tukey多重比較的統計方法,極顯著水平設置為α=0.01、顯著性水平設置為α=0.05。采用Microsoft Excel軟件制作圖表。
2 結果與分析
2.1 菖蒲幼苗、成株長勢及光合作用能力比較
菖蒲幼苗、成株長勢見表2,菖蒲成株株高、葉寬、平均根長、根直徑均顯著高于菖蒲幼苗(P<0.01);從根系發育上看(圖1),菖蒲幼苗根系不同部位根直徑差異較小,具體表現為根1/4≈根1/2>根3/4≈根1(P<0.05,P>0.05),而菖蒲成株則差異較大,表現為根 1/4>根 1/2>根3/4>根1(P<0.05);由表2 還可知,菖蒲幼苗、成株葉片yield值無顯著差異(P>0.05),表明二者葉片光合速率無顯著差異。

表2 菖蒲幼苗和成株長勢及光合作用能力Table 2 Plant growth and chlorophyll fluorescence parameters of A.calamus seedling and adult A.calamus plant

圖1 菖蒲幼苗、成株根不同部位直徑Fig.1 The diameter of different root parts of A.calamus seedling and adult A.calamus plant
2.2 生長階段對菖蒲根系泌氧影響
如圖2,無論有無光照,除根1/4處外,其余根不同部位氧擴散能力菖蒲成株較幼苗均顯著增強(P<0.01),遮光處理組增強幅度弱于照光處理組。遮光處理時,幼苗根1/2、根3/4、根1處氧擴散層厚度、最大氧飽和度由 0.3、0.28、0.24mm 和 3.5%、4.0%、3.1% 增加到成株的 0.38、0.34、0.36mm 和 21.5%、12.5%、11.6%,照光處理時,幼苗根1/2、根3/4、根1處氧擴散層厚度、最大氧飽和度由 0.4、0.32、0.26mm 和 6.4%、3.6%、4.1% 增加到 0.68、0.52、0.46mm 和 42.9%、22.5%、10.2%。而在照光、遮光處理時,菖蒲幼苗根1/4處氧擴散層厚度、最大氧飽和度與菖蒲成株相比無顯著差異(P>0.05)。
2.3 光照對菖蒲幼苗根系泌氧影響
氧擴散層厚度及氧飽和梯度可直接反映根系泌氧能力[17],如圖2,無論有無光照,菖蒲幼苗根系不同部位均存在從根表面至沉積物氧飽和度由高到低的氧擴散層,照光條件下氧擴散層厚度為0.26—0.40mm,最大氧飽和度為6.4%;遮光條件下氧擴散層厚度為0.24—0.30mm,最大氧飽和度為4.1%。
如圖2、圖3,光照對菖蒲幼苗根系不同部位氧擴散能力的影響存在差異,照光處理根1/2處氧擴散能力顯著強于遮光處理(P<0.01),氧擴散層厚度及最大氧飽和度分別為0.40mm和6.4%,為遮光處理的1.18倍和1.83倍;而菖蒲幼苗根1/4、根3/4、根1處,照光處理與遮光處理相比,氧擴散能力則無顯著性差異(P>0.05)。
從根系泌氧空間差異上看(圖2,圖3,表3),照光處理時,菖蒲幼苗具體表現為根1/2>根3/4≈根1≈根1/4(P<0.01,P>0.05),而遮光處理時,菖蒲幼苗根系不同部位氧擴散能力則無顯著性差異(P>0.05)。
2.4 光照對菖蒲成株根系泌氧影響
如圖2,無論有無光照,菖蒲成株根系不同部位均存在從根表面至沉積物氧飽和度由高到低的氧擴散層,照光條件下氧擴散層厚度為0.18—0.68mm、最大氧飽和度為42.9%,遮光條件下氧擴散層厚度為0.22—0.38mm、最大氧飽和度為 21.5%。

圖2 光照對菖蒲幼苗、成株根不同部位氧擴散能力的影響Fig.2 The influence of light on oxygen diffusion capacity in different root part of A.calamus seedling and adult A.calamus plant

圖3 光照對菖蒲幼苗、成株根不同部位氧擴散層厚度的影響Fig.3 The influence of light on oxygen diffusion layer thickness in different root part of A.calamus seedling and adult A.calamus plant

表3 光照對菖蒲幼苗、成株根不同部位氧擴散能力差異性影響Table 3 The influence of light on significant differences of oxygen diffusion capacity in different root part of A.calamus seedling and adult A.calamus plant
如圖2、圖3,光照對菖蒲成株根系不同部位氧擴散能力影響存在差異,照光處理根1/2、根3/4處氧擴散能力顯著強于遮光處理(P<0.01),根1/2處氧擴散層厚度及最大氧飽和度分別為0.68mm和42.9%,為遮光處理的1.79倍和2倍,根3/4處氧擴散層厚度及最大氧飽和度分別為0.52mm和22.5%,為遮光處理的1.53倍和1.8倍;根1/4、根1處,照光處理與遮光處理相比氧擴散能力則無顯著性差異(P>0.05)。
從根系泌氧空間差異上看(圖2,圖3,表3),照光處理時,菖蒲成株氧擴散能力具體表現為根1/2>根3/4>根1>根1/4(P<0.01),氧擴散層厚度及最大氧飽和度分別為 0.68、0.52、0.46、0.18mm 和 42.9%、22.5%、10.2%、6.4%;遮光處理時,菖蒲成株氧擴散能力具體表現為根 1/2>根 3/4≈根 1>根 1/4(P<0.01,P>0.05),氧擴散層厚度及最大氧飽和度分別為 0.38、0.34、0.36、0.22mm 和 21.5%、12.5%、10.6%、5.3%。
3 討論
已有研究表明,在白天,濕地植物莖葉的光合作用放氧是植物體內氧的最重要的供給機制,莖葉生物量及光合作用效率決定植株的光合產氧量及通氣量[3],植株光合作用產生的氧氣,一部分直接釋放到空氣或水中,一部分供自身呼吸作用消耗,還有一部分通過植物的通氣組織向下輸送到根系,并經由根系向底泥中釋放,而在夜間光合作用無法進行時,植物莖葉的氣體交換作用則能將大氣中的氧氣通過植物葉表面、莖桿等的孔隙進入植物體內,供植株呼吸或輸送釋放到底泥以維持根區的氧化狀態[18-20],這也與實驗中,無論有無光照,菖蒲幼苗、成株根系不同部位均存在從根表面至沉積物氧飽和度由高到低的氧擴散層的結果相一致。
實驗結果發現,在菖蒲幼苗、成株葉片光合速率無顯著差異的情況下,無論有無光照,除根1/4處外,其余根不同部位氧擴散能力菖蒲成株較幼苗均顯著增強(P<0.01),這主要與莖葉光合作用、通氣作用面積顯著增加有關,菖蒲成株株高、葉寬均顯著高于菖蒲幼苗(P<0.01)(表2),此外,根系泌氧還與根系生物量密切相關[21],菖蒲成株平均根長、根直徑均顯著高于菖蒲幼苗(P<0.01)(表2),根系泌氧面積顯著增加。而菖蒲幼苗根1/4處氧擴散層厚度、最大氧飽和度與菖蒲成株相比無顯著差異(P>0.05)則可能與根基產生泌氧屏障(ROL barrier)有關,濕地植物在缺氧的底質環境中,植物為了保證氧氣能夠擴散到根尖區域,在根基區產生泌氧屏障[1],通常在根表和皮層之間存在若干層厚壁細胞,避免大量的氧氣在運輸過程中通過根軸向沉積物擴散,并有利于抑制沉積物中過量的有毒物質通過根被植物吸收,起到脫毒作用,根系表現出根基部泌氧較根其它部位明顯減少,且趨于穩定[22]。
光照增強了植物的光合作用和蒸騰作用[23-24],蒸騰作用增強了植物內部的高濕度,同時加大了濕度誘導的壓強梯度和加快了氣體從大氣中進入植物體內。植物體內溫度升高,提高了熱力學誘導滲透作用,加快了氣體對流速度,而這些均可以增加根系泌氧量[24],實驗結果也發現,菖蒲幼苗根1/2處、菖蒲成株根1/2、根3/4處氧擴散能力照光處理顯著高于遮光處理(P<0.01),但照光對菖蒲幼苗、成株根其它部位氧擴散能力則無顯著性影響(P>0.05),根基(根1/4處)泌氧屏障能有效減弱光照對其泌氧影響,而根尖(根1處)照光處理與遮光處理氧擴散能力無顯著差異則可能與植物的夜間生長機制有關,有研究表明植物在夜間依然能保持較高的生長速率[25],為此植株夜間可能通過給根尖供氧,保持適宜的氧飽和度促進細胞分裂伸長、保持呼吸作用和代謝速率。照光對菖蒲幼苗根3/4處泌氧無影響則可能與菖蒲幼苗根系尚在發育階段、根3/4處具有根尖(根1處)的相關功能有關,實驗結果也表明其根直徑(0.04cm)與根1處(0.03cm)相比無顯著差異(圖1)。
從根系泌氧空間差異上看,照光條件下菖蒲幼苗、成株分別表現為根1/2>根3/4≈根1≈根1/4(P<0.01,P>0.05)和根1/2>根3/4>根1>根1/4(P<0.01),遮光條件下菖蒲幼苗、成株分別表現為根1/2≈根 3/4≈根 1≈根1/4(P>0.05)和根1/2>根3/4≈根1>根1/4(P<0.01,P>0.05)。除根1/4 處泌氧能力最小主要與其產生泌氧屏障相關外,根其它部分空間差異可能與根系生物量差異有關,通過對不同部位根系直徑發育情況分析發現(圖1),作為根莖型植物的菖蒲,其根系靠近基部部分直徑顯著高于靠近根尖部分,菖蒲成株根1/2、3/4、根1的直徑為根1/4的86.7%、53.3%、26.7%(圖1),導致靠近根尖處根系泌氧面積顯著下降,進而影響根系泌氧擴散范圍,通過對菖蒲幼苗、成株在照光、遮光條件下根1/2、根3/4、根1處最大氧飽和度與根直徑進行相關性分析后發現(圖4),菖蒲成株在照光、遮光條件下均呈顯著正相關,而菖蒲幼苗在照光條件下呈正相關,遮光條件下不相關,表明根系泌氧能力越強,根系泌氧空間差異受根系生物量差異影響就越顯著,相反,根系生物量差異將不會導致根系泌氧空間差異,如菖蒲幼苗在遮光條件下根系不同部位氧擴散能力無顯著性差異(P>0.05)。
4 結論
無論有無光照,菖蒲幼苗、成株根系不同部位均存在從根表面至沉積物氧飽和度由高到低的氧擴散層,氧擴散層厚度在0.18—0.68mm間變化;根1/2、3/4、1處氧擴散能力菖蒲成株較幼苗顯著增強(P<0.01),根1/4處二者則無顯著差異(P>0.05);光照對菖蒲幼苗、成株根系不同部位氧擴散能力的影響存在差異,光照對菖蒲幼苗根1/2及菖蒲成株根1/2、根3/4處影響顯著(照光組顯著高于遮光組,P<0.01),而對菖蒲幼苗根1/4、根3/4、根1及菖蒲成株根1/4、根1處無顯著影響(P>0.05);從根系泌氧空間差異上看,照光條件下菖蒲幼苗、成株分別表現為根1/2>根3/4≈根1≈根1/4(P<0.01,P>0.05)和根 1/2>根 3/4>根 1>根 1/4(P<0.01),遮光條件下菖蒲幼苗、成株分別表現為根1/2≈根3/4≈根1≈根1/4(P>0.05)和根1/2>根3/4≈根1>根1/4(P<0.01,P>0.05)。
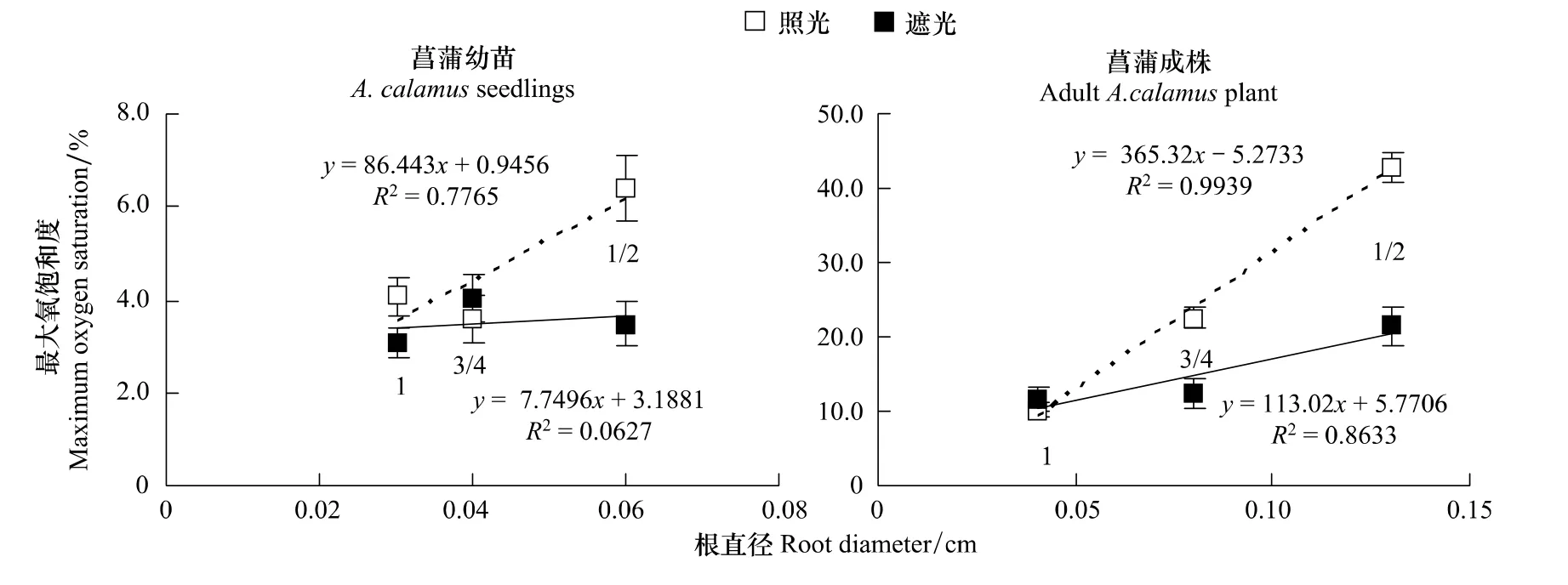
圖4 菖蒲幼苗、成株在照光、遮光條件下根1/2、根3/4、根1處最大氧飽和度與根直徑的相關性Fig.4 Correlation between maximum oxygen saturation and root diameter in root 1/2,3/4,1 of A.calamus seedling and adult A.calamus plant under light or dark condition
[1] Armstrong W.Aeration in higher plants.Advances in Botanical Research,1979(7):225-332.
[2] Gilbert B,Fenzel P.Rice roots and methane oxidation:the activity of bacteria,their distribution and the microenvironment.Soil Biology and Biochemistry,1998,30:1903-1916.
[3] Visser E J W,Comler T D,Blom C P W M,et al.Changes in growth,porosity,and radial oxygen loss from adventious roots of selected mono-and dicotyledonous wetland species with contrasting types of aerenchyma.Plant,Cell and Environment,2000,23:1237-1245.
[4] Mendelssohn I A,Kleiss B A,Wakeleyj S.Factors controlling the formation of oxidized root channels:a review.Wetlands,1995,15:37-46.
[5] Hansel C M,Fendorf S,Sutton S.Characterization of Fe plaque and associated metals on the roots of Mine-waste impacted aquatic plants.Environmental Science and Technology,2001,35:3863-3868.
[6] Armstrong J,Armsrtong W,Beckeet P M.Phramites australlis:Venturi-and humidity-induced convections enhance rhizome aeration and rhizosphere oxidation.New Phytologist,1992,120:197-207.
[7] Connell E L,Colmer T D,Walker D I.Radial oxygen loss from intact roots of Halophila ovalis as a function of distance behind the root tip and shoot illumination.Aquatic Botany,1999,63(3):219-228.
[8] Flessa H.Plant-induced changes in the redox potential of the rhizosphere of the submerged vascular macrophytes Myriophyllum verticillatum L.and Ranunculus circinatus.Aquatic Botany,1994,47:119-129.
[9] Waters I,Armstrong W,Thompson C J.Diurnal changes in radial oxygen loss and ethanol metabolism in roots of submerged and non-submerged rice seedlings.New Phytologist,1989,113(4):439-451.
[10] Inoue T M,Tsuchiya T.Interspecific differences in radial oxygen loss from the roots of three Typha species.Limnology,2008,9(3):207-211.
[11] Deng H,Ye Z H,Huang M H.Characteristics of radial oxygen loss from root of wetland plants.Journal of East China Normal University(Natural Science),2007,6:69-76.
[12] Sand-Jensen K,Revsbech N P,Barker J?rgensen B.Microprofiles of oxygen in epiphyte communities on submerged macrophytes.Marine Biology,1985,89(1):55-62.
[13] Laskov C,Horn O,Hupfer M.Environmental factors regulating the radial oxygen loss from roots of Myriophyllum spicatum and Potamogeton crispus.Aquatic Botany,2006,84(4):333-340.
[14] Lu D M.Hydrophytic Biology of Freshwater.Suzhou:Suzhou University Press,2002.46.
[15] Bilger W,Bjêrkman O.Role of the xanthophyll cycle in photoprotection elucidated by measurements of light induced absorbance changes,fluorescence and photosynthesis in leaves of Hedera canariensis.Photosynth Res,1990,25:173-185.
[16] Schreiber U,Bilger W,Neubauer C.Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis.Ecol Studies,1994,100:49-70.
[17] Colmer T D.Long-distance transport of gases in plants:aperspective on internal aeration and radial oxygen loss from roots.Plant Cell and Environment,2003,26(1):17-36.
[18] Woolhouse H W W.Advances in Botanical Research,Vol.7 London:Academic Press 1979,225-332.
[19] Grosse W,Buchel H B,Tiebel H.Pressurized ventilation in wetland plants.Aquatic Botany,1991,39:89-98.
[20] Brix H,Sorrell B K,Orr P T.Internal pressurization and convective gas flow in some emergent freshwater macrophytes.Limnol.Oceanogr,1992,37:1420-1433.
[21] Cheng S P,Wu Z B,Xia Y C.Review on gas exchange and transportation in macrophytes.Acta Hydrobiologica Sinica,2003,(4):413-417.
[22] Armstrong J,Armstrong W.Rice and Phragmites:Effects of organic acids on growth root permeability and radial oxygen loss to the rhizosphere.American Journal of Botany,2001,88:1359-1370.
[23] Caffrey J M,Kemp W M.Seasonal and spatial patterns of oxygen production,respiration and root rhizome release in potamogeton-perfoliatus I and zostera-marina L.Aquatic Botany,1991,40(2):109-128.
[24] Frenzel P,Rothfuss F,Conrad R.Oxygen profiles and methane turnover in a flooded rice microcosm.Biology and Fertility of Soils,1992,14(2):84-89.
[25] Shimizu H,Heins R D.Computer-vision-based system for plant growth analysis.Transactions of the ASAE,1995,38(3):959-964.
參考文獻:
[11] 鄧泓,葉志鴻,黃銘洪.濕地植物根系泌氧的特征.華東師范大學學報(自然科學版),2007,6:69-76.
[14] 盧德敏.淡水生物學.蘇州:蘇州大學出版社,2002.46
[21] 成水平,吳振斌,夏宜埠.水生植物的氣體交換與輸導代謝.水生生物學報,2003,(4):413-417.

