大鼠在力竭運動中“黑質-丘腦-皮層”通路的調控作用
胡琰茹, 劉曉莉, 喬德才
(北京師范大學體育與運動學院,北京100875)
大腦對軀體運動的調控是通過錐體系和錐體外系2條下行傳導通路實現的。作為錐體外系傳導通路中的重要核團,基底神經節(主要包括紋狀體、蒼白球、黑質、杏仁核及丘腦底核等)接受來自大腦皮層的大量信息傳入,并將處理整合后的信息通過直接、間接和超直接通路回傳給大腦皮層,實現對運動皮層功能的調節[1]。這3條通路最后均經黑質網狀部(substantia nigra reticular,SNr)-丘腦腹外側核(ventrolateral nuleus,VL)的傳遞到達皮層輔助運動區(supplementary motor area,SMA),通路各相關核團神經元興奮性的凈變化以及相互作用關系可以反映基底神經節對皮層興奮性的調節作用[2-3]。為此,本實驗采用局部場電(local field potentials,LPFs)及皮層腦電(electrocorticography,ECoG)同步記錄技術,對一次性力竭運動中大鼠“黑質-丘腦-皮層”通路各核團的神經元電活動變化進行動態觀察,探討其對運動疲勞產生的調控作用。這不僅對于揭示基底神經節對運動疲勞的調控作用具有重要意義,而且可為進一步闡明運動疲勞的中樞機制,完善疲勞理論提供參考依據。
1 材料與方法
1.1 實驗對象 選用15只雄性Wistar大鼠,購自北京維通利華實驗動物技術有限公司,許可證號為SCXK(京)2002-2003,體重為(290 ±20)g,常規分籠飼養,自由進食飲水,自然光照,動物房內溫度為(20±3)℃,相對濕度為40%~60%。在給大鼠實施電極埋藏手術前先進行適應性跑臺訓練,每天一次,連續3 d。
1.2 金屬電極埋藏手術 用戊巴比妥鈉(50 mg/kg)將大鼠腹腔麻醉,俯臥位固定于腦立體定位儀上(SN-3N,日本成茂)。沿大鼠頭頂正中線做矢狀切口,暴露前、后囟及冠、矢狀縫等骨性標志,調整門齒高度,使前囟和后囟處在同一水平面上。依照Paxinos and Watson大鼠腦立體定位圖譜[4],分別在黑質網狀部、丘腦腹外側核及皮層輔助運動區對應的顱骨部位鉆孔(圖1A、B、C)。顯微鏡下掀去硬腦膜,用微推進器(PC-5N,日本成茂)分別將微電極(直徑90μm)植入左側黑質網狀部(A:-5.0,L:2.0,H:-7.5)和丘腦腹外側核(A:-2.5,L:2.0,H:5),將直徑1 mm 的不銹鋼鏍釘固定于左側輔助運動區(A:3.7,L:1.4,H:-0.5)對應部位[5],另在小腦上方(A:-10.0,L:0,H:- 0.5)放置地線。石蠟封閉顱骨表面手術窗口,牙科水泥固定,保證電極不隨動物的活動而松動,并注射地塞米松緩解術后腦水腫。術后恢復4~5 d,待手術引起的不良反應消失、飲食與行為正常后,開始恢復性的漸增負荷訓練,并使其逐漸適應測試系統導聯狀態下的跑臺運動。
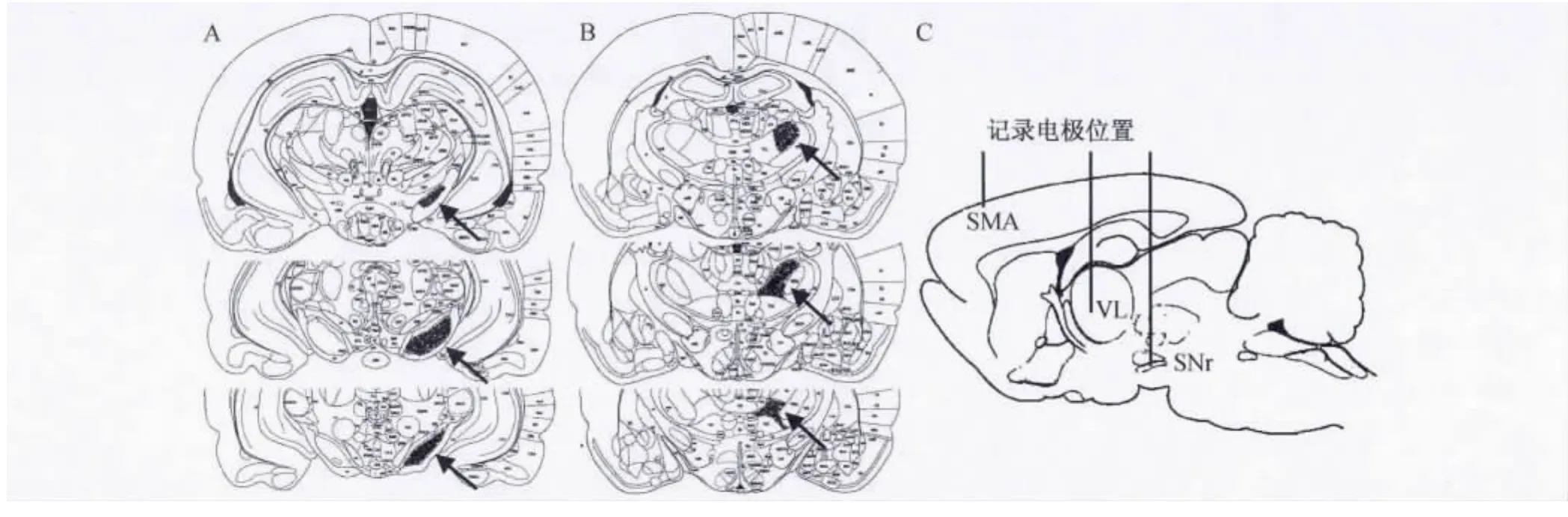
圖1 記錄電極位置示意Figure 1.Schematic Illustration of Location of Recording Electrode
1.3 大鼠力竭運動方案 當大鼠能以20 m/min速度跑30 min、未見不良反應時,次日可進行正式實驗。采用本實驗室根據Bedford方法改建的遞增負荷跑臺運動方案[6]讓大鼠進行力竭運動,負荷分為3級:Ⅰ級負荷為10 m/min,15 min;Ⅱ級負荷為 15 m/min,15 min;Ⅲ級負荷為20 m/min,運動至力竭。力竭判斷標準:大鼠跑姿由蹬地式變為伏地式,滯留在跑道末端不能繼續跑動,且聲波和光刺激均無法驅使其繼續維持跑動。
1.4 局部場電及皮層腦電信號的同步采集 大鼠開始運動之前,電極經導聯線與主放大器(Dagan EX4-400,美國)連接,導聯線靠近電極端包含一個多通道JFET前置放大器(headstage),用于消除運動過程中由于導線運動、纏繞造成的信號偽跡。跑臺電機由銅網屏蔽并接地,以消除跑臺工作過程中電機運轉引起的電磁干擾。預先植入的金屬微電極用以記錄黑質網狀部和丘腦腹外側核的神經元場電活動,另植入皮層輔助運動區的電極用以記錄皮層腦電活動。信號記錄采用差分模式,信號采集由PowerLab 8通道生理記錄儀(PowerLab 8/30,AD Instrument,澳大利亞)及自身所帶的軟件Chart 5(AD Instrument,澳大利亞)完成,采樣頻率為512 Hz,50 Hz數字陷波,主放大器硬件濾波設置為0.1~100 Hz,增益200。連續同步記錄大鼠安靜、一次力竭運動過程中和恢復期皮層腦電和局部場電的電信號。實驗完成后,實施常規冰凍切片取腦,并進行Nissl染色,對照大鼠腦立體定位圖譜鑒定金屬電極尖端所在位置,金屬微電極未同時準確植入黑質網狀部、丘腦腹外側核和皮層輔助運動區的數據將被刪除。
1.5 數據統計使用 Chart 5及 NeuroExplorer 4(Plexon,美國)離線分析軟件對原始波形進行頻譜分析,從大鼠力竭運動中的每一階段選取4個30 s的原始信號進行快速傅立葉轉換(fast fourier transform,FFT;welch法,FFT size:512),計算4個30 s信號的平均值代表各階段局部場電和皮層腦電的電活動特征。力竭運動過程中每隔15 min取30 s局部場電和皮層腦電信號,通過計算各頻段功率占總功率的百分比,得出功率值百分比。
運用SPSS 13.0軟件對所得數據進行統計分析,結果均用平均數±標準差表示。功率值百分比數據的比較用One-Way ANOVA分析,P<0.05表示組間差異顯著,P<0.01表示組間差異非常顯著。
2 研究結果
2.1 電活動變化特征及運動能力的階段劃分 實驗共用15只大鼠,實際記錄到有效信號的大鼠8只,納入數據統計,其余7只未記錄到有效信號而被剔除。在實驗過程中利用同步的方法所記錄到的黑質網狀部、丘腦腹外側核的局部場電及皮層腦電的原始波形如圖2所示。
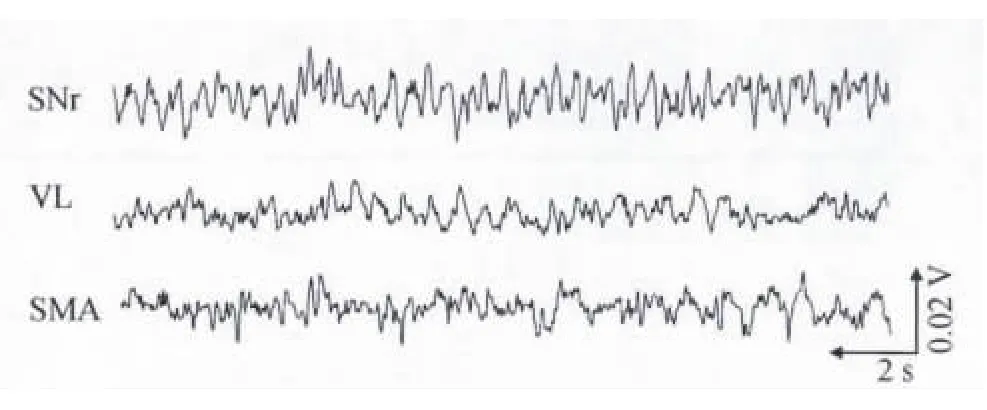
圖2 同步記錄大鼠局部場電及皮層腦電原始波形Figure 2.Raw Data Trace SimultaneouslyRecorded from ECoG and LFPs in Rats
在實驗中發現,大鼠的運動能力存在一定的個體差異[(93±23.6)min]。為便于分析,依據大鼠運動能力的外在表現將整個力竭運動過程劃分為4個階段[7],即自主運動期(大鼠在跑臺遞增負荷時能維持預定強度進行自主運動)、疲勞初期(當大鼠不能維持預定運動強度自主運動時,給予聲、光、電等外部刺激仍可維持原有強度繼續運動一段時間)、力竭期(給予大鼠外部刺激也無法維持預定強度,直至停止運動)和恢復初期(力竭后恢復至30 min)。在力竭運動的不同階段,大鼠的局部場電和皮層腦電原始電位波形表現出明顯的階段性變化特征(圖3A)。與安靜狀態相比,隨著力竭的出現,黑質網狀部局部場電的振幅逐漸減小,頻率逐漸增大;而丘腦腹外側核局部場電和皮層腦電的振幅逐漸增大,頻率逐漸減小。通過分析功率譜密度(power spectral density,PSD)發現,局部場電及皮層腦電均存在2種明顯的二次振蕩性電活動,一種為1~2 Hz的低頻振蕩;另一種為6~8 Hz的中頻振蕩(圖3B)。
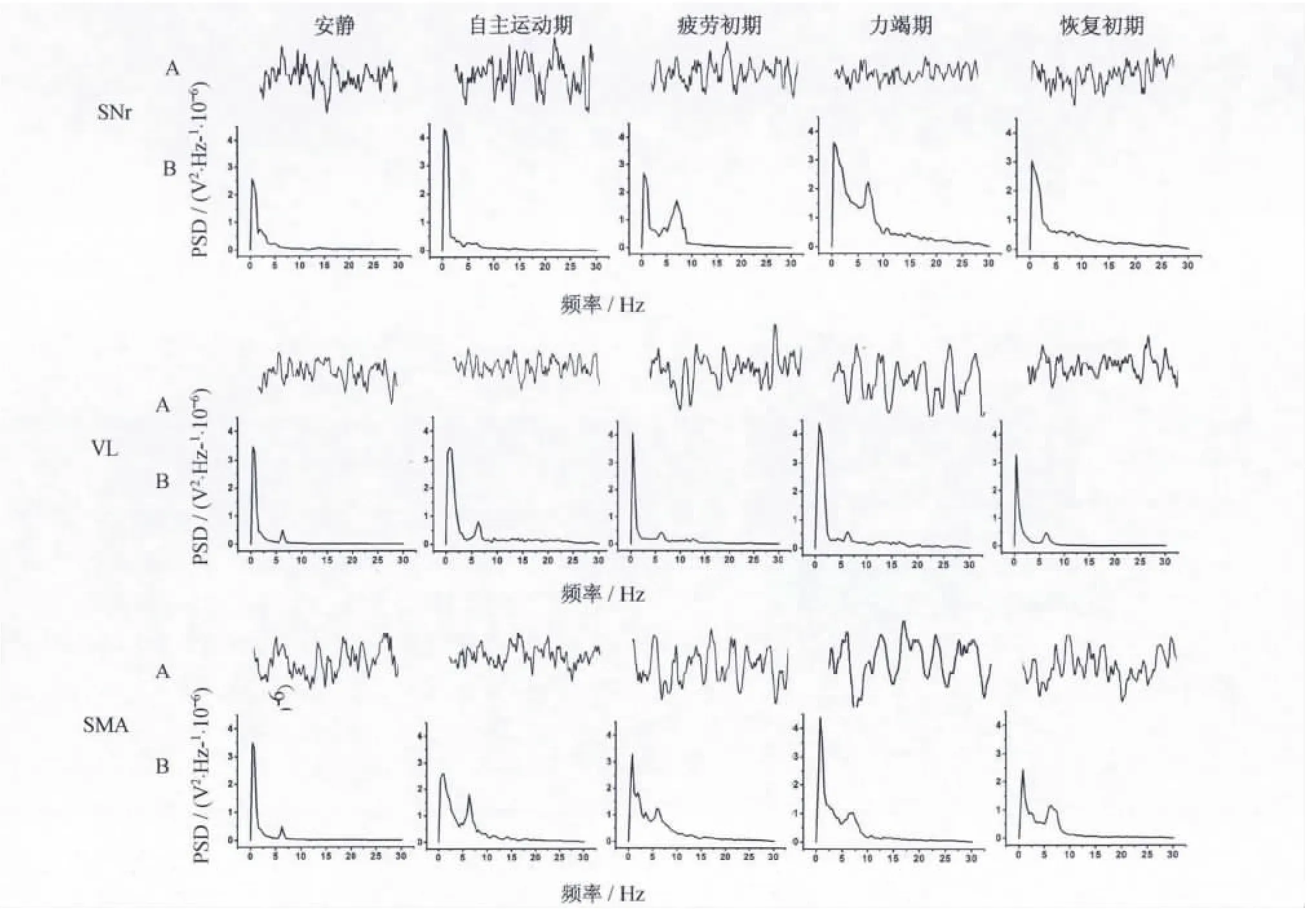
圖3 大鼠力竭運動中不同階段局部場電及皮層腦電活動特征Figure 3.Characteristic Diagram of ECoG and LFPs of Different Stages during the Exhausting Exercise in Rats
2.2 局部場電及皮層腦電頻段功率值百分比的動態變化 依據電活動的頻率特征,局部場電和皮層腦電可分為5 個頻段,即0.8 ~3.9 Hz(δ 波)、4~7.9 Hz(θ波)、8~12.9 Hz(α 波)、13~30 Hz(β 波)及30 Hz以上(γ波),其中,δ和 θ波稱為慢波,β和 γ波稱為快波[8]。通過對大鼠局部場電和皮層腦電各頻段功率值百分比的統計分析發現,各頻段功率值百分比的主要變化特點為δ、θ和α波的變化顯著(P<0.05),而β和 γ波的變化均不明顯(P>0.05)(圖4~圖7)。與安靜狀態相比,黑質網狀部局部場電在自主運動期的δ波和疲勞初期、力竭期的 α波顯著升高(P<0.05);丘腦腹外側核局部場電在自主運動期的α波和疲勞初期、力竭期的δ、θ波顯著升高(P<0.05),自主運動期的θ波顯著降低(P<0.05);皮層腦電在自主運動期的α波和疲勞初期、力竭期的δ、θ波顯著升高(P <0.05)。
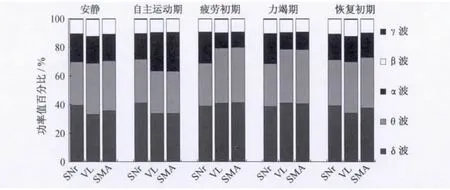
圖4 局部場電及皮層腦電各頻段功率值百分比變化Figure 4.Changes of the Power Ratio of Different Frequency Bands in ECoG and LFPs
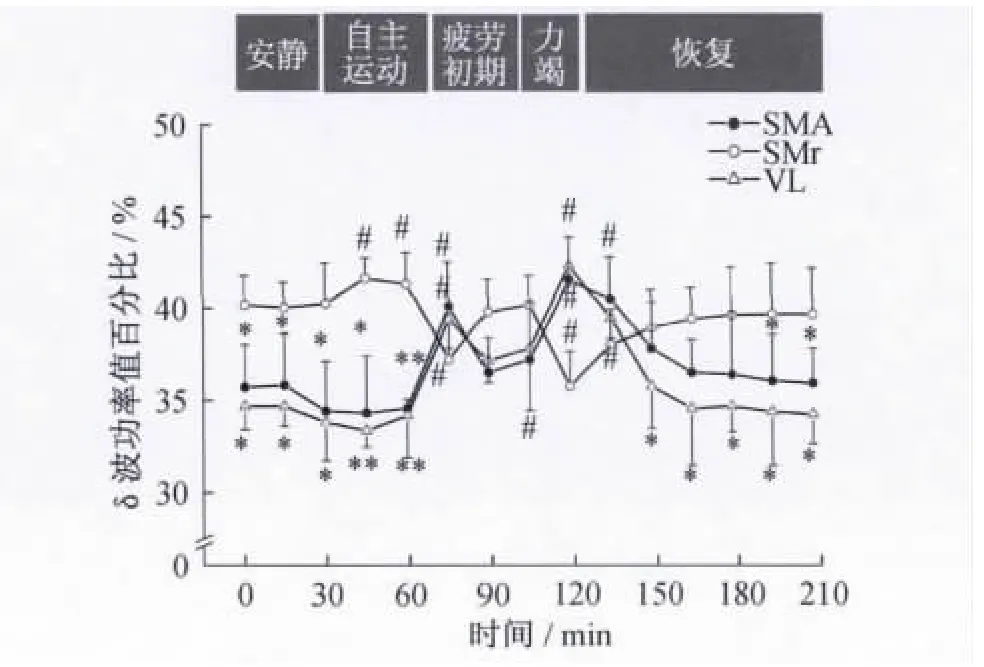
圖5 局部場電及皮層腦電δ波功率值百分比動態變化趨勢注:與安靜狀態相比,#表示P<0.05;與SNr的局部場電相比,* 表示 P <0.05,**表示 P <0.01,圖6~圖7同此。Figure 5.Dynamic Changes of Power Ratio of δBand in ECoG and LFPs
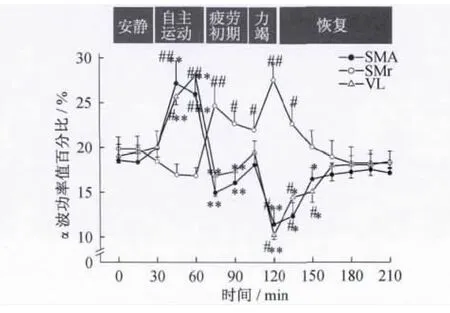
圖7 局部場電及皮層腦電α頻段功率值百分比動態變化趨勢Figure 7.Dynamic Changes of Power Ratio of αBand in ECoG and LFPs
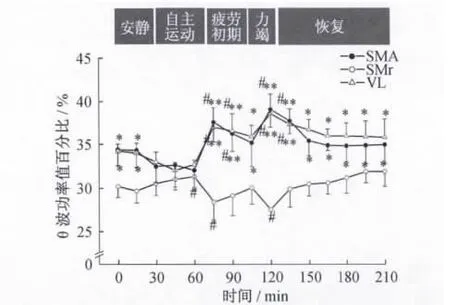
圖6 局部場電及皮層腦電θ波功率值百分比動態變化趨勢Figure 6.Dynamic Changes of Power Ratio of θBand in ECoG and LFPs
大鼠在一次性力竭運動中,δ、θ及α波功率值百分比動態變化的總趨勢為局部場電和皮層腦電均出現2個明顯的波峰,丘腦腹外側核與皮層走勢相同,而黑質網狀部走勢相反(圖5~圖7)。在2個波峰期,丘腦腹外側核、皮層與黑質網狀部相比均存在顯著性差異(P <0.05,P <0.01)。
3 討論
軀體運動的調控是在大腦皮層及皮層下主要神經核團的共同作用下實現的。大腦皮層是運動控制的最高級中樞,丘腦與基底神經節中的一些核團是調控運動的皮層下中樞,它們之間通過神經纖維投射構成了“基底神經節-丘腦-皮層”神經環路,通過核團之間神經信息的網絡聯系,實現運動的發起或停止[9-10]。
3.1 力竭運動中黑質網狀部、丘腦腹外側核及皮層輔助運動區電活動的特征 黑質是基底神經節內的重要核團之一,由黑質網狀部和黑質致密區構成。黑質網狀部與蒼白球內側部共同構成基底神經節的最后輸出核團,在整合基底神經節內3條通路的興奮性及調控皮層運動功能方面起重要作用。研究發現,大鼠在自主運動期時,黑質網狀部局部場電活動振幅增大,頻率減小,δ波震蕩性電活動顯著增多,神經元的興奮性明顯減弱;出現疲勞時,局部場電活動卻呈現出相反的變化趨勢,振幅減小,頻率增大,δ、θ波震蕩活動顯著減少,而α波震蕩活動顯著增多,神經元的興奮性明顯增強。相關文獻報道:黑質網狀部約80%的神經元放電增加會導致大肌肉群參與的身體運動能力下降[11];當帕金森病(parkinson’s disease,PD)模型大鼠[12]和癲癇模型大鼠[13]出現運動遲緩、肌肉僵直和靜止性震顫等臨床癥狀時,黑質網狀部神經元自發放電頻率也顯著增高,簇狀放電神經元比例增加,與運動疲勞時黑質網狀部電活動變化的特征相近似。大鼠疲勞時所出現的運動能力下降與黑質網狀部神經元興奮性增強有關。
丘腦位于間腦,對稱性地分布于第三腦室兩側,每側丘腦被丫形的白質板(內髓板)分隔成3團灰質或核團,即丘腦前核、內側核及外側核。丘腦外側核又可分為較小的背側部和較大的腹側部。丘腦腹外側核群,亦稱運動丘腦,是重要的感覺及運動中繼站。它與脊髓、腦干以及小腦有廣泛聯系,并發出纖維投射到大腦皮層的運動區,參與皮層對肌肉運動的調節[14],也是基底神經節信息投向皮層的最后中繼核團[15]。本研究發現,在力竭運動過程中,大鼠在自主運動期,丘腦腹外側核局部場電活動振幅減小,頻率增大,α波震蕩活動顯著增多,神經元興奮性明顯增強;但當大鼠出現疲勞時,該核團場電活動振幅增大,頻率逐漸減小,δ、θ波振蕩活動顯著增多,神經元興奮性明顯減弱;丘腦腹外側核神經元電活動變化與黑質網狀部呈相反趨勢,這與臨床上所發現的結果相類似。PD模型大鼠的丘腦腹外側核自發放電頻率降低,放電頻譜峰向低頻聚集[16],這從另一個角度證實,丘腦腹外側核在運動控制中發揮一定的作用。
大腦輔助運動區是運動控制的重要腦區,通過神經纖維聯系實現對脊髓運動神經元的控制[17]。另外,輔助運動區與皮層主運動區也有著非常廣泛的相互纖維投射聯系,其神經元興奮性的改變對運動能力具有重要影響。本研究發現,在力竭運動過程中,大鼠在自主運動期皮層輔助運動區腦電活動振幅減小,頻率增大,α波震蕩活動顯著增多,神經元的興奮性明顯增強;但當疲勞出現時,電活動振幅逐漸增大,頻率逐漸減小,δ、θ波振蕩活動顯著增多,說明在運動疲勞發生后輔助運動區激活減弱,神經元興奮性顯著下降。這與本實驗室前期的研究結果相同[7,18-19]。Liu 等[20]采用功能性磁共振成像技術也證實了這一現象的存在。
3.2 力竭運動中“黑質-丘腦-皮層”通路各核團的相互調控作用 在力竭運動中,“黑質-丘腦-皮層”通路各核團的相互聯系主要是通過神經遞質的調控作用實現的。黑質網狀部接收來自紋狀體、蒼白球外側部的γ-氨基丁酸(GABA)能神經纖維投射,以及來自丘腦底核的谷氨酸(Glu)能神經纖維投射,大鼠出現力竭時黑質網狀部神經元電活動的凈變化表現為興奮性增強,增加向丘腦腹外側核釋放神經遞質GABA的量,使丘腦腹外側核神經元興奮性減弱,進而減少向皮層輔助運動區釋放神經遞質Glu的量,從而抑制了皮層輔助運動區神經元的興奮性,最終導致運動能力的下降和疲勞的發生[21]。
我們推測,“黑質-丘腦-皮層”神經通路各核團神經遞質GABA和Glu的釋放量改變導致該通路功能失衡,進而發生運動疲勞。臨床上的相關研究也發現,該神經通路的功能失衡會引發PD大鼠肌張力障礙,也與黑質網狀部GABA能神經投射增強,抑制了丘腦-皮層Glu能神經投射,并降低相應皮層運動區神經元興奮性有關[22-23]。PD病人出現運動無能癥狀時會伴有皮層腦電活動的興奮性降低[24-25]。采用高頻電刺激皮層輔助運動區又可緩解PD癥狀[26]。亨廷頓舞蹈癥(huntington’s disease,HD)是一種遲發性神經退行性遺傳病,主要臨床表現為病人出現偏側舞蹈樣癥狀,其原因為紋狀體神經元病變、減少神經遞質GABA的釋放,抑制了間接通路,增強了丘腦腹外側核-皮層通路Glu能神經投射,引發運動過度[27]。PD和HD的病理機制進一步證實,“黑質-丘腦-皮層”通路在整合基底神經節各核團的神經信息傳遞及調控運動皮層的功能方面具有重要作用。
4 小結
在力竭運動中,大鼠“黑質-丘腦-皮層”通路神經元的電活動出現明顯的階段性特征,皮層與丘腦腹外側核電活動變化趨勢相同;但與黑質網狀部相反。大鼠在自主運動期,黑質網狀部神經元興奮性減弱,降低對丘腦腹外側核神經元的抑制作用,使皮層興奮性增強;在力竭時,黑質網狀部神經元興奮性增強,抑制了丘腦腹外側核神經元的興奮性,進而對皮層神經元產生去興奮作用,最終導致運動能力的下降。“黑質-丘腦-皮層”通路功能失調是導致力竭及運動能力下降的重要因素之一。
[1] Middleton F A,Strick P L.Basal Ganglia and Cerebellar Loops:Motor and Cognitive Circuits[J].Brain Res Rev,2000,31(2 -3):236 -250
[2] Nybo L,Secherb N H.Cerebral Perturbations Provoked by Prolonged Exercise[J].Prog Neurobiol,2004,72(4):223-261
[3] Chaudhuri A,Behan P O.Fatigue and Basal Ganglia[J].J Neurol Sci,2000,179(1 -2):34 -42
[4] Paxinos G,Watson C.The Rat Brain in Stereotaxic Coordinates[M].San Diego:Academic,1997:26 - 30,36 -37,39 -43
[5] Taib N O B,Manto M.Effects of Trains of High-Frequency Stimulation of the Premotor/Supplementary Motor Area on Conditioned Corticomotor Responses in Hemicerebellectomized Rats[J].Exp Neurol,2008,212(1):157-165
[6] 劉曉莉,羅勇,喬德才.大鼠一次性力竭跑臺運動模型的建立與動態評價[J].中國實驗動物學報,2012,20(3):25-28
[7] 王大磊,劉曉莉,喬德才.大鼠力竭運動中丘腦底核和皮層神經元電活動的變化[J].中國應用生理學雜志,2011,27(3):262 -266
[8] Lindberg N,Tani P,Virkkunen M,et al.Quantitative Electroencephalographic Measures in Homicidal Men with Antisocial Personality Disorder[J].Psychiat Res,2005,136(1):7-15
[9] Groenewegen H J.The Basal Ganglia and Motor Control[J].Neural Plast,2003,10(1 -2):107 -120
[10] Nambu A,Tokuno H,Takada M.Functional Significance of the Cortico-Subthalamo-Pallidal‘Hyperdirect’ Pathway[J].Neurosci Res,2002,43(2):111 -117
[11] Gulley J M,Kosobud A E K,Rebec G V.Behavior-Related Modulation of Substantia Nigra Pars Reticulata Neurons in Rats Performing a Conditioned Reinforcement Task[J].Neurosci,2002,111(2):337 -349
[12] Burbaud P,Gross C,Benazzouz A,et al.Reduction of Apomorphine-Induced Rotational Behaviour by Subthalamic Lesion in 6-ONDA Lesioned Rats is Associated with a Normalization of Firing Rate and Discharge Pattern of Pars Reticulata Neurons[J].Exp Brain Res,1995,105(1):48 -58
[13] Gemert M,Fedrowitz M,Wlaz P,et al.Subregional Changes in Discharge Rate,Pattern,and Drug Sensitivity of Putative GABAergic Nigral Neurons in the Kindling Model of Epilepsy[J].Eur J Neurosci.2004,20(9):2377 - 2386
[14] Sommer M A.The Role of the Thalamus in Motor Control[J].Curr Opin Neurobiol,2003,13(6):663 -670
[15] Haber SN,Calzavara R.The Cortico-Basal Ganglia Integrative Network:the Role of the Thalamus[J].Brain Res Bull,2009,78:69 -74
[16] 張貝,何德富,東春陽,等.魚藤酮腦內注射對大鼠行為和VL核神經元電活動的影響[J].華東師范大學學報,2006,11(6):53 -58
[17] Nachev P,Kennard C,Husain M.Functional Role of the Supplementary and Pre-Supplementary Motor Areas[J].Nat Rev Neurosci,2008,9:856 -869
[18] Dalei W,Xiaoli L,Decai Q.Modulatory Effect of Subthalamic Nucleus on the Development of Fatigue during Exhausting Exercise:an in Vivo Electrophysiological and Microdialysis Study in Rats[J].J Sport Sci Med,2012(11):286-293
[19] 楊東升,劉曉莉,喬德才.大鼠運動性疲勞形成和恢復過程ECoG的動態研究[J].體育科學,2012,32(4):53-59
[20] Liu JZ,Shan Z Y,Zhang L D,et al.Human Brain Activation during Sustained and Intermittent Submaximal Fatigue Muscle Contractions:an fMRI Study[J].J Neurophysiol,2003,90(1):300 -312
[21] Obeso J A,Rodriguez-Oroz M C,Rodriguez M,et al.Pathophysiology of Levodopa-Induced Dyskinesias in Pakinsion Disease:Problems with the Current Model[J].Ann Neurol,2000,47(suppl 1):S22 - S34
[22] Alexxai V K,Benjamin SF,Philip R L P,et al.Regulation of Parkinsonian Motor Behaviours by Optogenetic Control of Basal Ganglia Circuitry[J].Nature,2010,466(29):622 -626
[23] Lewis SJ,Barker R A.Understanding the Dopaminergic Deficits in Parkinson’s Disease:insights Into Disease Heterogeneity[J].JClin Neurosci,2009,16(5):620 - 625
[24] Nambu A. A New Approach to Understand the Pathophysiology of Parkinson’s Disease[J].J Neurol,2005,252(Suppl 4):iv1 -iv4
[25] Camicioli R M,Hanstock CC,Bouchard T P,et al.Magnetic Resonance Spectroscopic Evidence for Pre-Supplementary Motor Area Neuronal Dysfunction in Parkinson’s Disease[J].Movement Disord,2007,22(3):382 -386
[26] Hamada M,Ugawa Y,Tsuji S.High-Frequency rTMS Over the Supplementary Motor Area for Treatment of Parkinson’s Disease[J].Movement Disord,2008,23(11):1524 -1531
[27] Eidelberg D,Surmeier D J.Brain Networks in Huntington Disease[J].JClin Invest,2011,121(2):484 - 492

