水通道蛋白對動物適旱性作用的研究進展
于偉江 張建萍
(塔里木大學生命科學學院/新疆生產(chǎn)建設兵團塔里木盆地生物資源保護利用重點實驗室,新疆阿拉爾 843300)
水是生命之源。水分參與了生物從出生到衰老死亡過程中幾乎所有的生命活動。對于干旱區(qū)的生物來說水更為珍貴,如何能高效地利用有限的水資源決定著其生命能否繼續(xù)下去。水通道蛋白(Aquaporin,AQP)是一族細胞膜上高效轉(zhuǎn)運水分子的特異孔道蛋白,其種類和表達與水的分泌、吸收及細胞內(nèi)外水的平衡有非常密切的關系[1]。水通道蛋白構(gòu)成水分轉(zhuǎn)運的特異性通道,能增強細胞膜對水分的通透性。
1 水通道蛋白的發(fā)現(xiàn)及命名
1988年,Agre等在鑒定人紅細胞Rh血型抗原物質(zhì)時,偶然發(fā)現(xiàn)了一種分子質(zhì)量(Mr)為28 kDa的整合膜蛋白。氨基酸測序發(fā)現(xiàn)該蛋白和眼晶狀體主體內(nèi)在蛋白(major intrinsic protein,MIP)具有高度同源性,因此有了暫時的名稱通道膜整合蛋白CHIP(Channel-like integral membrane protein)。并根據(jù)其Mr命名該蛋白為:形成通道的28 kDa膜整合蛋白,簡稱 CHIP28[2]。1991 年,他們完成了CHIP28的cDNA分子克隆,闡明了其cDNA的分子組成[3]。在功能鑒定時,他們將體外反轉(zhuǎn)錄合成的CHIP28 cDNA注入非洲爪蟾卵母細胞中,在低滲溶液中觀察卵母細胞的膨脹度,發(fā)現(xiàn)表達了該基因的卵母細胞體積迅速增加,并于5 min內(nèi)破裂[3]。為進一步確定CHIP28的功能,研究人員又將其重構(gòu)于人工合成的脂質(zhì)體,通過獲得的活化能及滲透系數(shù)的數(shù)據(jù)表明,該脂質(zhì)體對水表現(xiàn)出極高的通透性,但不通透其它小分子[4]。基于CHIP28這些明確的水轉(zhuǎn)運功能,有人推薦使用“水孔蛋白(aquaporin)”這一名稱。1997年,該蛋白被基因組命名委員會正式命名為Aquaporin-1(AQP1)。Agre本人由于這項奠基性的工作被授予諾貝爾化學獎。隨著研究的不斷深入,不斷有新的AQP被發(fā)現(xiàn),迄今為止,在哺乳動物體內(nèi)已經(jīng)發(fā)現(xiàn)13種水通道蛋白(AQP0~AQP12),統(tǒng)稱為 aquaporin(AQP)[5]。這 13 種 AQP在通透水的功能上有著相似之處,但由于表達部位不同,因而又各自發(fā)揮著特異的生理功能。
2 水通道蛋白的分子結(jié)構(gòu)
哺乳動物水通道蛋白的分子大小在26 000 000~34 000 000范圍之內(nèi),其氨基酸序列同源性為19% ~52%[6]。因AQP是一類保守的疏水小分子整合膜蛋白,各種亞型三維結(jié)構(gòu)相似,常以AQP1的結(jié)構(gòu)作為代表。人AQP1基因位于第10號染色體,褐家鼠AQP1基因位于第4號染色體。AQP1的單體是一條由269個氨基酸殘基構(gòu)成的肽鏈,該單肽鏈在細胞膜上往返形成6個跨膜的α螺旋,并在胞內(nèi)外形成5個環(huán)(A~E loop)。A、C及E環(huán)位于胞外,B和D環(huán)及肽鏈的N端和C端都位于胞內(nèi)。目前,被人們廣為接受的AQP1單體分子的三維結(jié)構(gòu)為“沙漏”模式[6]:肽鏈中的B環(huán)和E環(huán)具有高度保守的NPA(Asn-Pro-Ala)特征性序列,分別位于細胞內(nèi)和細胞外的疏水B環(huán)和E環(huán)向脂質(zhì)雙分子層中打折,兩個NPA序列在折疊中形成一個供水分子通過的孔道。插入突變NPA區(qū)域后AQP1的水通道功能就喪失了,說明NPA區(qū)域具有重要的功能意義[7]。幾乎所有AQP分子的B環(huán)和E環(huán)上都存在高度保守的NPA特征性序列。然而也存在例外情況:在AQP11和AQP12中僅發(fā)現(xiàn)E環(huán)上具有NPA序列,另一個在 B環(huán)上的 NPA序列分別由 NPC(Asn-Pro-Cys)和 NPT(Asn-Pro-Thr)替代[8]。對AQP1晶體學數(shù)據(jù)分析表明,水孔蛋白由4個亞基組成四聚體(圖1A),每個亞基都有6個跨膜α螺旋組成(圖1B和C)。每個水孔蛋白亞基單獨形成一個供水分子運動的中央孔,孔的直徑稍大于水分子的直徑,約0.28 nm,水孔長約2 nm。研究發(fā)現(xiàn),水分子的跨膜轉(zhuǎn)運是通過水孔蛋白亞基的中心通道實現(xiàn)的,不是通過四聚體的中央孔洞(4個亞基銜接處的中心縫隙)[9]。盡管現(xiàn)在還沒有完全揭示為何AQP1在對水分子快速通過的同時能有效阻止質(zhì)子的通過,表現(xiàn)出對水分子的特異通透性,但已有的數(shù)據(jù)表明,這種特異性與兩個半跨膜區(qū)NPA序列有關。AQP1中央孔的孔徑無法通過比水分子大的物質(zhì),而兩個NPA中的Asn殘基所帶的正電荷也排斥了質(zhì)子的通過,因此,AQP1是一個高度特異的親水通道。
3 水通道蛋白的分布及生理功能
應用免疫電鏡、免疫組織化學、反轉(zhuǎn)錄PCR、實時熒光定量PCR、原位雜交、免疫印跡等方法,發(fā)現(xiàn)水通道蛋白廣泛分布于機體的組織細胞中,尤其在與液體分泌和吸收有關的上皮細胞及內(nèi)皮細胞中表達較多。在哺乳動物體內(nèi)AQP的13種亞型,即AQP0~AQP12(表1)。依據(jù)它們的基因結(jié)構(gòu)和通透性,將它們劃分為3組:傳統(tǒng)水通道蛋白(包括AQP0~2、AQP4~6及 AQP10)、甘油水通道蛋白(包括 AQP3、AQP7及 AQP9)和未明確分類的AQP8、AQP11 及 AQP12[11]。
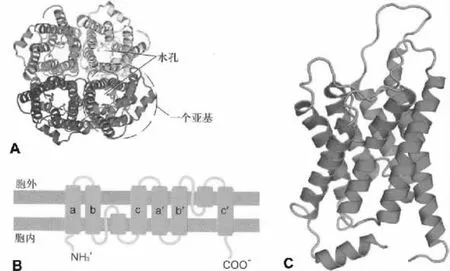
圖1 水通道蛋白的分子結(jié)構(gòu)[10]

表1 水通道蛋白成員的組織分布及功能
4 水通道蛋白與動物的適旱性
每種AQP都有其獨特的組織分布和細胞表達位置,以滿足機體對水分的需要。在肺的水代謝方面,Ma等[12]和 Bai等[13]發(fā)現(xiàn)與野生型小鼠相比,AQP1或AQP5基因敲除小鼠肺內(nèi)水轉(zhuǎn)運被抑制高達90%,AQP1和AQP5基因共同敲除小鼠肺內(nèi)水轉(zhuǎn)運進一步被抑制50%,這些結(jié)果說明AQP在肺泡水分轉(zhuǎn)運中起重要作用。King等[14]研究證明AQP1是肺血管通透性的決定因素。Song等[15]證明AQP5基因敲除小鼠其氣道粘膜下腺分泌液減少。Yasui等[16]發(fā)現(xiàn)在生產(chǎn)期間,大鼠肺 AQP1、AQP4及AQP5 mRNA表達量增加,提示這些AQP可能與清除肺水有關。
在腎水代謝方面,Ma等[17]發(fā)現(xiàn)與野生型小鼠相比,AQP1基因敲除小鼠表現(xiàn)出多飲和多尿的癥狀,若限制飲水則會引起機體嚴重脫水,同時尿濃縮能力也嚴重受損。Chou等[18]離體實驗證明,AQP1缺失將導致腎臟近曲小管和亨勒袢降支細段通透性降低,重吸收水分的能力降低。AQP2是腎臟重吸收水分濃縮尿液從而調(diào)節(jié)機體水平衡的主要分子基礎,AQP2只存在于集合管(CD)中,在其他部位未見表達,而CD是尿液分泌最后的決定性部位,這決定了AQP2對腎臟水調(diào)節(jié)獨特的作用。Sasaki等[19]研究發(fā)現(xiàn)缺水口渴可使AQP2 mRNA在腎臟的表達量增加。Tsumura等[20]發(fā)現(xiàn)多飲水影響AQP2基因的轉(zhuǎn)錄而導致其表達下降。AQP3分布于腎皮質(zhì)到腎乳頭的整個CD系統(tǒng)中,AQP4則主要表達于主細胞的基底膜。AQP3和AQP4共同對由AQP2轉(zhuǎn)運進入細胞內(nèi)的水分起分散作用。Kim等[21]研究發(fā)現(xiàn)與野生型小鼠相比,AQP3基因敲除小鼠的飲水量和尿量增加12倍以上,出現(xiàn)嚴重尿崩癥和尿濃縮障礙的癥狀。
在消化道的水代謝方面,每天在人類的消化道的液體轉(zhuǎn)運量有8~10 L之多,而且至少有7種水通道在消化道上皮表達。Ma等[22]發(fā)現(xiàn)就盲腸糞便中水分含量,AQP4基因敲除小鼠和野生型小鼠之間沒有差別,但排瀉的糞便中的水分含量差異顯著,AQP4基因敲除小鼠排瀉的糞便中的水分含量明顯升高。Wang等[23]在體結(jié)腸灌流實驗證明,AQP4基因敲除小鼠,其結(jié)腸上皮水的通透性明顯降低,證明AQP4參與結(jié)腸液體中水分的重吸收。這些研究表明,AQP的表達與肺泡水分轉(zhuǎn)運、尿的濃縮、排泄糞便中水分含量的多少等都有緊密的關系。然而,AQP在野生動物適應干旱環(huán)境中的作用尚未見報道。
干旱區(qū)野生動物的生存環(huán)境極度干旱。自然選擇是生物進化的驅(qū)動力。面對壓力環(huán)境,生物會進化為不同環(huán)境下所特有的分類群或生存特征[24]。這種針對壓力環(huán)境所產(chǎn)生的適應性反應可以導致加快生物譜系的進化或者特定壓力敏感蛋白的進化。因此環(huán)境壓力可以加速特定壓力敏感蛋白的進化速率,產(chǎn)生針對特定環(huán)境的新功能或?qū)υ泄δ艿募訌姡商岣邉游飳@種壓力環(huán)境的適合度[25]。正如Yang等[26]發(fā)現(xiàn)青藏高原的高原鼠兔(Ochotona curzoniae)在寒冷壓力的作用下,其瘦素蛋白(leptin)發(fā)生了適應性的功能進化,產(chǎn)生了新的功能或加強了原有功能。筆者的前期研究工作發(fā)現(xiàn),塔里木盆地的塔里木兔(Lepus yarcandensis)在干旱壓力的作用下,其腎臟AQP1和AQP2的表達比家兔強,并且表達的部位也更加廣泛,這有利于增強塔里木兔腎臟對水的重吸收能力,以保存體水。該研究結(jié)果表明,塔里木兔腎臟水通道蛋白對其適應干旱缺水的環(huán)境,具有重要作用。綜上所述,鑒于干旱區(qū)野生動物干旱缺水的生存環(huán)境及AQP在動物水代謝調(diào)節(jié)中的關鍵作用,推測在干旱區(qū)野生動物中,AQP可能作為一種干旱敏感蛋白,在動物對干旱環(huán)境的生態(tài)適應過程中起到了重要的作用。
致謝:中國科學院動物研究所王德華研究員對本文的撰寫提供了有益幫助,在此表示衷心的感謝。
[1]才麗平,趙金茹,林庶茹,等.水通道蛋白研究進展[J].解剖科學進展,2003,9(2):167 -170.
[2]Denker B M,Smith B L,Kuhajda F P,et al.Identification,purification,and partial characterization of a novel Mr28,000 integral membrane protein from erythrocytes and renal tubules[J].J.Biol.Chem,1988,(263):15634-16542.
[3]Preston G M,Agre P.Isolation of the cDNA for erythrocyte integral membrane protein of 28 kilodaltons:member of an ancient channel family[J].Proc.Natl.Acad.Sci.USA,1991,(88):11110 -11114.
[4]李敏,陳少軍,陳學群,等.腦水腫的AQP4調(diào)節(jié)機制研究進展[J].浙江大學學報(醫(yī)學版),2013,(1):60-64.
[5]Van Os CH,Deen P M T,Dempster J A.Aquaporins:Water selsction channels in biological membranes.Molecular structure and tissue distribution[J].Bipchim Biophy Acta,1994,(1197):291 -309.
[6]Jung J S,Preston G M,Smith B L,et al.Molecular structure of the water channel through aquaporin CHIP,the hourglass model.J Biol Chem,1994,269:14648—14654.
[7]Preston G M,Jung J S,Guggino W B,Agre P.Membrane topology of aquaporin CHIP28.Analysis of functional epitope - scanning mutants by vectorial proteolysis[J].Biol Chem,1994,269:1668 -1673.
[8]Morishita Y,Sakibe Y,Sasaki S,et al.Molecular mechanisms and drug development in aquaporin water channel diseases:aquaporin superfamily(superaquaporins):expansion of aquaporins restricted to multicellular organisms.J Pharmacol Sci,2004,96:276 -279.
[9]Murata K,Mitsuoka K,Hirai T,et al.Structural determinants of water permeation through aquaporin -1.Nature,2010,407:599 -605.
[10]翟中和,王喜忠,丁明孝,等.細胞生物學[M].北京:高等教育出版社,2011.71 -73.
[11]王晶,桑建利.水通道蛋白的基本結(jié)構(gòu)與特異性通透機理[J].生物學通報,2011,46(2):19-22.
[12]Ma T,F(xiàn)ukuda N,Song Y.Lung fluid transport in aquaporin -5 knockout mice[J].J Clin Invest,2000 ,105:93– 100.
[13]Bai C,F(xiàn)ukuda N,Song Y,et al.Lung fluid transport in aquaporin-1 and aquaporin-4 knockout mice[J].J Clin Invest,1999,103:555 – 561.
[14]King LS,Nielsen S ,Agre P,et al.Decreased pulmonary vascular permeability in aquaporin1 null human [J].Proc Natl Acad Sci USA,2012,99(2):1059 -1063.
[15]Song Y,Verkman AS.Aquaporin -5 dependent fluid secretion in airway submucosal glands[J].J Biol Chem,2011,276(44):41288 – 41292.
[16]Ya S M,Serlachius E,Lofgren M,et al.Perinatal changes in expression of aquaporin-4 and other water and ion transporters in rat lung[J].J Physiol,1997,505(pt 1):3-11.
[17]Ma T,Yang B,Gillespie A,et al.Severly impaired urinary concentrating ability in transgenic mice lacking aquaporin1 water channels[J].J Biol Chem,1998,273:4296– 4299.
[18]Chou C L,Knepper M A,Van Hoek A N,et al.Reduced waterpermeability and altered ultrastructure in thin dascending limb of henle in aquaprinl null mice[J].J Clin Ivest,1999,103(4):491 -496.
[19]Sasaki S,F(xiàn)ushimi K,Ishibashi K,et al.Water channels in the kidney collecting duct[J].Kidney Int,1995,48(4):1082-1087.
[20]Tsumura K,Li X,Murdiastuti K,et al.Downregulation of AQP2 expression in the kidney of polydipsic STR/N mice[J].Am J Physiol Renal Physiol,2006,290(2):F478-F485.
[21]Kim S W,Gresz V,Rojek A,et al.Decreased expression of AQP2 and AQP4 water channels and Na,K -ATPase in kidney collecting duct in AQP3 null mice [J].Biol Cell,2005,97(10):765 -778.
[22]Ma T,Jayaraman S,Wang K S,et al.Defective dietary fat processing in transgenic mice lacking aquaporin1 water channels[J].Am J Physiol Cell Physiol,2011,280(1):C126–1341.
[23]Wang K S,Ma T,F(xiàn)iliz F,et al.Colon water transport in transgenic mice lacking aquaporin4 water channels[J].Am J Physiol Gast rointest Liver Physiol,2010,279(2):G463– 4701.
[24]Huntley B,Webb T.Migration:Species’response to climatic variation caused by changes in the earth's orbit[J].J Biogeogr,1989,16:5 -19.
[25]Nei M.Selectionism and neutralism in molecular evolution [J].Mol BioI Evol,2005,22:2318 -2342.
[26]Yang J,Wang Z L,Zhao X Q,et al.Natural selection and adaptive evolution of leptin in the Ochotona family driven by the cold environmental stress[J].PLoS ONE,2008.3:e1472.

