殼聚糖-果膠鈣微球的制備及其體外溶脹釋放性的研究
楊 飛,周 華,夏書芹,譚 晨,張曉鳴
(江南大學食品學院,食品科學與技術國家重點實驗室,江蘇無錫214122)
隨著食品科技的發展和人們生活品質要求的不斷提高,如何高效吸收利用牛初乳免疫球蛋白、活性肽等具有生物活性的功能性食品成分已日益受到重視。但是,蛋白多肽類功能成分口服時通常具有不耐酸,易被消化道內的蛋白酶水解而失去活性的問題,嚴重降低了其營養價值。因此,以提高此類功能成分的胃腸穩定性,實現其緩釋、靶向輸送和高生物利用度的新型食品功能成分傳輸釋放系統的開發和利用已經成為功能食品研究的熱點。目前,采用天然多糖作為蛋白多肽類功能性成分靶向控釋載體的研究已經成為研究熱點。目前,果膠多以果膠鈣或與其他多糖復配使用的形式被應用于有效成分緩控釋的研究。低甲氧基果膠可與二價金屬離子交聯,形成特有的“蛋格”結構[1],可有效包埋蛋白多肽等功能性成分,但其緩釋效果不佳。張良珂等研究了Ca2+和Ba2+交聯果膠凝膠微丸釋放蛋白多肽類藥物的性質時,發現果膠鈣或果膠鋇微球在由模擬胃液中轉入模擬腸液中后1~2h內就會完全解體,無法達到現小腸內緩慢釋藥的效果[2]。殼聚糖和果膠形成聚電解質復合物,有助于提高腸內緩釋效果。靳鐳等考察果膠-鈣-殼聚糖游離膜對胃腸道上段藥物釋放的屏障作用時,發現果膠-鈣-殼聚糖游離膜可增加胃腸道上段藥物釋放的屏障作用,有利于制劑的結腸靶向釋藥[3]。目前,國內學者多偏向于果膠載體的體外釋放研究,很少涉及其體外溶脹的探究。本研究將離子移變交聯和聚電解質絡合相結合,以牛血清白蛋白(BSA)為模型蛋白類功能成分,通過滴加法制備殼聚糖-果膠鈣微球,并著重從體外溶脹和釋放兩方面深度考察其應用特性,旨在為蛋白多肽類功能成分靶向輸送載體的構建提供依據。
1 材料與方法
1.1 材料與儀器
牛血清白蛋白、無水氯化鈣 國藥集團化學試劑有限公司;低甲氧基果膠(甲氧基度26%) 美國斯比凱可公司;食品級殼聚糖(相對分子質量≈1×105,脫乙酰度93.4%) 青島金湖甲殼制品有限公司;其他試劑 均為分析純。
SPX-250型振蕩培養箱 上海博訊實業有限公司;UV-1600型紫外可見分光光度計 上海美普達儀器有限公司;RW20.n型懸臂式攪拌器 廣州儀科公司;DELTA 320型pH計 梅特勒-托利多儀器公司;DX51/BX52型顯微鏡 奧林巴斯公司。
1.2 實驗方法
1.2.1 牛血清白蛋白殼聚糖-果膠鈣微球的制備 配制果膠水溶液(90℃),待其降溫至40℃時,邊攪拌邊將一定量的牛血清白蛋白溶于其中[4]。同時,采用2%(v/v)的醋酸溶液配制氯化鈣-殼聚糖交聯溶液。邊緩慢攪拌邊采用注射器(5mL,7#針頭)將果膠和牛血清白蛋白(5%w/v)的混合溶液滴加到pH5.5氯化鈣-殼聚糖溶液中,針頭離液面高度為5cm左右,攪拌速度100r/min,滴速大約2mL/min,交聯時間10min[5-6]。交聯完成后,篩網過濾,去離子水清洗三次,真空干燥(37℃、真空度0.1MPa)24~48h,即得殼聚糖-果膠膠鈣微球。
1.2.2 微球表征觀察 觀察干態和濕態微球的形態與分布,同時對載有BSA的殼聚糖-果膠鈣微球在溶脹的不同階段的形態結構進行分析和比較。
1.2.3 包封率和載量的計算 交聯完成后,篩網過濾,水洗三次,合并濾液,取0.5mL氯化鈣-殼聚糖交聯溶液和微球洗滌液的混合溶液[7],采用考馬斯亮藍法測定游離BSA含量[8],計算出實際載量和包封率。包封率(EE)和載量(LC)計算公式如下:

式中:W1:微球中BSA濃度/mg;W2:交聯液和洗滌液中游離BSA含量/mg;W:微球的干重/mg。
1.2.4 體外溶脹度的測定 定量稱取干燥殼聚糖-果膠鈣微球,置于25mL具塞燒杯中,加入5mL模擬胃液(0.1mol/L HCl,pH1.2),置于(37±0.5)℃恒溫水浴鍋中水浴溶脹2h后,將微球轉移至模擬腸液(KH2PO4/NaOH,0.05mol/L,pH7.4)中,每隔一定時間,取出微球,用濾紙吸其表面水分,稱重后記錄數據,并將微球放回原來溶液[9],溶脹度計算公式如下:

式中:Wa:某一時間點溶脹后微球的質量/g;W:溶脹前微球干重/g。
1.2.5 體外釋放率的測定 定量稱取干燥殼聚糖-果膠鈣微球,置于100mL具塞錐形瓶中,加入50mL模擬胃液,置于(37±0.5)℃恒溫振蕩水浴鍋中,50r/min振蕩。2h后再將微球由模擬胃液中轉移至模擬腸液中,繼續釋放。每隔一定時間,取樣并用考馬斯亮藍法測其吸光度,同時補充相同體積的新鮮釋放介質,計算樣液BSA含量[9]。累積釋放率計算公式如下:

式中:Cn:第n次取樣時,釋放介質中BSA濃度(mg/mL);V:釋放介質體積(mL);Vi:第n次取樣前,所取樣的體積(mL)。
2 結果與討論
2.1 微球形態觀察

圖1 干燥前后的微球照片Fig.1 Images of microspheres before and after drying
由于微球的粒徑主要受制備微球所用針頭內徑以及干燥方式的影響[6],而本實驗中制備微球的針頭和干燥方式都是不變因素,所以在本實驗中不同條件下制備的微球大小和形態基本一致,無明顯差異。如圖1所示,干燥前,微球呈乳白色,球形顆粒,粒徑2mm左右;干燥后,壁材被濃縮,微球呈果膠原料的淺黃色,扁圓形顆粒,粒徑略有減小。
2.2 微球溶脹前后形態分析
如圖2所示,載有BSA的殼聚糖-果膠鈣微球在不同的溶脹階段,有著顯著的變化。當干燥的微球在進入模擬胃液中后快速吸水溶脹,0.5h和2h的時候,微球溶脹情況相近,可見當微球浸在模擬胃液中0.5h后,就達到了溶脹平衡。然后將在模擬胃液中溶脹了2h的微球轉入pH7.4的模擬腸液中后,微球進一步溶脹,并隨著溶脹時間的延長,微球的溶蝕現象越明顯。在模擬腸液中溶脹3h后,微球幾乎完全被溶蝕。因此,可推斷:在模擬胃液中,殼聚糖-果膠鈣微球不斷溶脹,其釋放主要是在微球半透膜兩側BSA濃度差的推動下,BSA不斷向微球表面擴散完成;而當微球進入模擬腸液中后,主要在微球的不斷溶蝕過程中,實現BSA釋放的。
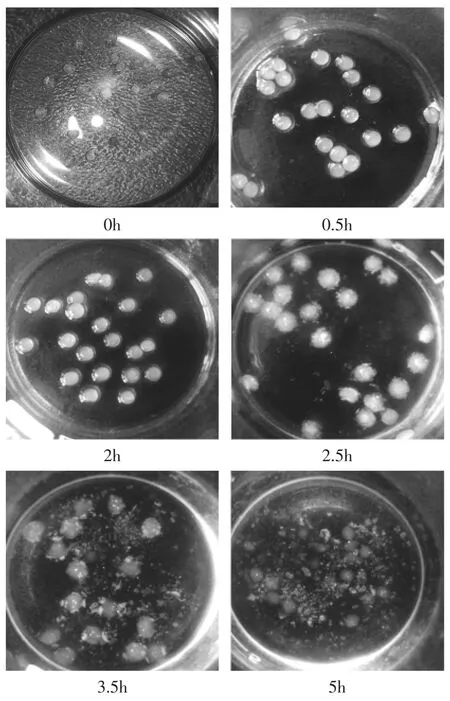
圖2 不同溶脹階段的微球照片Fig.2 Images of microspheres during swelling periods
2.3 果膠濃度的影響
果膠濃度對于微球質量具有顯著的影響。由于采用注射器滴加法制備微球,果膠濃度過低時,無法形成規則球狀;濃度過高時,果膠溶液粘度過大,會導針孔致阻塞。故由預實驗可知,取3%~7%濃度范圍內的果膠進行研究為宜。由表1和圖3中可以看出,隨著果膠濃度的增加,包封率增加,而載量、體外溶脹度和累計釋放率逐漸減小。分析原因,可能是由于隨著果膠濃度的增加,可提供更多的果膠分子和鈣離子形成致密的“蛋格”結構,有效包埋更多的BSA;此外,隨著果膠濃度的增加,果膠分子上的-COO-和殼聚糖分子上的-NH3+所帶電荷相當,相互之間的靜電吸引力增強,溶脹度減小[10],微球通透性降低,減少了BSA的釋放。在現有的三個濃度梯度中,當果膠濃度為7%(w/v)時,獲得最高包封率和最低累積釋放率。綜上所述,選取7%(w/v)的果膠進行進一步研究。

表1 果膠濃度對微球的包封率和載量的影響Table 1 Effect of pectin concentration on the EE and LC of microspheres
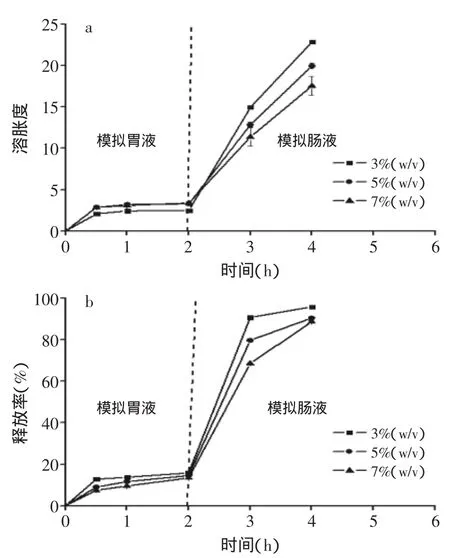
圖3 果膠濃度對微球的溶脹度和釋放率的影響Fig.3 Effect of pectin concentration on swelling ratioand cumulative BSA release rate of microspheres
2.4 氯化鈣濃度的影響
由表2可知,當CaCl2濃度為3%時,微球的包封率和載量最高;而高于或低于該濃度時,包封率和載量均會有所下降。由圖4a可知,隨著CaCl2濃度的增加,微球的溶脹度逐漸減小;而圖4b顯示,微球在CaCl2溶液濃度為3%時,體外釋放率最小。在果膠、殼聚糖和鈣離子體系中,果膠和殼聚糖形成聚電解質絡合物,而鈣離子與凝膠網絡內游離的果膠羧基結合,從而交聯成更致密的網狀結構。雖然,增大鈣離子濃度降低了凝膠結構溶脹度,篩網孔隙率較小,進一步阻礙了大分子的釋放[2],但是過多的鈣離子會占據大量果膠羧基結合位點,減少聚電解質絡合物的形成,多聚糖游離膜結構疏松,從而導致微球的通透性增大,溶脹度增大,加快芯材釋放[11]。綜上所述,選取3%(w/v)氯化鈣溶液進行進一步研究。
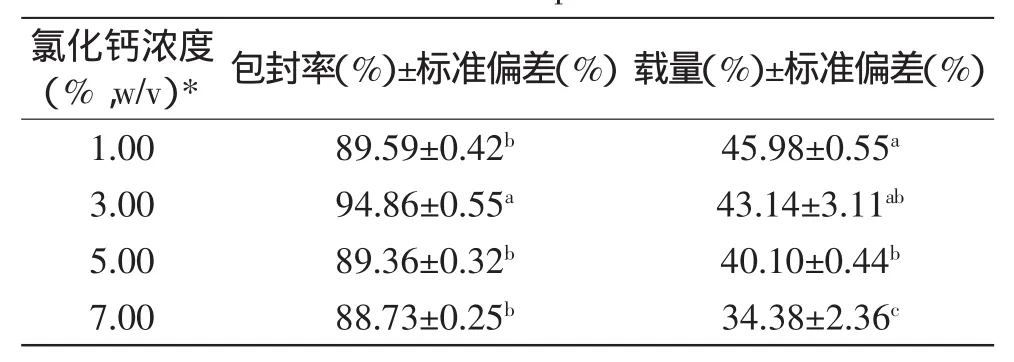
表2 氯化鈣濃度對微球的包封率和載量的影響Table 2 Effect of calcium chloride concentration on the EE and LC of microspheres

圖4 氯化鈣濃度對微球的溶脹度和釋放率的影響Fig.4 Effect of calcium chloride concentration on swelling ratio and cumulative BSA release rate of microspheres
2.5 殼聚糖濃度的影響
殼聚糖可與果膠通過靜電相互作用,在微球表面形成聚合電解質復合物,對果膠鈣微球具有顯著的固化作用,減少其通透性。如表3所示,當果膠鈣體系中加入殼聚糖之后,微球的通透性顯著降低,包封率和載量最高分別提高了約17%和6%。

表3 殼聚糖濃度對微球的包封率和載量的影響Table 3 Effect of chitosan concentration on the EE and LC of microspheres
圖5a所示,在模擬胃液中,果膠鈣微球和殼聚糖-果膠鈣微球均在1h后達到溶脹平衡,但是前者溶脹度略小于后者;而轉入模擬腸液中后,果膠鈣微球要早于殼聚糖-果膠鈣微球2h崩解,這不利于微球中BSA的緩釋。圖5b所示的結論印證了圖5a的推測。當不存在殼聚糖時,微球的通透性較大,在模擬胃液中突釋情況嚴重,要高于殼聚糖-果膠鈣微球約20%;而在轉入模擬腸液中后,果膠鈣微球的快速崩解導致微球中BSA幾乎在2h內完全釋放。而殼聚糖的介入顯著推遲了微球的崩解時間,改善了BSA的緩釋效果。當殼聚糖濃度比較低時,殼聚糖在醋酸溶液中充分溶解,殼聚糖溶液粘度小,分子基本成線狀,能夠在果膠鈣外層充分分散均勻,大量分子鏈段滲透到果膠鈣內層網孔中,其氨基與果膠中剩余羧基配位復合,有效降低了孔隙率,同時降低微球的通透性[11];當濃度大于0.5%時,殼聚糖無法在果膠鈣外層均勻分散,也不能有效進入果膠鈣孔隙中形成致密果膠-殼聚糖復合膜,導致微球通透性變大;而且,果膠和殼聚糖中的羧基和胺基以COO-、NH+、NH和COOH形式存在,適當果膠和殼聚糖比例有利于聚電解質絡合物和聚合物分子內氫鍵的形成,使多糖凝膠網狀結構收縮,從而導致膜溶脹度降低,降低釋放率[2]。綜上所述,選取0.50%(w/v)的殼聚糖溶液為宜。

圖5 殼聚糖濃度對微球的溶脹度和釋放率的影響Fig.5 Effect of pectin concentration on swelling ratio and cumulative BSA release rate of microspheres
3 結論
本文基于天然多糖復配獲得的微球可避免高溫處理、有毒交聯劑或有機試劑的使用,減少了對蛋白多肽類功能成分的破壞,為新型腸定位釋放載體的構建提供了一個有效的途徑。研究結果確定了牛血清白蛋白殼聚糖-果膠鈣微球的最佳制備工藝為:7%(w/v)的果膠溶液,3%(w/v)氯化鈣溶液,pH5.5的氯化鈣-殼聚糖交聯溶液,0.50%(w/v)的殼聚糖溶液,5%(w/v)的BSA濃度。最終,殼聚糖-果膠鈣微球中,BSA的包封率高達89.68%,載量高達32.13%,釋放時間顯著延長,緩釋效果得到明顯改善。但是,如何進一步優化腸部緩釋效果還值得深入探究。殼聚糖-果膠鈣微球有望成為蛋白多肽類功能因子口服腸道釋放的輸送載體。
[1]O Chambin,G Dupuis,D Championb,et al.Colon-specific drug delivery:Influence ofsolution reticulation properties upon pectin beadsperformance[J].InternationalJournalof Pharmaceutics,2006,321:86-93.
[2]張良珂,田睿,袁佩,等.牛血清白蛋白從不同果膠凝膠微丸中的釋放[J].中國藥學雜志,2008,43(18):1407-1410.
[3]靳鐳,梁桂賢,丁紅,等.果膠-鈣-殼聚糖游離膜的制備及特性研究[J].中國現代醫生,2010,48(18):8-12.
[4]Verma A,Pandit J K.Rifabutin-loaded floating gellan gum beads:Effect of calcium and polymer concentration on incorporation efficiency and drug release[J].Tropical Journal of Pharmaceutical Research,2011,10(1):61-67.
[5]趙瑛.胰島素果膠鈣結腸靶向微球的研究[D].武漢:華中科技大學,2008.
[6]Das S,Chaudhury A,Ng K.Preparation and evaluation of zinc-pectin-chitosan composite particles for drug delivery to the colon:Role of chitosan in modifying in vitro and in vivo drug release[J].International Journal of Pharmaceutics,2011,406(1-2):11-20.
[7]Kim T H,Park Y H,Kim K J,et al.Release of albumin from chitosan-coated pectin beads in vitro[J].International Journal of Pharmaceutics,2003,250(2):371-383.
[8]Lin Y H,Liang H F,Kuang C,et al.Physically crosslinked alginate/N,O-carboxymethyl chitosan hydrogels with calcium for oral delivery of protein drugs[J].Biomaterials,2005,26(14):2105-2113.
[9]Xu Yongmei,Zhan Changyou,Fan Lihong,et al.Preparation of dual crosslinked alginate-chitosan blend gel beads and in vitro controlled release in oral site-specific drug delivery system[J].International Journal of Pharmaceutics,2007,336(2):329-337.
[10]鄭學芳,楊華,王立升.殼聚糖/果膠及其衍生物水凝膠的制備與在功能成分控制釋放中的應用[J].食品工程,2008,3(12):120-123.
[11]邢楠,田豐,劉圣軍,等.海藻酸鈣-殼聚糖微膠囊組成對BSA通透性能影響的研究[J].化學學報,2007,65(24):2952-2928.

