乳腺癌新輔助化療前后正常乳腺腺體MRI表觀擴散系數的對比研究
方艷 姜原 秦乃姍
北京大學第一醫院醫學影像科,北京 100034
乳腺癌新輔助化療(neoadjuvant chemotherapy,NAC)是指乳腺癌手術或手術加放療的局部治療前,以全身化療為乳腺癌的第1步治療后再行局部治療。NAC是局部晚期乳腺癌或炎性乳腺癌的規范療法,既可使腫瘤降期以達到保乳手術要求,從而提高生活質量[1],又可使部分患者獲得病理完全緩解,提高無病生存率。現階段臨床上NAC多選擇含蒽環類和紫杉類的聯合或序貫化療方案。
目前乳腺MRI檢查是公認有效評價NAC療效的影像方法;而彌散加權成像(diffusion-weighted imaging,DWI)是唯一能反映人體內水分子運動狀態的成像方法,可直接反映組織結構、細胞密度等信息,因此也成為乳腺癌NAC療效評價的重要功能指標之一[2]。本研究旨在通過定量測定乳腺癌患者健側乳腺實質在NAC前后MRI的表觀擴散系數(apparent diffusion coefficient,ADC)變化來評價化療藥物對正常乳腺組織是否有影響,從而探討ADC值,評價NAC療效的準確性。
1 資料和方法
1.1 一般資料
回顧性收集2008年北京大學第一醫院確診乳腺癌并入院行規范化NAC,且完成基線MRI檢查、化療第2和第4個周期后MRI檢查的患者,剔除圖像質量不滿意者,篩選出其中采用蒽環類聯合紫杉類化療方案(TA方案)、且乳腺實質為中至多量型、未絕經或圍絕經期女性患者共16例。年齡42~58歲,中位年齡48歲。
1.2 掃描方法
采用GE公司1.5TMRI掃描儀(Medical System,Signa Excite,HD),4通道乳腺專用相控陣表面線圈,行雙乳橫軸面DWI掃描。具體參數:TR 5275 ms,TE 67.3 ms,視野(field of view,FOV) 30.0 cm,矩陣128×128,層厚4.0 mm,間隔1.0 mm,b值取1000 s/mm2。
1.3 圖像處理
采用GE AW4.2工作站,使用Functool工具測量健側乳腺實質和癌灶的ADC值。具體方法(圖1):選擇近乳暈中心的3個連續層面,于各層面的乳腺纖維腺體致密處放置一個12~16像素大小的感興趣區(region of interest,ROI),分別記錄ADC值后取平均值,視為該患者正常乳腺實質的ADC值。另于癌灶最大層面上,DWI圖最亮處放置一個12~16像素大小的ROI,記錄此ADC值為癌灶ADC值。同一患者的3次MRI檢查盡量選擇相同層面的相同位置進行ADC值測量。
1.4 數據分析
使用SPSS 13.0軟件對NAC前(ADC1)、NAC第2個周期后(ADC2)及第4個周期后(ADC3)正常乳腺實質的ADC值進行配對t檢驗。考慮來自同一個體測量值的關聯性,采用STATA 9.0 軟件的線性混合效應模型完成3個時期正常乳腺實質ADC值的回歸分析。計算NAC第4個周期結束后癌灶ADC值的變化率[(NAC第4個周期結束后癌灶ADC-基線水平癌灶ADC)/基線水平癌灶ADC]和NAC第4個周期結束后正常乳腺實質ADC值的變化率[(ADC3-ADC1)/ADC1],對其進行配對t檢驗。P<0.05為差異有統計學意義。
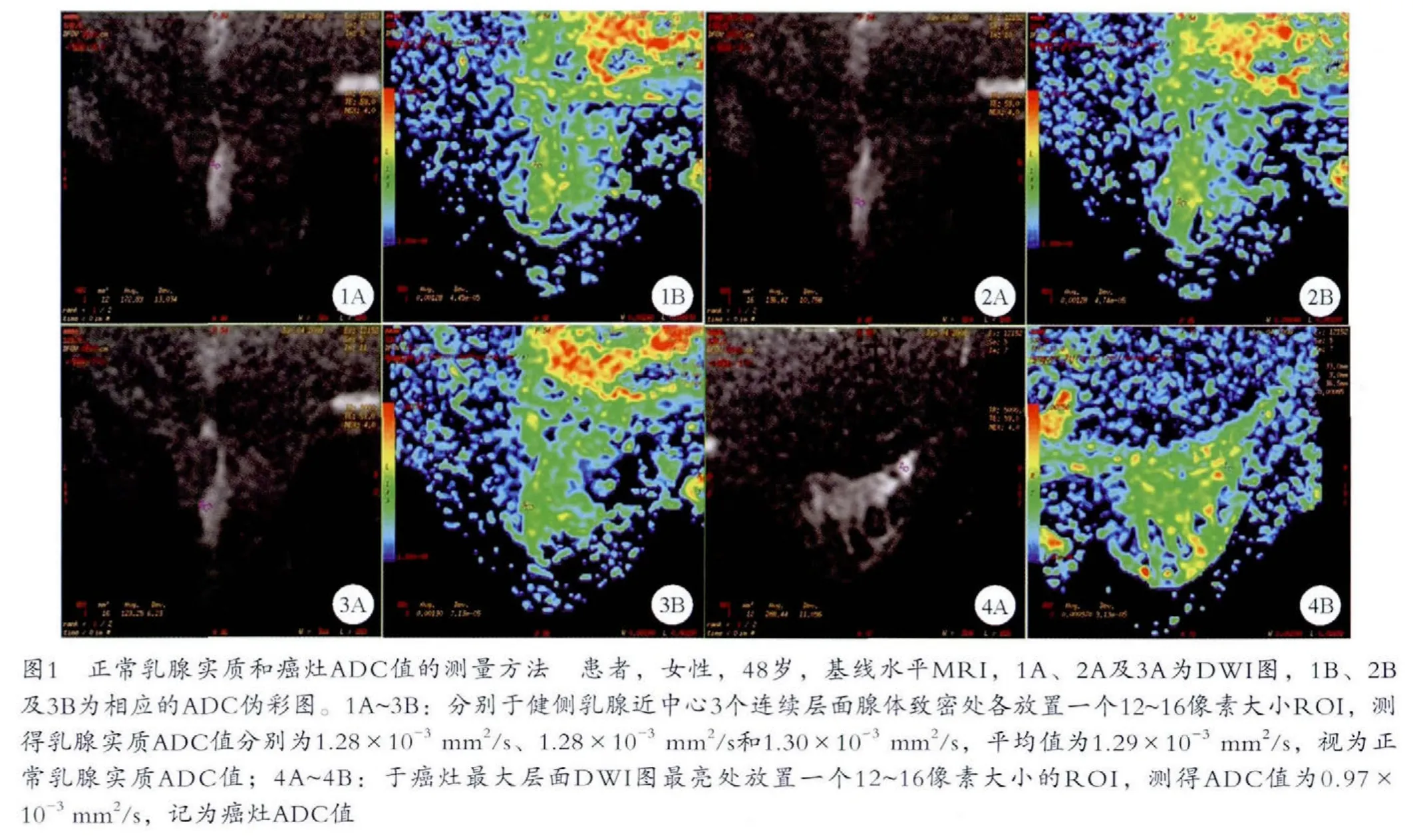
2 結果
2.1 NAC前后正常乳腺實質ADC值的變化
NAC前、NAC第2個周期后及第4個周期后正常實質的ADC值依次增高,平均值分別為(1.56±0.35)×10-3mm2/s、(1.64±0.35)×10-3mm2/s和(1.75±0.33)×10-3mm2/s;其中,NAC前與NAC第4個周期后、NAC第2個周期后與NAC第4個周期后比較均有統計學差異(P<0.05)。
2.2 正常乳腺實質ADC值與NAC周期數的線性回歸分析
因為同一患者不同時期的正常乳腺實質ADC值之間存在關聯性,所以采用線性混合效應模型進行回歸分析。具體結果如表1所示。患者的正常乳腺實質ADC值與NAC周期數存在正向線性關系(P<0.05),即正常乳腺實質ADC值隨著化療周期數增加而升高。
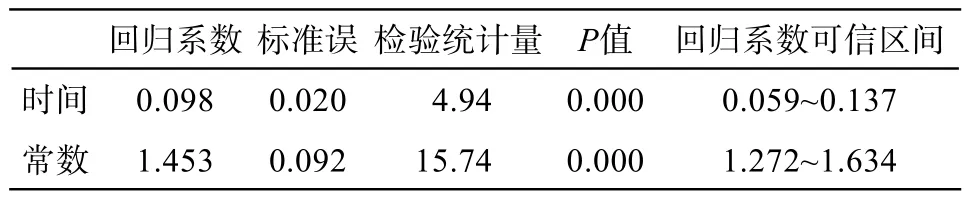
表1 NAC前后正常乳腺實質ADC值的線性回歸分析
2.3 NAC前后癌灶與正常乳腺實質ADC值變化率的比較
NAC 4個周期結束后,癌灶和正常實質ADC值變化率的均值分別為(27.6±20.4)%和(13.9±12.3)%,癌灶ADC值的變化率顯著大于正常乳腺實質(P<0.05)。
3 討論
DWI掃描時間短,且無需造影劑,是臨床上使用最方便的乳腺MRI功能成像技術之一,具有廣泛的臨床應用和研究價值。在DWI成像中,b值的正確選擇是圖像能否用于診斷的關鍵。合適的b值能提高圖像信噪比,同時比較真實地反映組織水分子的擴散運動。綜合考慮后,本研究中b值取1000 s/mm2是文獻中較為推崇的選擇[3]。ADC值反映的是活體內水分子隨機熱運動的受限程度,主要受2個因素影響:生物膜結構的限制和大分子物質如蛋白質對水分子的吸附作用。細胞繁殖越旺盛,密度越高,生物膜結構對水分擴散的限制越明顯,ADC值越低[4]。NAC后乳腺正常腺體實質的ADC值升高,提示乳腺腺體內細胞密度減低,這與Chen等[5]認為NAC使正常乳腺腺體實質密度減低相一致。
自從NAC廣泛應用于臨床以來,其導致婦女提早閉經和不孕的問題引起關注[6-9]。有研究證明導致該現象的理論基礎是化療藥物作用于卵巢,使其功能減退,雌激素水平降低[10]。而乳腺作為雌激素的靶器官,必然會受一定影響。這也是目前大家比較認同的NAC后乳腺實質密度發生變化的原因。NAC是一種全身療法,其對乳腺實質的直接作用不應忽視。但研究表明,>55歲的患者經歷NAC后,乳腺實質密度并無明顯減低,而<40歲的患者乳腺實質密度改變顯著[5]。由此推論,化療藥物對乳腺的作用更有可能是通過作用于卵巢實現的。而正常實質ADC值的升高在NAC第2個周期后表現更明顯,這可能與化療藥物對卵巢的作用存在劑量累加效應或乳腺實質對卵巢激素降低的反應具有一定時間延遲有關。
目前NAC廣泛應用于臨床,MRI作為一種無創、有效的療效評價手段越來越受重視。除監測癌灶大小、強化方式變化外,癌灶ADC值變化也成為一個重要的療效評價指標。癌灶的ADC值在NAC早期即出現上升,且這一變化比癌灶大小變化出現得更早、更明顯[11-12]。而采用癌灶ADC值變化率來評價NAC療效時,應考慮到正常乳腺實質本身對化療的反應。本組16例患者NAC 4個周期后癌灶ADC值的變化率與正常乳腺實質相比具有顯著差異,說明癌灶對化療藥物的反應比正常乳腺實質更敏感。
本研究也存在不足之處。首先,這是一個回顧性的小樣本研究,限于DWI圖像空間分辨率低,為提高ADC值測量的準確率,只選取了中至多量實質類型的患者入組,無法將結論推廣到更廣泛的人群。其次,乳腺癌NAC的藥物種類繁多,聯合或序貫應用方案也不盡相同。文獻表明不同化療藥物對卵巢功能的影響也不同[13],而此次研究只選擇了TA方案者,其余化療方案對卵巢及乳腺組織的影響還有待繼續研究。此外,患者對化療的反應,即最終病理療效評價沒有納入本研究中。
總之,化療藥物不僅作用于乳腺癌灶,還可使正常乳腺實質的ADC值升高,且這種效應可能隨著化療周期數增多而表現更明顯。因此,使用DWI評價乳腺癌NAC療效時,應考慮到此效應的影響,從而提高準確率。
[1]中國抗癌協會乳腺癌專業委員會.中國抗癌協會乳腺癌診治指南與規范(2011版)[J].中國癌癥雜志, 2011,21(5): 389.
[2]顧雅佳, 邱龍華.磁共振彌散在乳腺病變診斷中的作用[J].中國醫學計算機成像雜志, 2007, 13(5): 356.
[3]KUROKI Y, NASU K.Advances in breast MRI:diffusion-weighted imaging of the breast[J].Breast Cancer, 2008, 15(3): 212-217.
[4]楊正漢,馮逢,王霄英.磁共振成像技術指南[M].北京: 人民軍醫出版社, 2010: 750.
[5]CHEN J H, NIE K, BAHRI S, et al.Decrease in breast density in the contralateral normal breast of patients receiving neoadjuvant chemotherapy: MR imaging evaluation [J].Radiology, 2010, 255(1) :44-52.
[6]POIKONEN P, SAARTO T, ELOMAA I, et al.Prognostic effect of amenorrhea and elevated serum gonadotropin levels induced by adjuvant chemotherapy in premenopausal node-positive breast cancer patients [J].Eur J Cancer, 2000, 36(1): 43-48.
[7]MINTON S E, MUNSTER P N.Chemotherapyinduced amenorrhea and fertility in women undergoing adjuvant treatment for breast cancer [J].Cancer Control,2002, 9(6): 466–472.
[8]FORNIER M N, MODI S, PANAGEAS K S, et al.Incidence of chemotherapy-induced, long-term amenorrhea in patients with breast carcinoma age 40 years and younger after adjuvant anthracycline and taxane [J].Cancer, 2005, 104(8): 1575-1579.
[9]THAM Y L, SEXTON K, WEISS H, et al.The rates of chemotherapy-induced amenorrhea in patients treated with adjuvantdoxorubicin and cyclophosphamide followed by taxane [J].Am J Clin Oncol, 2007, 30(2):126-132.
[10]OKTEMO, OKTAY K.Quantitative assessment of the impact of chemotherapy on ovarian follicle reserve and stromal function [J].Cancer, 2007, 110(10): 2222-2229.
[11]PICKLES M D, GIBBS P, LOWRY M, et al.Diffusion changes precede size reduction in neoadjuvant treatment of breast cancer[J].Magn Reson Imaging, 24(7):843-847.
[12]SHARMA U, DANISHAD K K, SEENU V, et al.Longitudinal study of the assessment by MRI and diffusion-weighted imaging of tumor response in patients with locally advanced breast cancer undergoing neoadjuvant chemotherapy[J].NMR Biomed, 2009,22(1): 104-113.
[13]GADDUCCI A, COSIO S, GENAZZANI A R.Ovarian function and childbearing issues in breast cancer survivors[J].Gynecol Endocrinol, 2007, 23(11): 625-631.

