上調c-myc基因的表達對U937白血病細胞的影響
潘曉娜, 方志剛, 龍梓潔, 陳家杰, 劉玲玲, 范蕊芳, 林東軍
(中山大學附屬第三醫院血液科,中山大學血液病研究所,廣東 廣州 510630)
上調c-myc基因的表達對U937白血病細胞的影響
潘曉娜▲, 方志剛▲, 龍梓潔, 陳家杰, 劉玲玲, 范蕊芳, 林東軍△
(中山大學附屬第三醫院血液科,中山大學血液病研究所,廣東 廣州 510630)
目的構建穩定表達外源c-myc基因的人單核細胞白血病細胞株U937,并初步分析其特性。方法首先構建重組質粒MSCV-c-myc-IRES-GFP (MMIG)載體,分別用MMIG及空載體MSCV-IRES-GFP(MIG)包裝病毒,并感染U937細胞,用流式細胞術分選綠色熒光細胞,獲得 U937/GFP和U937/MYC細胞,用熒光顯微鏡及流式細胞術檢測GFP陽性率,用Western blotting測定細胞中c-Myc、survivin、X連鎖凋亡抑制蛋白(XIAP)和Bcl-2的蛋白表達水平,流式細胞術檢測U937/GFP和U937/MYC細胞周期,并用MTT法測定U937/GFP和U937/MYC細胞的生長情況,克隆形成實驗檢測克隆形成能力。結果熒光顯微鏡觀察,MIG和MMIG病毒感染后,2種細胞均表達綠色熒光蛋白;流式細胞術結果顯示,MIG病毒感染的細胞熒光率為26.0%,MMIG病毒感染的細胞熒光率為27.7%;Western blotting的結果顯示,c-Myc蛋白在MMIG病毒感染的細胞中表達水平升高。流式細胞術分選后,熒光顯微鏡觀察可見綠色熒光蛋白表達明顯增多,U937/GFP和U937/MYC細胞綠色熒光蛋白表達率分別達98.7%和93.7%。 U937/MYC細胞中c-Myc蛋白表達較U937/GFP細胞顯著升高,c-Myc蛋白下游的survivin表達增多,而凋亡相關蛋白XIAP及Bcl-2的表達則沒有明顯變化。細胞周期檢測顯示,U937/MYC細胞處于S期的細胞數增多。MTT實驗結果顯示,U937/MYC細胞的生長速率較U937/GFP細胞增快。U937/MYC細胞的克隆形成能力較U937/GFP細胞強。結論成功構建了c-myc基因高表達的U937穩定細胞株U937/MYC。在U937/MYC細胞中,c-Myc及其下游的survivin表達明顯上調,處于細胞周期S期的細胞數增多、細胞生長加快、克隆形成能力增強,提示c-Myc可能通過增強自我更新能力、加快細胞周期、促進相關抗凋亡蛋白表達從而提高細胞的存活率。
c-Myc蛋白; 載體構建; U937細胞
髓細胞瘤病癌基因(myelocytomatosis oncogene,myc)是髓細胞增生原癌基因,編碼的Myc蛋白結合于其它基因以調控基因的表達。N-myc、L-myc和c-myc是原癌基因myc三大家族成員。N-myc具有一定的組織特異性,主要與神經系統相關,在1/3的神經母細胞瘤病人中有N-Myc高表達[1]。L-Myc的表達和活性均比較低,研究最多的是c-Myc。人類c-myc基因定位于8q24,其編碼蛋白質的功能區含有堿性結構域-螺旋-回旋-螺旋-亮氨酸拉鏈結構域(basic helix-loop-helix/leucine zipper motif,bHLHZ),該區域與Max蛋白結合,形成Myc/Max異二聚體。異二聚體與靶基因的E-box DNA(5’-CACGTG-3’)區域結合,發揮轉錄功能,調節下游基因[2]。c-myc基因的mRNA一般情況下極不穩定,半衰期較短,常在10 min之內發生降解,但在細胞受到刺激時其穩定性常發生改變[3]。
Myc是Wnt、轉化生長因子β(transforming growth factor β,TGF-β)、受體酪氨酸激酶(receptor tyrosine kinase,RTK)及T細胞受體(T-cell receptor,TCR)等多條信號通路的交匯點,參與細胞的生長、增殖、腫瘤形成及腫瘤耐藥。除此之外,Myc還與Sox2、Oct4和KLF4共同參與成纖維細胞誘導成多能干細胞的過程,是調節細胞干性的關鍵基因[4]。c-Myc與多種實體瘤密切相關,在乳腺癌、前列腺癌、胃腸癌、黑色素瘤等均發現c-Myc的異常表達,且與腫瘤的分期和預后相關[5]。
在血液系統中,c-Myc參與造血,且在Burkitt 淋巴瘤和多發性骨髓瘤中明顯高表達[6]。在急性淋巴細胞白血病(acute lymphocytic leukemia, ALL)中,c-Myc與NOTCH共同參與腫瘤的維持[7]。在急性髓系白血病(acute myelocytic leukemia,AML)中有約1/3的患者c-Myc高表達,且c-Myc的表達水平與初診時外周血白細胞的數目呈正相關,化療可降低c-Myc的表達水平[8]。Strassburg等[9]通過對初診和復發 AML患者c-myc mRNA檢測發現,在復發難治患者中c-myc mRNA表達明顯高于初診患者,化療無效或不緩解的AML患者的c-myc mRNA和蛋白表達呈持續高水平,白血病c-myc基因的表達水平可能是反映白血病細胞惡性程度及判斷預后的重要指標之一。因此,針對c-Myc對白血病細胞影響的研究對臨床有重要意義。本文旨在構建c-myc穩定高表達的人單核細胞白血病細胞株U937(U937/MYC),研究c-myc基因高表達對AML細胞系特性的影響。
材 料 和 方 法
1主要試劑
細胞培養用的胎牛血清為HyClone產品, RPMI-1640培養基為Gibco產品, Trizol試劑為Ambion產品,DL2000 marker以及構建載體所用的限制性內切酶BglII、NotI和PCR所用的高保真DNA聚合酶均為TaKaRa產品,細胞轉染試劑為Invitrogen公司的Lipofectamine 2000。
2重組質粒MSCV-c-myc-IRES-GFP(MMIG)載體的構建
2.1目的基因c-myc的獲得 利用從ADDGENE質粒庫上購買的FUW-tetO-c-myc質粒(質粒編號為20324)為模板進行PCR擴增反應。PCR擴增所用的引物序列為:上游引物5’-AGCTCTCAGATCTATGCCCCTCAACGTTAGCT-3’,下劃線處為BglII 酶切位點;下游引物5’-AAGGAAAAATGCGGCCGCTTAC-GCACAAGAGTTCCGTA-3’,下劃線處為NotI酶切位點。PCR反應條件為94 ℃預變性5 min,94 ℃ 30 s,55 ℃ 40 s,72 ℃ 1.5 min,25個循環,72 ℃ 10 min。將PCR產物進行0.8%瓊脂糖凝膠電泳,觀察結果并將目的條帶進行回收。
2.2MMIG載體的連接和酶切鑒定 將 PCR回收產物與MSCV-IRES-GFP(MIG)載體分別用BglⅡ和NotⅠ進行雙酶切,純化回收酶切產物,將c-myc片段與MIG載體用T4 DNA連接酶于16 ℃ 連接過夜,轉化感受態大腸桿菌DH5α,在鋪有氨芐青霉素瓊脂糖平板上進行單個菌落挑取,37 ℃培養過夜,提取重組質粒DNA,用BglⅡ和NotⅠ雙酶切鑒定,觀察c-myc基因片段是否克隆到MIG載體中。陽性質粒由深圳華大基因研究院進行DNA測序分析。測序正確的重組質粒載體即MMIG。
3細胞培養
人單核細胞白血病細胞株U937用含10%胎牛血清的RPMI-1640培養基于37 ℃、5% CO2條件下常規培養。每隔2~3 d進行傳代,取對數生長期細胞進行細胞實驗。
4逆轉錄病毒的包裝及對U937細胞的感染
4.1逆轉錄病毒的包裝 轉染前將GP2-293包裝細胞在60 mm培養皿接種1×106~2×106,生長密度達到80%左右進行轉染。用脂質體介導的方法將重組逆轉錄病毒載體(MIG和MMIG)和pVSV-G載體共轉染GP2-293包裝細胞。將GP2-293細胞放于5% CO2、37 ℃孵箱培養。轉染后48和72 h后分別收集病毒液,0.45 μm濾器過濾后混勻,4 ℃保存。
4.2逆轉錄病毒對U937細胞的感染 感染前將U937細胞低密度傳至培養皿中,加病毒液,同時加入聚凝胺(polyberne)使其終濃度為至8 mg/L。感染4~6 h后去除病毒液,加入新鮮培養基繼續培養,感染24~36 h后在倒置熒光顯微鏡下觀察GFP表達情況。GFP陽性表達的細胞繼續培養,3 d后利用流式細胞術分析GFP陽性細胞的比率。
5穩定細胞株U937/GFP和U937/MYC的流式分選
將陽性的穩定細胞株用MoFlo XDP細胞分選流式儀(Beckman)進行GFP陽性細胞的分選。MIG病毒感染分選后的U937穩定細胞株命名為U937/GFP,而MMIG病毒感染分選后的U937穩定細胞株命為U937/MYC。
6Westernblotting檢測c-Myc及相關蛋白的表達水平
U937/GFP和U937/MYC細胞,用細胞裂解液(20 mmol/L Tris, pH 7.5,150 mmol/L NaCl, 0.25% NP40,2.5 mmol/L sodium pyprophosphate,1 mmol/L EGTA,1 mmol/L EDTA,1 mmol/L β-glycerophosphate,1 mmol/L Na3VO4,1 mmol/L PMSF,1 mg/L leupeptin)提取細胞總蛋白。用考馬斯亮藍法進行蛋白定量后,按40 μg上樣,12% SDS-PAGE進行電泳,將蛋白轉移至硝酸纖維素膜(10 V,50 min),Ⅰ抗孵育,4 ℃過夜, HRP標記的抗鼠或兔IgG的Ⅱ抗孵育1 h,于暗室中曝光。以GAPDH作為內參照。
7MTT法檢測穩定細胞株增殖情況
將U937/GFP和U937/MYC細胞按1×103cells/well培養于96孔板,分別培養1 d、2 d、3 d、4 d、5 d和6 d,檢測前每孔加入20 μL MTT溶液,繼續孵育4 h,棄上清液,然后每孔加入150 μL DMSO溶解沉淀,于490 nm波長的酶標儀測定吸光度(absorbance,A),1 d吸光度為對照組吸光度,其余為實驗組吸光度。細胞存活率(%)=實驗組吸光度/對照組吸光度×100%。
8流式細胞術檢測細胞周期
收集細胞,1 500 r/min 離心5 min, PBS洗滌2次,后用冰乙醇固定過夜,碘化丙啶(propidium iodide,PI)染色后流式細胞儀測定細胞周期。以上實驗重復3次。
9甲基纖維素克隆形成實驗
U937/GFP和U937/MYC細胞分別以500 cells/well種于400 μL甲基纖維素中, 37 ℃、5% CO2條件下培養6 d后熒光顯微鏡下觀察克隆。
10統計學處理
用SPSS 13.0統計軟件分析,數據用均數±標準差(mean±SD)表示,組間均數比較采用t檢驗。以P<0.05為差異有統計學意義。
結 果
1MMIG載體的構建
PCR擴增c-myc基因片段,經瓊脂糖凝膠電泳顯示擴增條帶與預期大小相一致,于1 000~2 000 bp處,見圖1A。純化PCR產物與MIG載體均用BglⅡ和NotⅠ雙酶切后,電泳顯示目的基因片段(圖1B泳道4)和MIG載體(圖1B泳道5)雙酶切后得到線性片段大小與理論值相符。連接產物轉化感受態E.coliDH5α,挑3個重組質粒提取質粒DNA進行BglⅡ和NotⅠ雙酶切鑒定,電泳分析得有2個陽性的重組質粒,見圖1C。將此2個質粒進行DNA測序。測序結果經BLAST分析, 證實該重組質粒插入的序列與GenBank的人類c-myc基因(基因登錄號:V00568.1)的開放讀碼框序列同源性為100%。
2c-myc高表達的U937細胞株的感染情況分析
將質粒MIG和MMIG分別進行病毒包裝,感染U937細胞株。熒光顯微鏡觀察兩種病毒感染的U937細胞均有GFP表達,見圖2A。經流式細胞術分析得出MIG病毒感染的U937細胞GFP陽性率為26.0%,MMIG為27.7%,見圖2B。Western blotting結果顯示,MMIG病毒感染的U937細胞中c-Myc蛋白表達水平有上調現象,見圖2C。
3c-myc高表達的U937穩定細胞株U937/MYC的建立與驗證
用Beckman MoFlo XDP細胞分選流式儀分選得到穩定細胞株U937/GFP和U937/MYC。熒光顯微鏡觀察,相同放大倍數視野內綠色熒光細胞較分選前明顯增多,見圖3A。流式細胞術檢測U937/GFP細胞中的GFP陽性細胞的比率是98.7%,U937/MYC細胞中GFP陽性細胞的比率為93.7%,見圖3B。Western blotting進一步證實,c-Myc蛋白表達比分選前增多,見圖3C,說明成功地得到c-myc高表達的U937穩定細胞株U937/MYC。

Figure 1. Electrophoresis of MSCV-c-myc-IRES-GFP recombinant. A: PCR amplification of FUW-tetO-c-myc plasmid; B, C:BglII andNotI digestion. M: DL2000 DNA marker; 1~3:c-mycPCR product; 4:c-mycPCR product digested byBglII andNotI, generating ac-mycDNA; 5: MIG vector digested byBglII andNotI, generating a linear plasmid; 6~8: three recombinants digested byBglII andNotI. Two positive clones were obtained (7 and 8).
圖1構建MSCV-c-myc-IRES-GFP重組載體電泳圖
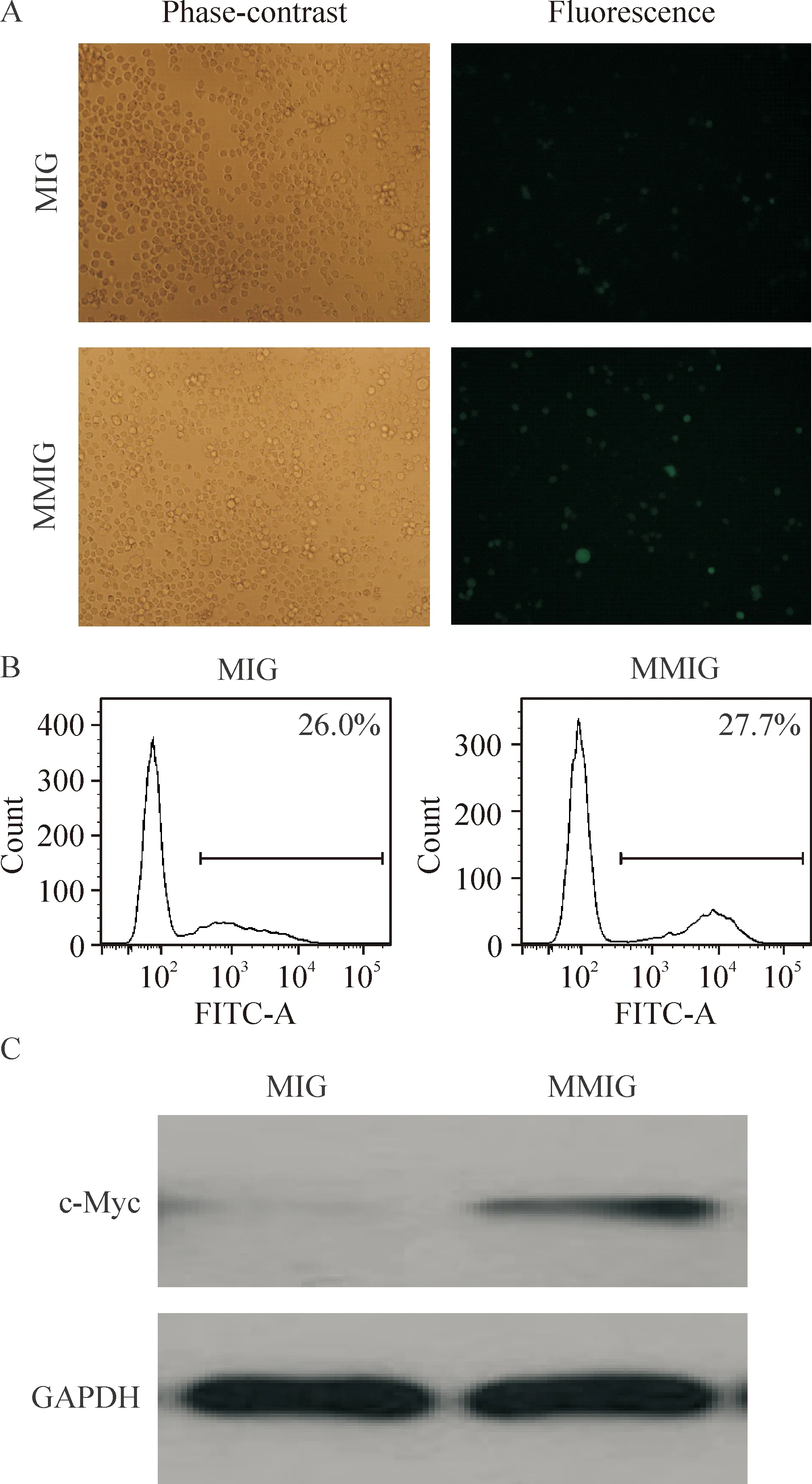
Figure 2. Analysis of c-Myc expression after virus infection in U937 cells. A: images of U937 cells infected with MIG or MMIG under phase-contrast microscope and fluorescence microscope (×200); B: GFP positive rates in U937 cells infected with MIG or MMIG analyzed by flow cytometry; C: the expression of c-Myc in U937 cells infected with MIG or MMIG detected by Western blotting.
圖2MIG和MMIG病毒感染后U937細胞中c-Myc的表達分析

Figure 3. Characteristics of U937/MYC and U937/GFP cells after fluorescence-activated cell sorting. A: images of U937/MYC cells under phase-contrast microscope and fluorescence microscope (×200); B: GFP positive rates of U937/GFP and U937/MYC cells determined by flow cytometry; C: the expression of c-Myc in U937/GFP and U937/MYC cells analyzed by Western blotting.
圖3U937/MYC和U937/GFP細胞中c-Myc的表達分析
4穩定細胞株U937/MYC相關蛋白的表達情況
Western blotting結果顯示,c-Myc下游的survivin在U937/MYC細胞中較U937/GFP細胞明顯上調,而其它凋亡相關蛋白X連鎖凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)及Bcl-2無明顯改變,見圖4。

Figure 4. The protein expression of survivin, XIAP and Bcl-2 detected by Western blotting.
圖4U937/MYC和U937/GFP細胞中survivin、XIAP及Bcl-2蛋白表達分析
5U937/MYC和U937/GFP細胞株細胞周期及生長情況
用流式細胞術檢測U937/MYC和U937/GFP細胞周期,顯示U937/MYC細胞處于S期的細胞數較U937/GFP細胞多,見圖5A。將兩細胞株以1×103cells/well接種于96孔板,MTT檢測培養1 d、2 d、3 d、4 d、5 d和6 d細胞的生長情況,結果顯示,U937/MYC細胞在培養3 d、4 d、5 d和6 d時生長較U937/GFP細胞快(P<0.05),見圖5B。克隆形成實驗結果顯示,U937/MYC細胞的克隆形成能力較U937/GFP細胞強,見圖5C。
討 論
近年來,逆轉錄病毒表達載體系統在研究基因的下游靶點和功能中得到廣泛應用。MoMLV(Moloney murine leukemia virus)和MSCV(murine stem cell virus)是目前常用的逆轉錄病毒載體,用于干細胞或前體細胞,特別是血液細胞的感染。MoMLV載體廣泛用于懸浮真核細胞基因轉染,但在未分化的胚胎干細胞中常因啟動子甲基化、增強子缺乏和負調控因子增多而導致沉默,降低轉錄活性[10]。而基于MoMLV載體改造的MSCV在原先的長末端重復(long terminal repeat,LTR)基礎上發生點突變和缺失,使其在造血干細胞和胚胎干細胞的表達率提高,安全性更高。文獻報道MSCV在白細胞中的感染率也達到1.6%~47.5%[11]。MSCV載體因其在造血干/祖細胞中對外源基因的轉染和表達具有明顯優勢而得到廣泛應用。
Figure 5. Cell cycle and growth analysis of U937/GFP and U937/MYC cells. A: cell cycle distribution determined by PI staining; B: cell viability measured by MTT assay; C: clone-forming images under phase-contrast microscope and fluorescence microscope (×200). Mean±SD.n=5.*P<0.05vsU937/GFP.
圖5U937/MYC和U937/GFP細胞株細胞周期及生長情況分析
U937細胞系來源于組織細胞性淋巴瘤的病人,最早由Dr. K. Nilsson實驗室于1974年建立,在多種因子誘導下具有向單核細胞分化的惡性幼稚細胞[12-13]。本文采用MSCV載體介導c-myc基因在U937細胞系高表達,結果表明,MSCV-c-myc-IRES-GFP對U937細胞的感染率達到27.7%,感染率較高。
為了進一步驗證經流式分選獲得的U937/MYC細胞能穩定高表達c-myc,我們利用Western blotting方法觀察細胞內c-Myc下游的蛋白表達水平。與c-Myc相關的下游基因高達600多種,研究表明其中經典的有survivin和多種microRNA[14]。本實驗結果顯示,U937/MYC細胞中survivin明顯高表達,而該細胞中其它凋亡相關蛋白XAIP及Bcl-2表達水平無明顯改變。
c-myc基因的表達能影響細胞周期的變化。Link等[15]報道,c-Myc的靶基因可調節細胞由G1期向S期轉變。Polioudakis等[16]也證實,促有絲分裂物質可以通過上調c-Myc促進miR-22的轉錄,從而使靜止的細胞進入細胞周期,促進分裂增殖。本實驗中細胞周期分析顯示U937/MYC細胞處于S期的比例(60.03%)比U937/GFP細胞(40.26%)多,說明細胞的增殖速度加快,與之前的研究結果一致。克隆形成實驗結果表明,U937/MYC細胞的自我更行能力也增強。此外,細胞生長曲線顯示,U937/MYC細胞在第3天、第4天、第5天和第6天的細胞存活率均比U937/GFP細胞高。因此,高表達c-myc的U937細胞可能通過上調c-myc基因的表達來加速細胞周期,增強自我更新能力,提高細胞的生長速度,同時通過增加抗凋亡蛋白survivin的表達提高細胞的存活率。
本實驗成功地構建了c-myc基因高表達的U937穩定細胞株U937/MYC,并初步分析了c-Myc對該白血病細胞株特性的影響。該細胞可以作為較好的細胞模型進一步用于研究c-myc基因在白血病發生發展中的機制,并為治療白血病藥物的篩選提供基礎。
[1] Seeger RC, Brodeur GM, Sather H, et al. Association of multiple copies of the N-myconcogene with rapid progression of neuroblastomas[J]. N Engl J Med, 1985,313(18):1111-1116.
[2] Gomez-Curet I, Perkins RS, Bennett R, et al. c-Myc inhibition negatively impacts lymphoma growth[J]. J Pediatr Surg,2006,41(1):207-211.
[3] Malempati S, Tibbitts D, Cunningham M, et al. Aberrant stabilization of c-Myc protein in some lymphoblastic leukemias[J]. Leukemia, 2006, 20(9):1572-1581.
[4] Dang CV. MYC on the path to cancer[J]. Cell, 2012,149(1):22-35.
[5] Nesbit CE, Tersak JM, Prochownik EV. MYC oncogenes and human neoplastic disease[J]. Oncogene, 1999,18(19):3004-3016.
[6] 林媛媛,楊文萍.c-myc基因與血液細胞生成及白血病研究現狀[J].實驗與檢驗醫學, 2012, 30(3):247-251.
[7] Demarest RM, Dahmane N, Capobianco AJ. Notch is oncogenic dominant in T-cell acute lymphoblastic leukemia[J]. Blood, 2011,117(10):2901-2909.
[8] 陳 琰,肖若芝,王立琳,等.U0126增強索拉非尼對K562細胞增殖抑制、凋亡及誘導分化作用[J].中國病理生理雜志,2011,27(5):859-864.
[9] Strassburg CP, Neubauer V, Poliwoda H, et al. Regulation of the proto-oncogenesc-sis,c-fos,c-mycandc-mybin acute myeloid leukemias[J]. Neoplasma, 1992, 39(6):343-347.
[10] Feuer G, Taketo M, Hanecak RC, et al. Two blocks in Moloney murine leukemia virus expression in undifferentiated F9 embryonal carcinoma cells as determined by transient expression assays[J]. J Virol, 1989, 63(5):2317-2324.
[11] Oue M, Handa H, Matsuzaki Y, et al. The murine stem cell virus promoter drives correlated transgene expression in the leukocytes and cerebellar purkinje cells of transgenic mice[J]. PLoS ONE, 2012, 7(11):e51015.
[12] Ralph P, Moore MA, Nilsson K. Lysozyme synthesis by established human and murine histiocytic lymphoma cell lines[J]. J Exp Med, 1976,143(6):1528-1533.
[13] Olsson I, Gullberg U, Ivhed I, et al. Induction of diffe-rentiation of the human histiocytic lymphoma cell line U-937 by 1alpha,25-dihydroxycholecalciferol[J]. Cancer Res, 1983, 43(12 Pt 1):5862-5867.
[14] Papanikolaou V, Iliopoulos D, Dimou I, et al. Survivin regulation by HER2 through NF-kappaB and c-myc in irradiated breast cancer cells[J]. J Cell Mol Med, 2011, 15(7):1542-1550.
[15] Link JM, Hurlin PJ. MYC needs MNT[J]. Cell Cycle, 2013, 12(3):385-386.
[16] Polioudakis D, Bhinge AA, Killion PJ, et al. A Myc-microRNA network promotes exit from quiescence by suppressing the interferon response and cell-cycle arrest genes[J]. Nucleic Acids Res, 2013,41(4):2239-2254.
Effectsofup-regulationofc-mycexpressiononU937cellline
PAN Xiao-na, FANG Zhi-gang, LONG Zi-jie, CHEN Jia-jie, LIU Ling-ling, FAN Rui-fang, LIN Dong-jun
(DepartmentofHematology,theThirdAffiliatedHospital,SunYat-senUniversity,SunYat-senInstituteofHematology,Guangzhou510630,China.E-mail:lindongjun0168@163.com)
AIM: To establish a human monocytic leukemia cell line U937 stably expressingc-mycgene and to investigate the biological characteristics of this cell line.METHODSThe recombinant plasmid MSCV-c-myc-IRES-GFP (MMIG) was constructed. MMIG and MSCV-IRES-GFP (MIG) were used to package the viruses for infecting U937 cells. Fluorescence-activated cell sorter (FACS) was used for sorting U937/GFP and U937/MYC cells. The GFP-positive cells were detected by fluorescence microscopy and FACS. The protein expression of c-Myc, survivin, X-linked inhibitor of apoptosis protein (XIAP) and Bcl-2 was detected by Western blotting. Cell proliferation was evaluated by MTT assay. Propidium iodide (PI) staining was used to determine the cell cycle distribution. Self-renewal ability was observed by colony- forming assay.RESULTSThe GFP expression in the cells infected with MIG or MMIG virus was observed under fluorescence microscope. The green fluorescent rate of the cells infected with MIG was 26.0%, while that of the cells infected with MMIG was 27.7%. The protein expression of c-Myc in MMIG-infected U937 cells was higher than that in MIG-infected cells. After sorting, the green fluorescent rates of U937/GFP and U937/MYC cells reached 98.7% and 93.7%, respectively. The protein expression of c-Myc in U937/MYC cells was higher than that in U937/GFP cells. In addition, survivin, a downstream protein of c-Myc, was up-regulated, while the protein expression of XIAP and Bcl-2 remained unchanged. Cell cycle analysis showed that the percentage of the cells in S phase increased in U937/MYC cells. Moreover, the proliferation and colony-forming ability of U937/MYC cells were also enhanced.CONCLUSIONU937/MYC cell line stably expressingc-mycgene was successfully established. c-Myc may increase cell viability via enhancing the expression of anti-apoptotic protein survivin, the cell cycle transition and the self-renewal ability.
c-Myc protein; Vector construction; U937 cells
R733.7
A
10.3969/j.issn.1000- 4718.2013.11.012
1000- 4718(2013)11- 1984- 06
2013- 02- 19
2013- 08- 22
△通訊作者 Tel: 020-85252227; E-mail: lindongjun0168@ 163.com
▲并列第1作者

