AEG-1表達下調對人宮頸癌細胞細胞周期和侵襲能力的影響及其機制*
秦瑞英, 夏永華, 任艷芳, 潘 瑩, 楊 君, 王慧玲, 王玉紅
(新鄉醫學院第一附屬醫院 1婦產科, 2皮膚科, 河南 新鄉 453100; 3新鄉醫學院第三附屬醫院婦產科,河南 新鄉 453003)
AEG-1表達下調對人宮頸癌細胞細胞周期和侵襲能力的影響及其機制*
秦瑞英1△, 夏永華2, 任艷芳1, 潘 瑩3, 楊 君1, 王慧玲1, 王玉紅1
(新鄉醫學院第一附屬醫院1婦產科,2皮膚科, 河南 新鄉 453100;3新鄉醫學院第三附屬醫院婦產科,河南 新鄉 453003)
目的研究星形細胞上調基因1(astrocyte elevated gene-1,AEG-1)在人宮頸鱗癌細胞和組織中的表達,探討AEG-1表達下調對宮頸癌SiHa細胞細胞周期和侵襲能力的影響,并分析其可能的分子機制。方法采用Western blotting檢測正常宮頸組織、宮頸鱗癌組織、HeLa、SiHa和CaSki細胞中AEG-1蛋白的表達。將對照siRNA和AEG-1 siRNA分別轉染SiHa細胞,利用Western blotting檢測SiHa細胞中AEG-1蛋白的表達,采用流式細胞術檢測細胞周期分布的變化,采用Boyden小室檢測細胞侵襲能力的變化,最后采用Western blotting檢測cyclin D1、細胞周期素依賴性激酶 2(CDK2)和基質金屬蛋白酶9(MMP-9)蛋白表達的變化。結果宮頸鱗癌組織中AEG-1蛋白表達顯著高于正常宮頸組織(P<0.05),同時3株宮頸癌細胞中AEG-1蛋白表達均顯著高于正常宮頸組織,其中SiHa細胞中AEG-1蛋白表達最高(P<0.05)。此外,AEG-1 siRNA能顯著下調SiHa細胞中AEG-1蛋白的表達(P<0.05),其表達下調能明顯促使SiHa細胞在G0/G1期的比例增加和降低其侵襲能力。Western blotting結果表明,AEG-1 siRNA組中cyclin D1、CDK2和MMP-9蛋白的表達均顯著低于未處理組和對照siRNA組(P<0.05)。結論AEG-1在宮頸癌中的高表達可能與宮頸癌的發生發展密切相關,其表達下調介導的細胞周期靜止和侵襲能力降低可能與cyclin D1、CDK2和MMP-9蛋白表達下調密切相關。
星形細胞上調基因1; 宮頸腫瘤; 小干擾RNA; 細胞周期; 腫瘤侵襲
星形細胞上調基因1(astrocyte elevated gene-1,AEG-1)最初在人胎兒星形細胞中作為人免疫缺陷病毒1(human immunodeficiency virus type 1,HIV-1)誘導基因被鑒定[1]。在2004年,研究人員采用噬菌體篩選表明AEG-1介導的小鼠乳腺癌細胞向肺轉移,提示AEG-1與腫瘤的發生發展相關[2]。進一步研究表明,AEG-1作為癌基因已經被證實在許多人類的腫瘤中過表達,包括食管鱗癌[3]、肝癌[4]、非小細胞肺癌[5]、乳腺癌[6]、神經母細胞瘤[7]、腎癌等[8]。然而,檢索國內外文獻發現迄今為止尚未見AEG-1在宮頸癌中的研究報道,因此在本研究中,我們檢測宮頸癌細胞和組織中AEG-1蛋白的表達,并利用脂質體將AEG-1 siRNA轉染宮頸癌細胞,研究其表達下調對宮頸癌細胞周期和侵襲能力的影響,并分析AEG-1表達下調介導的細胞周期素D1(cyclin D1)、細胞周期素依賴性激酶2(cyclin-dependent kinase 2,CDK2)和基質金屬蛋白酶 9(matrix metalloproteinase-9,MMP-9)蛋白表達的變化,該研究旨在為以AEG-1為靶點的宮頸癌分子靶向治療提供理論依據。
材 料 和 方 法
1材料
人宮頸鱗癌組織和正常宮頸組織均通過病理學證實,取自新鄉醫學院第一附屬醫院,并經液氮保存備用。人宮頸癌細胞株HeLa、SiHa和CaSki購自中國典型培養物保藏中心。DMEM培養液、胰酶和胎牛血清均購自Gibco;兔多克隆抗體AEG-1、AEG-1 siRNA和對照siRNA均購自Zymed,鼠單克隆抗體cyclin D1、CDK2及MMP-9購自Santa Cruz;細胞裂解液購自寶生物工程(大連)有限公司。
2細胞培養、轉染及分組
HeLa、SiHa和CaSki細胞復蘇后置于含10%胎牛血清DMEM培養液中培養,當細胞傳代到細胞狀態穩定后,采用Western blotting檢測3株細胞中AEG-1蛋白的表達。將上述AEG-1表達量最高的SiHa細胞培養至細胞融合度為90%左右時,將AEG-1 siRNA和對照siRNA采用脂質體介導法轉染至SiHa細胞,轉染后將細胞分為3組進行相關實驗:未處理組(不作任何處理)、對照siRNA組(利用對照siRNA轉染)和AEG-1 siRNA組(采用AEG-1 siRNA轉染)。
3細胞周期分析
收集轉染后48 h的3組宮頸癌SiHa細胞,每組細胞數為1×106個。離心后采用PBS漂洗細胞3次,接著將細胞放置于4 ℃ 70%冰乙醇中固定30 min,采用預冷的PBS漂洗3次,然后重懸細胞于含40 μg碘化丙啶和100 μg RNase A的PBS溶液中,于37 ℃孵育30 min。最后用流式細胞儀檢測3組樣品中的DNA含量。
4Boyden小室體外侵襲實驗
收集轉染后48 h的3組宮頸癌SiHa細胞,每組細胞數為105個。將收集的細胞離心后分別重懸于含有0.2%的胎牛血清的800 μL的培養基中,依次接種至Boyden 小室的上層,繼續培養6 h。然后收集濾膜下層的細胞,用甲醇固定,并通過HE染色觀察下層細胞的數量,最后通過30個視野(×200)計算濾膜下層的細胞數,評估其侵襲的細胞數量。
5Westernblotting檢測蛋白的表達
收集轉染后48 h的3組宮頸癌SiHa細胞,利用細胞裂解液提取總蛋白,并采用Bradford法測定各組蛋白濃度。將50 μg總蛋白在上樣緩沖液中煮5~10 min,采用10% SDS-PAGE電泳進行蛋白分離,接著將凝膠上的蛋白轉移至硝酸纖維素膜(NC)上。將NC用含5%脫脂奶粉的TBST于室溫封閉2 h,分別加Ⅰ抗(AEG-1、cyclin D1、CDK2、MMP-9和β-actin;按1∶200稀釋)于含5%脫脂奶粉的TBST中,于4 ℃過夜孵育,接著用TBST洗膜3次,每次5 min,洗膜結束后加Ⅱ抗室溫孵育2 h,然后曝光。最后用Gene Tools軟件分析蛋白相對表達量(目的基因表達量與內參照β-actin表達量的比值)。
6統計學處理
采用統計學軟件SPSS 13.0分析,數據以均數±標準差(mean±SD)表示,3組之間比較采用單因素方差分析(One-way ANOVA),以P<0.05為差異有統計學意義。
結 果
1宮頸鱗癌組織和細胞中AEG-1蛋白表達
宮頸鱗癌組織中AEG-1蛋白表達顯著高于正常宮頸組織,且差異有統計學意義(P<0.05)。與正常宮頸組織相比,3株宮頸癌細胞系中AEG-1蛋白表達均顯著上調(P<0.05)。在所有檢測的組織和細胞中,SiHa細胞中AEG-1蛋白表達顯著高于其它各組(P<0.05),見圖1。
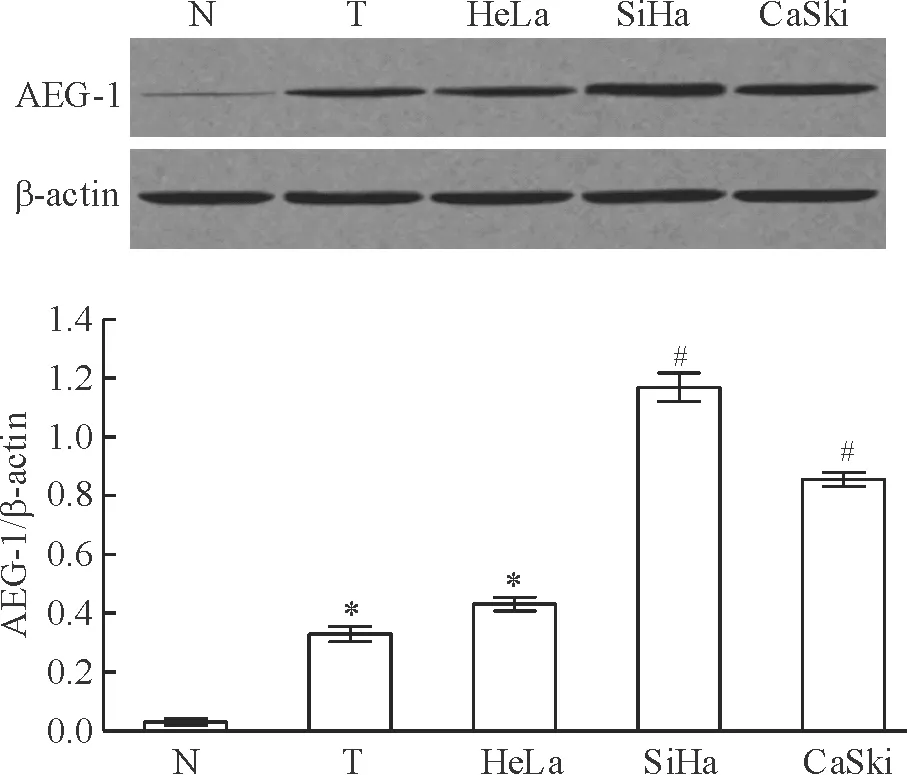
Figure 1. Expression of AEG-1 protein in cervical carcinoma tissues and cells.N: normal cervical tissues; T:cervical squamous cell carcinoma tissues.Mean±SD.n=3.*P<0.05vsN;#P<0.05vsother groups.
圖1AEG-1蛋白在宮頸鱗癌組織和細胞中的表達
2AEG-1siRNA下調宮頸癌SiHa細胞中AEG-1蛋白的表達
AEG-1 siRNA組中AEG-1蛋白表達顯著低于未處理組和對照siRNA組,差異顯著(P<0.05)。未處理組和對照siRNA組之間AEG-1蛋白表達無顯著差異(P>0.05),見圖2。
3AEG-1表達下調對宮頸癌SiHa細胞周期的影響
AEG-1 siRNA組中SiHa細胞在G0/G1期細胞的比例(59.23%±1.05%)顯著高于未處理組(42.88%±1.33%)和對照siRNA組(43.13%±0.88%)(P<0.01)。AEG-1 siRNA組中SiHa細胞在S期的比例(26.46%±0.87%)顯著低于未處理組(32.59%±1.19%)和對照siRNA組(31.83%±1.11%)(P<0.01),見表1。
4AEG-1表達下調抑制宮頸癌SiHa細胞的侵襲能力
AEG-1 siRNA組中SiHa細胞的穿膜數(43.45±4.22)顯著低于未處理組(113.34±5.15)和對照siRNA組(109.26±4.05)(P<0.01),而未處理組和對照siRNA組之間SiHa細胞的穿膜數無顯著差異(P>0.05)。
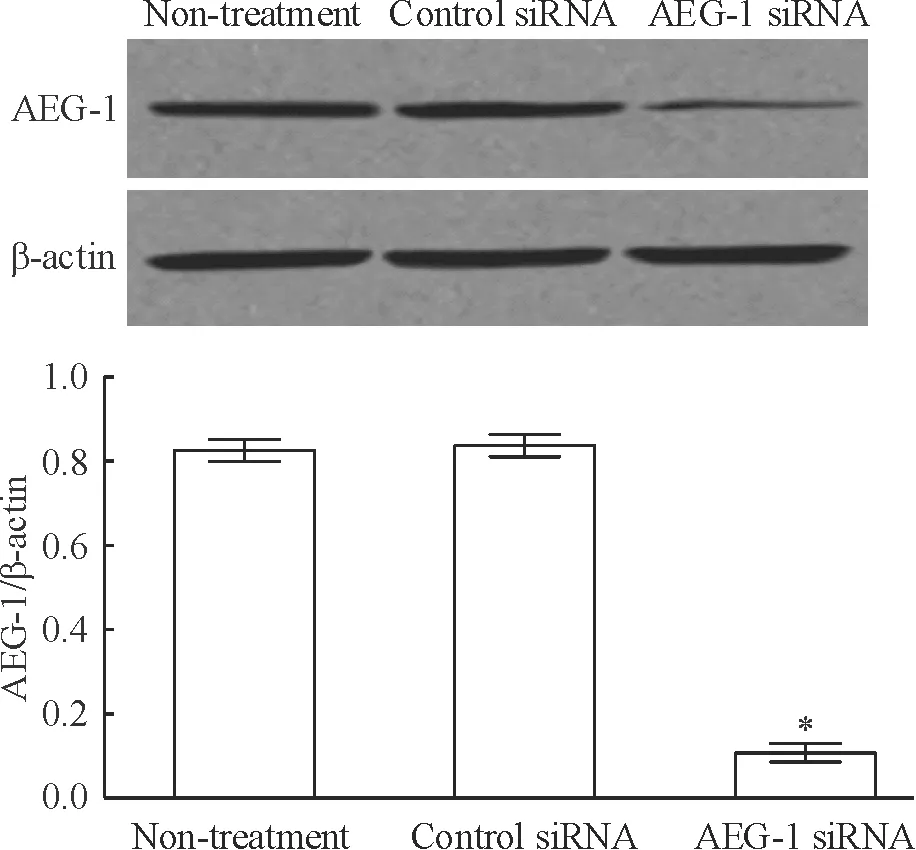
Figure 2. Expression of AEG-1 protein in cervical carcinoma SiHa cells after transfection with AEG-1 siRNA. Mean±SD.n=3.*P<0.05vsnon-treatment or control siRNA.
圖2轉染AEG-1siRNA后宮頸癌SiHa細胞AEG-1蛋白的表達
表1AEG-1表達下調對宮頸癌SiHa細胞周期的影響
Table 1. Effect of down-regulation of AEG-1 expression on cell cycle of cervical carcinoma SiHa cells (%.Mean±SD.n=3)
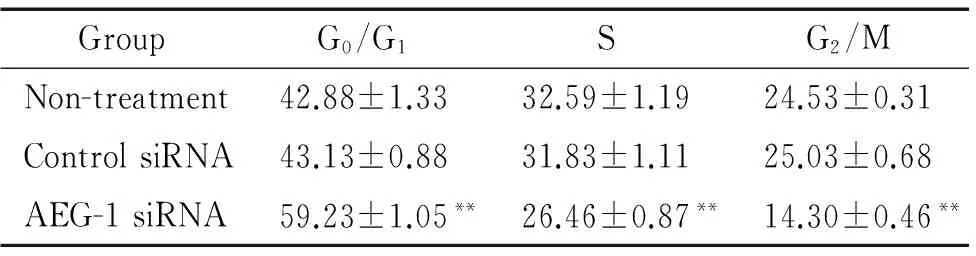
GroupG0/G1SG2/MNon-treatment42.88±1.3332.59±1.1924.53±0.31ControlsiRNA43.13±0.8831.83±1.1125.03±0.68AEG-1siRNA59.23±1.05**26.46±0.87**14.30±0.46**
**P<0.01vscontrol siRNA.
5Westernblotting檢測cyclinD1、CDK2和MMP-9的表達
AEG-1 siRNA組中cyclin D1、CDK2和MMP-9蛋白的表達均顯著低于未處理組和對照siRNA組(P<0.05),而未處理組和對照siRNA組之間cyclin D1、CDK2和MMP-9蛋白的表達無顯著差異(P>0.05),見圖3。
討 論
近幾年來,AEG-1在腫瘤中的作用日益成為廣大科研工作者關注的對象,可能成為腫瘤潛在的預后指標和分子靶點[9]。研究顯示,AEG-1牽涉腫瘤發展過程中的多種細胞生物學過程,包括:細胞存活、血管生成、侵襲、轉移、凋亡和化療抗性[4, 10-12]。最初對于AEG-1與腫瘤關系的研究集中在乳腺癌、神經膠質瘤和前列腺癌中[6, 11, 13]。在乳腺癌中,AEG-1的表達水平與乳腺癌的臨床階段和TNM分期密切相關,可能是乳腺癌潛在的預后指標[6]。通過拷貝數的變化和基因表達相關性分析,AEG-1已經被鑒定作為轉移相關基因,其過表達有助于乳腺癌中的基因組擴增[14]。在食管鱗癌、非小細胞肺癌和肝癌的研究中發現AEG-1水平上調與病人的臨床分期和較差的預后相關[3-5],因而進一步提示AEG-1可能在不同類型的腫瘤中作為癌基因而發揮其相應的生物學功能。在本研究中,我們檢測了正常宮頸組織、宮頸鱗癌組織和3株宮頸癌細胞中AEG-1蛋白的表達,發現宮頸鱗癌組織中AEG-1蛋白的表達顯著高于正常宮頸組織,并且3株宮頸癌細胞中AEG-1蛋白的水平也明顯高于正常宮頸組織,提示AEG-1可能在宮頸鱗癌的發生發展過程中發揮重要的作用,但其確切的分子機制和表達模式尚需進一步探討。

Figure 3. Down-regulation of AEG-1 expression inhibited the expression of cyclin D1, CDK2 and MMP-9 proteins in cervical carcinoma SiHa cells.Mean±SD.n=3.*P<0.05vsnon-treatment or control siRNA.
圖3AEG-1表達下調抑制宮頸癌SiHa細胞中cyclinD1、CDK2和MMP-9的表達
許多研究支持AEG-1通過激活增殖途徑和抗凋亡效應促進腫瘤細胞的增殖[11, 15]。在前列腺癌和乳腺癌中的研究表明,AEG-1表達上調與細胞周期抑制子表達的下調密切相關,從而導致細胞增殖加速[11, 15]。此外,Liu等[16-17]研究證實,在神經母細胞瘤中,AEG-1表達下調能誘導細胞周期靜止在G0/G1期,從而抑制腫瘤的增殖。為了進一步分析AEG-1在宮頸癌中的功能,我們選擇AEG-1表達量最高的SiHa細胞作為研究對象,利用AEG-1 siRNA轉染SiHa細胞,結果表明AEG-1 siRNA轉染后48 h,AEG-1蛋白表達顯著下調,這為進一步研究AEG-1在宮頸癌中的功能提供理想的研究平臺。進一步我們采用流式細胞術分析轉染前后SiHa細胞周期分布的變化,我們發現AEG-1 siRNA組中SiHa細胞在G0/G1期的比率顯著高于未處理組和對照siRNA組,而S期的比率顯著高于未處理組和對照siRNA組,提示AEG-1表達下調通過靜止細胞周期在G0/G1期,從而抑制宮頸癌細胞的增殖。進一步我們分析與細胞周期密切相關的cyclin D1和cdk2蛋白的表達,AEG-1 siRNA轉染后cyclin D1和cdk2蛋白的表達均顯著下調,這一結果提示AEG-1介導的宮頸癌細胞周期靜止可能與細胞周期相關蛋白cyclin D1和cdk2表達下調密切相關。
對于AEG-1對腫瘤細胞的生物學功能和惡性表型的影響已經成為腫瘤生物學領域研究的熱點,最初的證據表明AEG-1過表達有助于乳腺癌細胞向肺轉移[2],這一點進一步被后來的體內實驗所證實[14]。此外,AEG-1被證實能促進腫瘤的侵襲和轉移,Liu等[18]研究表明,AEG-1促進神經膠質瘤細胞的侵襲。為了探討AEG-1與宮頸癌細胞侵襲的關系,我們采用Boyden小室檢測了轉染AEG-1 siRNA前后宮頸癌SiHa細胞侵襲能力的變化,結果顯示AEG-1 siRNA組中宮頸癌SiHa細胞穿膜數顯著低于未處理組和對照siRNA組,提示AEG-1表達下調能顯著降低宮頸癌細胞的侵襲能力。眾所周知,MMP-9是一種廣泛被研究的基質金屬蛋白酶家族的成員之一,是腫瘤侵襲和轉移過程中侵襲細胞的ECM降解和細胞因子活化所必需的因子[19]。研究發現AEG-1能直接靶向和反式激活MMP-9基因的啟動子,從而抑制腫瘤的侵襲能力[18]。基于此,我們也在宮頸癌細胞中檢測轉染AEG-1 siRNA前后MMP-9蛋白的表達,結果發現AEG-1表達下調能明顯引起MMP-9的下調,但其在宮頸癌中確切的分子作用機制尚需要進一步探討,但我們的結果可以初步表明AEG-1表達下調介導的侵襲能力降低可能與MMP-9蛋白表達下調密切相關。
總之,我們這里呈現的結果顯示,AEG-1表達下調能顯著靜止宮頸癌細胞周期和降低宮頸癌細胞侵襲能力,這可能與cyclin D1、CDK2和MMP-9表達下調密切相關,后續進一步研究AEG-1在宮頸癌發生發展中的分子機制有望為宮頸癌的分子靶向治療提供新的實驗依據。
[1] Su ZZ, Chen Y, Kang DC, et al. Customized rapid subtraction hybridization (RaSH) gene microarrays identify overlapping expression changes in human fetal astrocytes resulting from human immunodeficiency virus-1 infection or tumor necrosis factor-α treatment[J]. Gene, 2003, 306: 67-78.
[2] Brown DM, Ruoslahti E. Metadherin, a cell surface protein in breast tumors that mediates lung metastasis[J]. Cancer Cell, 2004, 5(4): 365-374.
[3] Yu C, Chen K, Zheng H, et al. Overexpression of astrocyte elevated gene-1 (AEG-1) is associated with esophageal squamous cell carcinoma (ESCC) progression and pathogenesis[J]. Carcinogenesis, 2009, 30(5): 894-901.
[4] Yoo BK, Emdad L, Su ZZ, et al. Astrocyte elevated gene-1 regulates hepatocellular carcinoma development and progression[J]. J Clin Invest, 2009, 119(3): 465-477.
[5] Song L, Li W, Zhang H, et al. Over-expression of AEG-1 significantly associates with tumour aggressiveness and poor prognosis in human non-small cell lung cancer[J]. J Pathol, 2009, 219(3): 317-326.
[6] Li J, Zhang N, Song LB, et al. Astrocyte elevated gene-1 is a novel prognostic marker for breast cancer progression and overall patient survival[J]. Clin Cancer Res, 2008, 14(11): 3319-3326.
[7] Lee SG, Jeon HY, Su ZZ, et al. Astrocyte elevated gene-1 contributes to the pathogenesis of neuroblastoma[J]. Oncogene, 2009, 28(26): 2476-2484.
[8] Chen W, Ke Z, Shi H, et al. Overexpression of AEG-1 in renal cell carcinoma and its correlation with tumor nuclear grade and progression[J]. Neoplasma, 2010, 57(6): 522-529.
[9] Ying Z, Li J, Li M. Astrocyte elevated gene 1: biological functions and molecular mechanism in cancer and beyond[J]. Cell Biosci, 2011, 1: 36.
[10] Lee SG, Su ZZ, Emdad L, et al. Astrocyte elevated gene-1 activates cell survival pathways through PI3K-Akt signaling[J]. Oncogene, 2008, 27(8): 1114-1121.
[11] Kikuno N, Shiina H, Urakami S, et al. Knockdown of astrocyte-elevated gene-1 inhibits prostate cancer progression through upregulation of FOXO3a activity[J]. Oncogene, 2007, 26(55): 7647-7655.
[12] 劉海燕,宋現讓,鄭愛青,等. Astrocyte elevated gene-1的研究進展[J]. 中國病理生理雜志,2010,26(1):188-192.
[13] Emdad L, Sarkar D, Su ZZ, et al. Astrocyte elevated gene-1: recent insights into a novel gene involved in tumor progression, metastasis and neurodegeneration[J]. Pharmacol Ther, 2007, 114(2): 155-170.
[14] Hu G, Chong RA, Yang Q, et al. MTDH activation by 8q22 genomic gain promotes chemoresistance and metastasis of poor-prognosis breast cancer[J]. Cancer Cell, 2009, 15(1): 9-20.
[15] Li J, Yang L, Song L, et al. Astrocyte elevated gene-1 is a proliferation promoter in breast cancer via suppressing transcriptional factor FOXO1[J]. Oncogene, 2009, 28(36): 3188-3196.
[16] Liu H, Song X, Liu C, et al. Knockdown of astrocyte elevated gene-1 inhibits proliferation and enhancing chemo-sensitivity to cisplatin or doxorubicin in neuroblastoma cells[J]. J Exp Clin Cancer Res, 2009, 28: 19.
[17] 劉海燕,姜玉杰,孫若鵬. siRNA下調astrocyte elevated gene-1 對神經母細胞瘤細胞增殖和凋亡影響的體外研究[J]. 中國病理生理雜志,2011,27(4):705-711.
[18] Liu L, Wu J, Ying Z, et al. Astrocyte elevated gene-1 upregulates matrix metalloproteinase-9 and induces human glioma invasion[J]. Cancer Res, 2010, 70(9): 3750-3759.
[19] Kessenbrock K, Plaks V, Werb Z. Matrix metalloproteinases: regulators of the tumor microenvironment[J]. Cell, 2010, 141(1): 52-67.
Effectsofdown-regulationofAEG-1expressiononcellcycleandinvasionofhumancervicalcarcinomacells
QIN Rui-ying1, XIA Yong-hua2, REN Yan-fang1, PAN Ying3, YANG Jun1, WANG Hui-ling1, WANG Yu-hong1
(1DepartmentofObstetrics&Gynecology,2DepartmentofDermatology,TheFirstAffiliatedHospitalofXinxiangMedicalUniversity,Xinxiang453100,China;3DepartmentofObstetricsandGynecology,TheThirdAffiliatedHospitalofXinxiangMedicalUniversity,Xinxiang453003,China.E-mail:qinruiying666@163.com)
AIM: To investigate the effects of down-regulation of astrocyte elevated gene-1 (AEG-1) expression on cell cycle and invasion of human cervical carcinoma SiHa cells.METHODSThe protein expression of AEG-1 was detected by Western blotting in normal cervical tissues, cervical squamous cell carcinoma tissues, HeLa cells, SiHa cells and CaSki cells. Control siRNA or AEG-1 siRNA was transfected into SiHa cells, and the protein expression of AEG-1 in SiHa cells was detected by Western blotting. The changes of cell cycle distribution and cell invasion were determined by flow cytometry and Boyden chamber, respectively. The protein levels of cyclin D1, cyclin-dependent kinase 2(CDK2) and matrix metalloproteinase-9 (MMP-9) were analyzed by Western blotting.RESULTSThe protein expression of AEG-1 in cervical squamous cell carcinoma tissues was significantly higher than that in normal cervical tissues (P<0.05). Meanwhile, the protein expression of AEG-1 in the 3 cervical carcinoma cell lines was obviously higher than that in normal cervical tissues, in which SiHa cells displayed the highest AEG-1 protein level (P<0.05). In addition, AEG-1 siRNA effectively down-regulated the protein expression of AEG-1 in SiHa cells, which led to increase the percentage at G0/G1phase and reduced the invasion of SiHa cells. Furthermore, the protein levels of cyclin D1, CDK2 and MMP-9 in AEG-1 siRNA group were markedly lower than those in non-treatment group and control siRNA group (P<0.05).CONCLUSIONOver-expression of AEG-1 may be closely associated with the occurrence and development of cervical carcinoma, and the AEG-1 down-regulation-mediated cell cycle arrest and attenuation of invasion may be tightly related to the down-regulations of cyclin D1, CDK2 and MMP-9 at protein levels.
Astrocyte elevated gene-1; Uterine cervical neoplasms; Small interfering RNA; Cell cycle; Neoplasm invasiveness
R737.33
A
10.3969/j.issn.1000- 4718.2013.06.011
1000- 4718(2013)06- 1020- 05
2012- 12- 03
2013- 03- 26
河南省衛生廳科技攻關項目(No. 200802009); 河南省教育廳自然科學研究計劃項目(No. 2008A320011)
△通訊作者 Tel: 0373-4404665; E-mail: qinruiying666@163.com

