硫酸酸解攀西鈦精礦技術研究
馬維平
(攀鋼集團研究院有限公司,釩鈦資源綜合利用國家重點實驗室,四川攀枝花 617000)
硫酸法可用于生產銳鈦礦型和金紅石型鈦白粉。由于其工藝成熟、設備簡單、對鈦礦的要求不高、原料來源充沛,所以至今仍應用廣泛。截至“十一五”末,中國已成為世界第一大鈦白生產和消費國,年產能達230萬t,產量為147.4萬t,共有鈦白粉生產企業70余家,其中98%的生產企業采用硫酸法鈦白生產工藝。酸解鈦礦是硫酸法鈦白生產的第一步,根據酸解方式不同,酸解分為間歇和連續兩種方法[2]。國內外大部分生產廠家采用間歇法酸解工藝[3]。依據參與反應的硫酸濃度和最終反應產物的狀態,酸解又可分為液相法、固相法、兩相法。酸解是制備鈦白粉流程的關鍵步驟之一,不僅影響鈦的收率,而且關系著鈦白粉質量的優劣。因此對硫酸法鈦白生產中酸解技術的研究受到高度的重視。
1 實驗條件及方法
1.1 實驗條件
四川省攀西地區擁有96.6億t釩鈦磁鐵共生礦資源,其中鈦資源量(以TiO2計)為8.7億t,占中國已探明儲量的90%以上。實驗原料選用攀西鈦精礦,其主要化學組成如表1所示。
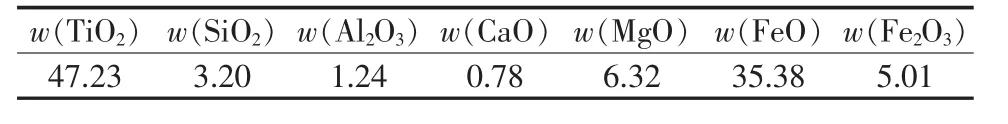
表1 攀西鈦精礦化學組成 %
1.2 實驗方法
硫酸酸解鈦精礦的工藝流程:將計量好的硫酸與鈦鐵礦(FeTiO3·Fe2O3)依次放入預混合容器中制得懸浮液,移入酸解釡中,在壓縮空氣攪拌下,加入工藝水啟動酸解反應,生成硫酸氧鈦、硫酸鈦等硫酸鹽,經熟化后用工藝水或廢酸浸出,另用鐵屑或鐵粉將Fe3+還原成Fe2+,直至將部分Ti4+還原成Ti3+。當Ti3+含量達到工藝要求時,即為制得合格鈦液。
2 實驗結果與討論
2.1 酸解工藝原理
含鈦礦物的酸解是通過酸解反應將礦物中的鈦和鐵溶解反應成可溶性硫酸鹽。硫酸法生產鈦白粉的天然原料是鈦精礦。用硫酸分解鈦鐵礦時所發生的主要化學反應:
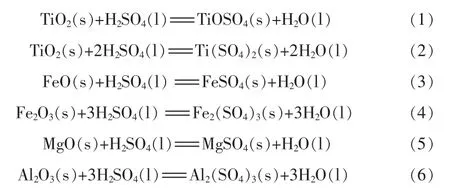
硫酸分解鈦精礦是一個復雜的多相化學反應過程。鈦精礦中的鈣和硅難以與硫酸作用,鐵鎂鋁等金屬元素則按一般的堿性氧化物與硫酸發生反應。鈦精礦的酸分解產物 TiOSO4和 Ti(SO4)2同時存在,另外其他四價鈦的硫酸鹽也會存在。
2.2 各因素對酸解率的影響
1)硫酸濃度。反應酸濃度是影響酸解率的關鍵指標,實驗中通過向98%(質量分數)硫酸中加入不同量的稀釋水來調節反應酸濃度。固定其他條件,考察了硫酸濃度對鈦酸解結果的影響,如圖1所示。由圖1可見,酸解率隨著硫酸濃度的增加先升高后降低。當w(硫酸)=85%時,酸解率高達95%。酸解率隨硫酸濃度的增加而增加,這主要是因為H+和濃度增加,其接觸鈦精礦粉表面的幾率增大,使H+、對偶極作用和固體表面的作用力加強,進而促使鈦精礦的分解速度加快;然而硫酸濃度越高,H+活性越低[4],當 w(硫酸)>85%后,鈦精礦酸解率隨著酸濃度的增加而降低。綜合考慮,實驗選擇適宜的硫酸濃度為85%。
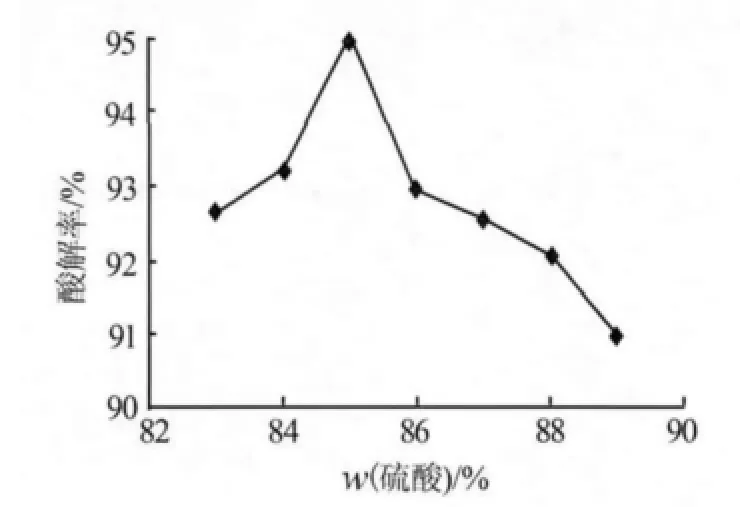
圖1 硫酸濃度對酸解率的影響
2)酸礦比(100%酸與礦的質量比)。加入定量啟動水使w(硫酸)=85%,在此條件下考察酸礦質量比對酸解率的影響,如圖2所示。由圖2可知,酸礦比越高,酸解率也越高。在酸礦質量比為1.58∶1時,鈦精礦的酸解率已達到較高水平,再增大酸礦比酸解率升高趨勢不明顯。此外,過大的酸礦比不僅會使下一工序水解困難,還會增加生產成本。
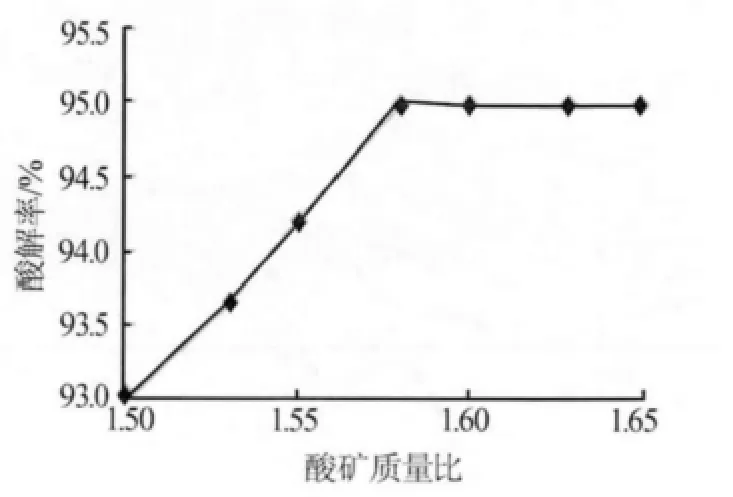
圖2 酸礦比對酸解率的影響
根據鈦精礦成分,酸解生成硫酸氧鈦的理論酸礦質量比為1.34∶1,全部生成硫酸鈦的理論酸礦質量比為1.92∶1,則按1.58∶1酸礦化酸解后產物硫酸氧鈦與硫酸鈦的質量比接近1∶1。
對鈦精礦的酸解反應物進行殘渣物相分析,進一步考察酸解產物情況,如圖3所示。
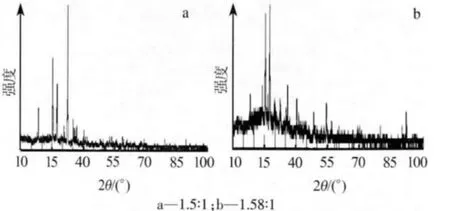
圖3 不同酸料比下鈦精礦酸解殘渣衍射譜圖
由圖3可見,在酸料質量比為1.5∶1時,反應浸出渣主要物相為 FeTiO3、(FeMg)(TiFe)O3,說明鈦精礦酸解不完全,硫酸的用量不足;在酸料質量比為1.58∶1時,反應浸出渣主要物相為 CaSiO3和 SiO2,說明鈦精礦酸解反應較完全,硫酸用量足夠。綜合經濟成本與酸解率等因素考慮,選擇適宜的酸料質量比為 1.58∶1。
3)熟化時間。在間歇式酸解生產過程中,恰當的熟化時間可使酸解率提升5%~10%。在w(硫酸)=85%、酸料質量比為1.58∶1的條件下,實驗考察了熟化時間對酸解率的影響,如圖4所示。由圖4可知,熟化時間對酸解率的影響顯著。熟化時間小于180 min時,酸解率提升幅度很大,此時酸解率大于95%;而超過180 min后,酸解率變化平緩。主要原因是酸解主反應一旦結束,反應產物將固化成固體。雖然在形成的固體內部有局部未反應的微小液體硫酸和礦粒,但是由于固化產物的存在,致使其傳質速率非常緩慢,只有足夠的時間才能使其相互接觸,繼續反應。但反應完成后繼續增加熟化時間對酸解率的影響很小,且會延長生產周期,影響產能。綜合考慮,實驗選擇適宜的熟化時間為180 min。
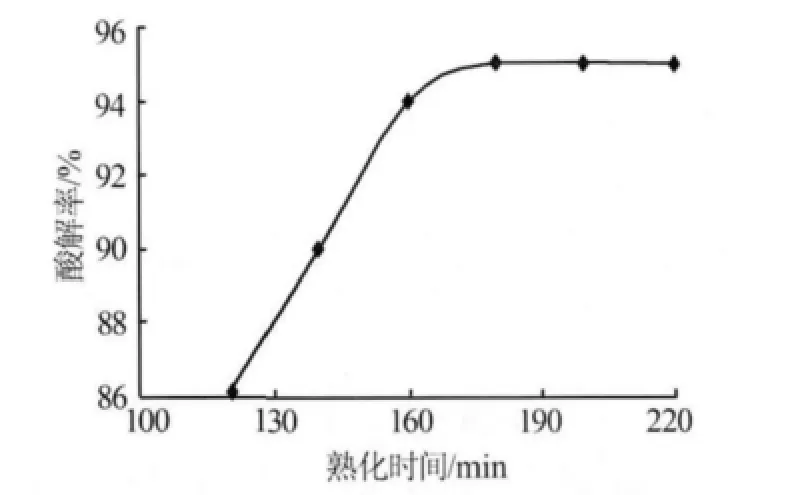
圖4 熟化時間對酸解率的影響
2.3 酸解熱量計算
鈦精礦酸解反應的放熱量和吸熱量計算遵循如下條件:1)按照100 g鈦精礦計算;2)反應產物比熱容采用固定值 1.008 J/(g·℃);3) 酸礦質量比為 1.58∶1,w(硫酸)=85%。表2為酸解熱量計算結果。
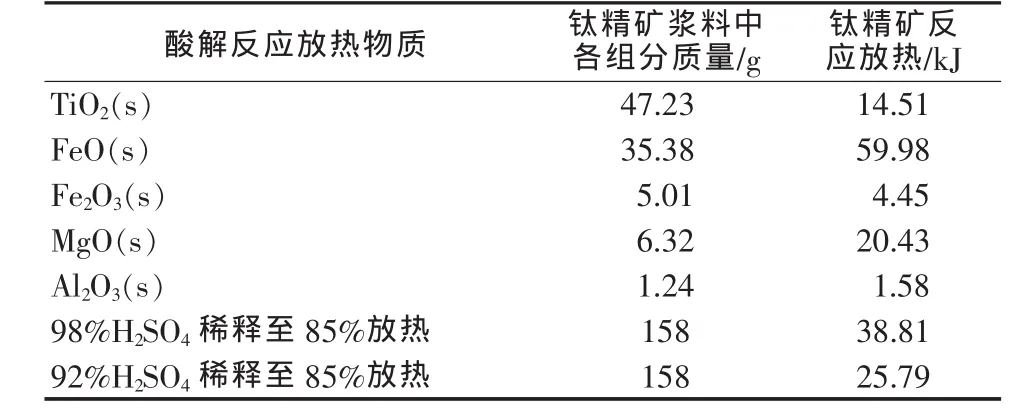
表2 硫酸酸解鈦精礦熱量及反應產物吸熱量計算結果
由表2計算可知,100 g鈦精礦酸解反應加硫酸稀釋(98%至85%)總放熱量為139.76 kJ,即反應加稀釋熱總熱量為1397.6 kJ/kg。此熱量能夠將反應產物加熱到321℃,此時反應劇烈,冒鍋幾率大,危險系數高。而采用92%硫酸然后加水稀釋至85%,其稀釋熱與反應放熱總量為1267.4 kJ/kg,能將反應產物加熱到271℃,反應相對于98%硫酸稀釋溫和一些,且其總熱量完全滿足酸解反應的需求,攀西鈦精礦酸解只需加啟動水引發反應即可自發進行。
3 結論
1)當硫酸質量分數為85%時,攀西鈦精礦的酸解率較高;2)酸解時酸礦質量比為1.58∶1較理想;3)熟化時間為180 min時,既可以提高酸解率又不會影響生產周期;4)鈦精礦酸解反應中,直接用98%的硫酸引發反應時,反應劇烈易發生冒鍋現象,危險系數大。若采用92%硫酸在酸解釡中引發,其總熱量完全能夠滿足反應需求,相對比較安全。
[1]景建林.硫酸法鈦白液相酸解的實驗研究[D].成都:四川大學碩士學位論文,2003.
[2]鄒建新,楊成,彭富昌.我國鈦白生產技術現狀與發展趨勢[J].稀有金屬快報,2007,26(4):7-12.
[3]景建林,張全忠,張允奎,等.硫酸法鈦白液相連續酸解的基礎研究[J].四川化工與腐蝕控制,2002,5(5):1-4.
[4]吳飛翔,李新海,王志興,等.攀枝花鈦鐵礦固相酸解和浸出試驗研究[J].濕法冶金,2010,29(2):88-91.

