UniCel DXI800全自動磁性微粒子化學發光免疫分析系統性能評價
肖 翔,張偉龍,潘理想,張達秀
(廣東省東莞市塘廈醫院檢驗科 523721)
DXI800是美國Beckman公司推出的全自動磁性微粒子化學發光免疫分析系統,根據檢測項目的不同,其檢測方法分為競爭法和雙抗體夾心法兩種,其中每種方法又分為一步法和兩步法。根據ISO15189和美國CAP的要求,新的檢測系統在用于臨床標本的檢測之前需要對其分析性能進行評價。本研究在每一種檢測方法中選擇一個項目作為代表(雌二醇為兩步競爭法、促卵泡生成素為兩步夾心法、泌乳素為一步夾心法、三碘甲狀腺原氨酸為一步競爭法),應用臨床和實驗室標準化協會(CLSI)頒布的《臨床實驗室定量檢測試驗的初步評價批準指南》第2版(EP10-A2)對這4個項目的分析性能進行初步評價。
1 材料與方法
1.1 試驗標本 伯樂公司生產的Lyphochek免疫分析質控物高、低兩個水平的質控品,高值質控品(批號40253,有效期2014年2月28日),低值質控品(批號40251,有效期2014年2月28日),中值質控品由高值質控品和低值質控品等比例混合而成。雌二醇(E2)均值:高值650pg/mL,低值150pg/mL。促卵泡生成素(FSH)均值:高值6.58mIU/mL,低值42mIU/mL。泌乳素(PRL)均值:高值4.7ng/mL,低值33ng/mL。三碘甲狀腺原氨酸(TT3)均值:高值0.96ng/mL,低值3.15 ng/mL。
1.2 儀器與試劑
1.2.1 儀器 美國Beckman公司Unicel DXI800全自動磁性微粒子化學發光免疫分析儀。
1.2.2 試劑與校準品 試劑和校準品都使用美國Beckman公司的產品,E2試劑批號017612,有效期至2012年3月12日,校準品批號919196;FSH試劑批號019511,有效期至2012年2月21日,校準品批號011716;PRL試劑批號023640,有效期至2012年2月28日,校準品批號018583;TT3試劑批號023640,有效期至2012年2月28日,校準品批號018583。
1.3 方法
1.3.1 在開始試驗之前,參加試驗操作的人員必須進行儀器的操作培訓并熟練掌握儀器的檢測操作、日常維護保養和常見故障的排除等技能,熟悉性能驗證方案。
1.3.2 開始試驗之前按照廠家說明使用校準品校準檢測系統,在整個試驗過程不應該對檢測系統進行再校準。在整個試驗過程中按照廠家說明進行日常維護和保養。
1.3.3 根據試驗要求計算試驗樣品的用量,嚴格按照質控品說明書的規定溶解質控品。并按照1∶1的比例用高值質控品和低值質控品配制出中值質控品。一次性溶解和配制出整個試驗所需的試驗樣品用量,避免溶解質控品過程帶來的誤差。
1.3.4 將高、中、低3個水平的質控品上機檢測,檢測順序為中、高、低、中、中、低、低、高、高、中(其中第一個中值標本為試驗啟動的灌注樣品,其值不進行統計分析),這個順序不應該改變、插入或中斷。無論何種原因,如果最后的9個標本中任何一個被拒絕、丟失或沒有報告,整個過程需要重做。按照上述順序連續測定5d,得到高、中、低值各15個。
1.3.5 每天試驗結束后都需要對數據進行初步判斷,看是否有明顯的離群點,若有需要盡最大努力找出原因,繼續試驗。
1.3.6 偏倚和總不精密度的判斷使用基于生物學變異的質量規范[1]。(1)允許偏倚:E2、FSH、PRL、TT3 4個項目的允許偏倚分別為8.3%、7.8%、15.4%、4.2%。(2)允許總不精密度:E2、FSH、PRL、TT3 4個項目的允許總不精密度分別為11.3%、5.1%、3.5%、4.4%。(3)截距、斜率、攜帶污染率、非線性、線性漂移:計算所得的校正值進行t檢驗,t檢驗值介于-4.6到4.6之間表示無統計學意義,可接受。
1.4 統計學方法 每天的原始數據記錄在EP10-A2文件提供的原始數據記錄表上,錄入Excel軟件進行統計學分析。
2 結 果
2.1 總不精密度 根據EP10-A2提供的計算表格和公式計算總不精密度,4個項目的總不精密度結果見表1和表2。
2.2 偏倚分析 計算各濃度試驗樣品5d檢測結果的均值,以廠商提供的各濃度質控品的均值為靶值,計算二者的差值,再計算差值的百分偏倚,結果見表1和表2。
2.3 截距、斜率、非線性、攜帶污染率、線性漂移的回歸分析結果見表3和表4。
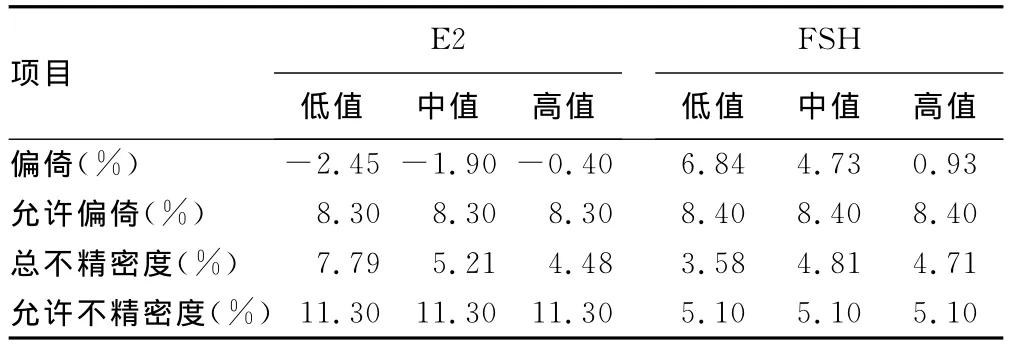
表1 E2和FSH總不精密度和偏倚計算

表2 PRL和TT3總不精密度和偏倚計算
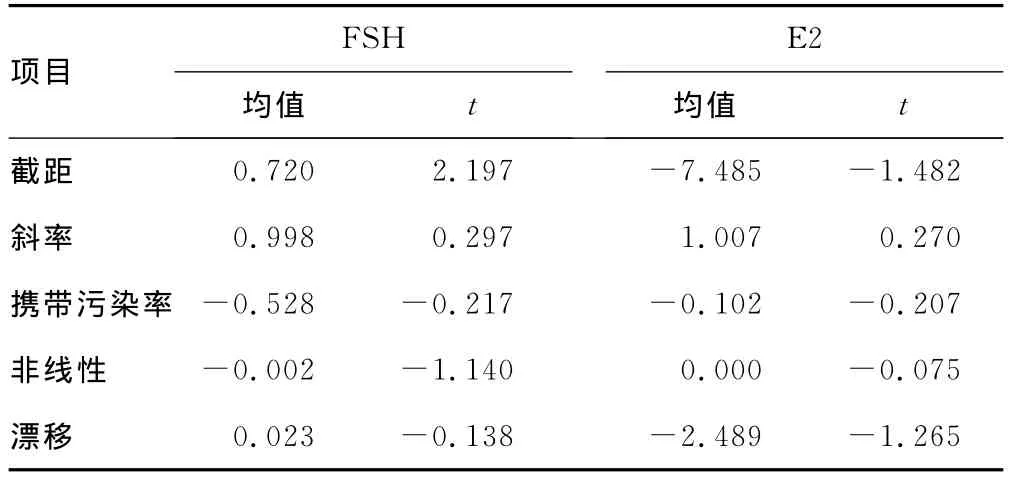
表3 E2和FSH截距、斜率、攜帶污染率、非線性、漂移計算
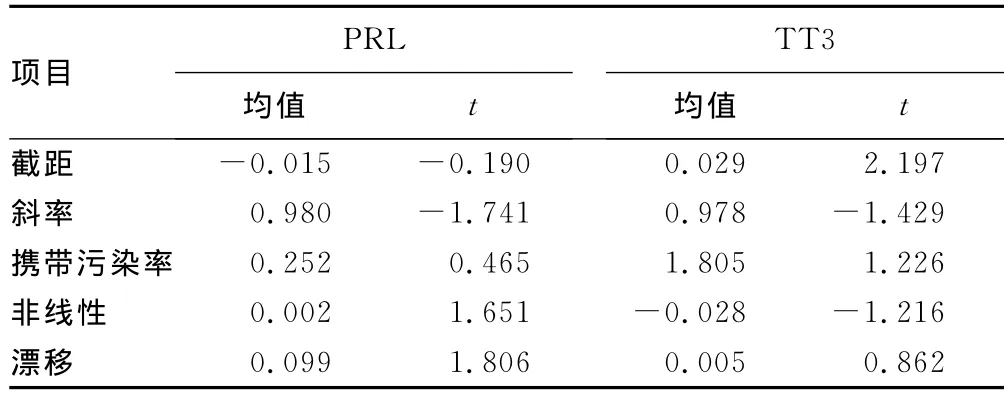
表4 PRL和TT3截距、斜率、攜帶污染率、非線性、漂移計算
3 討 論
近年來隨著實驗室認可的發展,質量意識已經深入廣大檢驗人的心中,根據ISO15189的規定實驗室應評估所選方法和程序,在用于醫學檢驗之前應證實其可給出滿意的結果,因此在新的分析系統實施臨床標本的檢測之前需要對其分析性能進行評價[2-5]。本文的研究對象DXI800是新購入的配套檢測系統,廠家在出廠之前已經對其進行了嚴格的分析性能評價,其性能參數已通過試劑說明書給出。實驗室如果再使用EP5-A、EP9-A等文件來對分析系統的精密度和準確度等性能指標進行評價就會延長分析系統投入使用的時間,且試驗過程需要耗費大量的人力和物力。EP10-A2提供了一個具有操作簡單、時間短、評價參數多的試驗方案,可以快速地對分析系統的分析性能進行初步評價,可以縮短分析系統投入使用的周期。
在使用EP10-A2進行檢測系統性能的初步評價時,需要嚴格按照廠家的說明書進行操作,因為中值質控品是通過高值和低值質控品等比例混合而成的,且混合后的理論值將作為靶值使用,故在混合的時候特別需要注意吸樣體積的準確。在開始試驗之前應該根據試驗的需要計算出試驗樣品的用量,最好能多制備一些以便在出現離群值時重復測試。如果使用溶解干粉質控品最好在穩定期內一次性溶解足夠的量,避免溶解質控品帶來的誤差。如果使用液體質控品最好統一每次溶解的時間、溫度和復溶操作。
本文的研究對象為配套檢測系統,且為新品,通過EP10-A2方案對其進行初步性能評價后證實了廠家試劑說明書介紹的分析性能,滿足本科室規定的質量要求。分析系統在使用過程中應該按照廠家的建議制定和執行維護保養,定期對分析系統的性能進行驗證。
[1] 楊有業,張修明.臨床檢驗方法學評價[M].北京:人民衛生出版社,2008:59-66.
[2] 王佳,蔡新.Unicel DIX800全自動微粒子化學發光免疫分析系統性能評價[J].臨床檢驗雜志,2008,26(2):157-158.
[3] 吳躍軍,姚莉.同一實驗室2臺DXI800化學發光儀6個常規項目的偏倚評估及應用分析[J].國際檢驗醫學雜志,2012,33(3):360-362.
[4] 李觀強,葉應嫵,萬彥彬,等.某型號免疫分析儀甲胎蛋白分析性能驗證[J].國際檢驗醫學雜志,2011,32(13):1502-1504.
[5] 王瑜敏.應用EP10-A初步評價DXI800發光分析儀性能[J].中國衛生檢驗雜志,2010,20(9):3229-3230.

